云南省蓝舌病病毒血清7型毒株的分离与基因组序列分析
李占鸿,宋子昂,廖德芳,杨振兴,谢佳芮,高 翔,胡忠燕,李卓然,李华春*,杨 恒*
(1.云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,昆明 650224;2.云南农业大学动物医学院,昆明 650201;3.云南省景洪市动物疫病预防控制中心,景洪 666100)
动物蓝舌病(bluetongue,BT)是反刍动物的一种烈性传染病,其病原蓝舌病病毒(bluetongue virus,BTV)主要通过库蠓(Culicoidesspp.)传播,可感染牛、羊、鹿和骆驼等多种家养与野生反刍动物。BT的暴发、流行严重危害牛羊养殖业,造成严重的经济损失的同时,还会制约牛、羊出口贸易,影响畜产品国际贸易[1]。2006年,非洲来源的BTV-8型毒株侵入欧洲,给欧洲各国的牛、羊养殖业带来巨大的经济损失[2-3]。世界动物卫生组织(OIE)将BT列为法定报告的动物疫病,我国也将其列为一类动物疫病。
BTV属呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus),其基因组为双链RNA(dsRNA),由Seg-1到Seg-10 10个基因节段构成,约20 kb,可编码VP1~VP7等7种结构蛋白以及NS1、NS2、NS3、NS3a与NS4等5种非结构蛋白[4-5]。BTV病毒粒子由内部核心、内层衣壳与外层衣壳3个部分构成:内部核心由Seg-1编码的RNA依赖RNA聚合酶(VP1蛋白)、Seg-4编码的加帽酶(VP4蛋白)、Seg-9编码的解旋酶(VP6蛋白)与基因组dsRNA组成;内层衣壳由Seg-3与Seg-7编码的VP3与VP7蛋白共同构成,其氨基酸序列高度保守,VP7蛋白是诱导产生BTV群特异性抗体的主要蛋白;外层衣壳由Seg-2与Seg-6编码的VP2与VP5蛋白构成,该部分氨基酸序列高度变异,其中VP2是诱导中和抗体的主要蛋白,决定BTV的血清型,VP5可通过影响VP2蛋白的构象间接影响中和抗体的产生[4-5]。BTV各个基因节段构建的系统发生树显示,不同国家/地区的分离的BTV毒株分为东方型 (Eastern)与西方型 (Western)两种地域型[6]。
目前,世界范围已报道了28种血清型的BTV(BTV-1至BTV-28)[7-8],不同血清型BTV的分布范围不同,对动物的致病性也存在较大差异。BTV-7型主要流行于非洲与澳大利亚,目前,对该血清型毒株在易感动物上的致病性尚不完全清楚。我国BTV-7型毒株于2014年首次分离于广东省汕头市设置的哨兵牛中[9],全基因组测序结果显示,该毒株的Seg-1、-2、-3、-4与-6属Western型,与非洲BTV毒株具有最近的亲缘关系;而Seg-5、-7、-8、-9与-10属Eastern型,与中国流行BTV毒株序列相似度最高,表明非洲来源的BTV侵入了我国,在其传播过程中与中国流行毒株通过基因重配(reassortment)产生了变异毒株[10]。
目前GenBank中仅公布了3株BTV-7型毒株的全基因组序列,分别来自中国(GDST008毒株)[10]、非洲(1504毒株)与澳大利亚(v6963毒株)[11]。分离我国流行的BTV-7型毒株,掌握其全基因组序列与感染特性,不仅可丰富世界范围对BTV-7型毒株的了解,也有助于追溯我国BTV-7型毒株的来源,加深对BTV基因重配多样性的认知,为BTV诊断与疫苗研究提供基础。因此,作者拟报道于2020年在我国云南省哨兵牛血液中分离到的1株BTV-7型毒株,并分析其全基因组序列及其感染特征。
1 材料与方法
1.1 细胞与毒株
C6/36细胞(白纹伊蚊细胞)、BHK-21细胞(仓鼠肾细胞)均由云南省热带亚热带动物病毒病重点实验室保存,以含10%胎牛血清的MEM培养基分别培养于27 与37 ℃;BTV-7型毒株(GDST008)于2014年分离自广东省汕头市设立的哨兵牛血液中[9-10],由云南省热带亚热带动物病毒病重点实验室保存。
1.2 主要试剂
细胞培养用材料(胎牛血清、MEM与DMEM培养基)购自美国Gbico公司;RNA提取试剂RNAiso Plus、逆转录酶、高保真DNA聚合酶、DNA纯化试剂盒、一步法RT-PCR试剂盒、实时荧光定量qRT-PCR试剂盒均为大连宝生物公司产品;RNA纯化试剂盒、T4 RNA Ligase I均为北京NEB公司产品;磁珠法病毒RNA抽提试剂盒为美国Thermo Fisher公司产品;DNA文库构建试剂盒购至美国Illumina公司;低熔点琼脂糖与结晶紫购自杭州碧云天公司;BTV抗体C-ELISA检测试剂盒[12]由云南省热带亚热带动物病毒病重点实验室制备并保存。
1.3 哨兵动物的设立与血样采集
2020年5月,在云南省景洪市勐罕镇(经纬度:E100°59′53″,N21°54′58″,海拔550 m)选择3头1周岁 云南黄牛作为虫媒病毒监测的哨兵动物。哨兵牛BTV与动物流行型出血病病毒(EHDV)血清学检测为阴性,采用放牧的方式单独饲养,期间不使用任何疫苗与驱虫剂。从5月初开始,每周定时采集肝素钠抗凝血、EDTA抗凝血与全血等三种血液样本,进行虫媒病毒的检测与分离。
1.4 血液样本中BTV的检测与病毒分离
取采自哨兵牛的全血分离血清,以BTV抗体C-ELISA检测试剂盒[12]进行检测;取采集的EDTA抗凝血提核酸,使用BTV群特异性qRT-PCR[13]检测病毒核酸。取BTV感染动物的肝素钠抗凝血,离心收集红细胞(red blood cells,RBCs)。以PBS洗涤RBCs一次,加入灭菌水裂解RBCs。取RBCs裂解液接种C6/36细胞培养1代,随后在BHK-21细胞上连续盲传3~5代,当观察到细胞病变(cytopathic effect,CPE)时,收获细胞培养上清鉴定分离的病毒。
1.5 分离病毒的RT-PCR鉴定
使用病毒RNA/DNA提取试剂盒按说明书操作提取待鉴定病毒的核酸,使用一步法RT-PCR试剂盒,以针对BTV、EHDV与帕利亚姆病毒(PALV)的特异性引物进行一步法RT-PCR扩增检测[14-16];若待鉴定毒株为BTV,使用云南省热带亚热带动物病毒病重点实验室建立的BTV血清型特异性RT-PCR[17]进行分离BTV毒株的血清型鉴定。
1.6 病毒基因组dsRNA的提取及检测
将所分离的BTV毒株接种BHK-21细胞,待开始出现CPE时,刮取病变细胞,8 000 r·min-1离心20 min,收集细胞,加入RNAiso Plus,按说明书操作提取细胞的总RNA。按照文献[18]报道的方法纯化病毒基因组dsRNA。取5 μL纯化后病毒核酸,进行2%的高分辨率琼脂糖凝胶电泳,检测dsRNA的质量与完整性。
1.7 病毒基因组cDNA的合成与PCR扩增
取纯化后的BTV毒株基因组dsRNA作为模板,参照Maan等[19]报道的全长cDNA扩增(full-length amplification of cDNAs,FLAC)技术合成病毒基因组cDNA,使用GXL高保真DNA聚合酶扩增病毒基因组,按说明书推荐方法配制PCR反应体系,扩增程序:94 ℃预变性3 min;94 ℃变性30 s,60 ℃复性30 s,68 ℃延伸4 min,35个循环。反应结束后,取PCR扩增产物进行电泳,检测扩增产物的完整性。
1.8 高通量测序获取病毒的全基因组序列
取“1.7”病毒全基因组PCR扩增产物,纯化,然后使用Illumina公司的TruSeq DNA Sample Prep Kit DNA文库构建试剂盒构建文库。将所构建的文库在高通量测序平台Illumina Novaseq 6000上进行高通量测序。使用Trimmomatic软件[20]对获取的原始reads数据进行质量控制与滤过处理,滤过后的reads使用Edena(v3.131028)[21]、SOAPdenovo(v2.04)软件[22]进行病毒基因组的denove组装。
1.9 序列分析与系统发育树的构建
从GenBank数据库中下载相关BTV毒株序列,使用Mafft-win序列比对软件[23]与本研究中获取的基因组序列进行比对,使用BioEdit软件计算核酸(nt)与氨基酸(aa)序列的相似度;使用MEGA X软件[24]构建系统发生树,模型选择邻近法(Neighbor-join),参数选择P-distance,将自举检验值(bootstraps)取值设为1 000。
1.10 病毒在细胞上的感染特性比较
将适当稀释的病毒液接种BHK-21细胞,37 ℃吸附1 h,弃病毒液,并覆盖含2%胎牛血清和1%低熔点琼脂糖的DMEM培养基。在感染后第5天,用含0.03%的结晶紫染液对细胞进行染色,镜下观察病毒形成的蚀斑形态,并进行蚀斑计数。
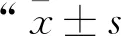
1.11 病毒在动物上的感染回溯分析
取5—8月份采集的哨兵牛EDTA抗凝血50 μL,使用磁珠法病毒RNA抽提试剂盒提取病毒核酸。使用本实验室建立的BTV-7型血清型特异性实时荧光定量(qRT-PCR)检测方法对感染动物血液中BTV-7型毒株的核酸(靶基因Seg-2)进行检测,按说明书推荐方法配制反应体系,反应条件:45 ℃ 5 min,95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。待检血液中病毒的核酸含量以qRT-PCR反应产生荧光信号的循环阈值数(cycle threshold,Ct)表示采用Karber法[25]测定分离毒株的TCID50;将采集的动物血清56 ℃灭活处理30 min,倍比稀释后备用。取100 TICD50的病毒悬液与稀释的动物血清作用2 h,在96孔板上采用“固定病毒-稀释血清”的方法测定梯度稀释的血清对细胞CPE的抑制作用。通过Karber法计算血清中和抗体的效价,分析感染哨兵牛血清中和抗体水平的动态变化。
2 结 果
2.1 病毒的分离与鉴定
3头哨兵牛,每周定时采血,持续监测血样中的BTV抗体和核酸。1号哨兵牛5月19日采集的血液样本经qRT-PCR检测为BTV核酸阳性,5月25日 采集的血清样本经C-ELISA检测为阳性,从哨兵牛的血液样本中检测到BTV的核酸与群特异性抗体的存在,表明该哨兵动物感染了BTV。
取5月19日自1号哨兵牛采集的肝素钠血液样本,接种C6/36与BHK-21细胞进行BTV分离。在BHK-21细胞上盲传至第3代,接种细胞出现明显的CPE,表现为细胞皱缩、脱落与裂解(图1)。提取病变细胞的核酸,分别进行BTV、EHDV和PALV的RT-PCR鉴定,BTV群特异性RT-PCR可扩增出预期的约1 kbSeg-7片段;BTV血清型RT-PCR鉴定结果显示,仅BTV-7型引物可扩增约1 kb的Seg-2片段,测序结果BLAST比对显示与BTV-7型毒株的序列相似度为92.7%~98.8%。以上结果表明在感染BTV的哨兵牛血液中分离出1株BTV-7型毒株,将其命名为V303/YNJH/2020。

图1 V303/YNJH/2020感染BHK-21细胞引起的细胞病变(100×)Fig.1 Cytopathic effect (CPE) of V303/YNJH/2020 on BHK-21 cells (100× magnification)
2.2 BTV-7型毒株在细胞上增殖特性的比较
将BTV-7型V303/YNJH/2020与GDST008毒株分别感染BHK-21细胞,在细胞层面分析两个毒株感染特性的差异。蚀斑试验的结果(图2)显示,V303/YNJH/2020毒株在细胞上造成的蚀斑明显大于GDST008毒株造成的。病毒的增殖曲线(图3)显示,感染后的48 h,感染细胞上清中V303/YNJH/2020与GDST008的含量基本一致;感染后72~96 h,V303/YNJH/2020在细胞上的增殖水平明显高于GDST008(P<0.05);在120 h后,两种病毒在细胞增殖基本达到平台期,但细胞上清中V303/YNJH/2020的病毒滴度(106.28PFU·mL-1)明显高于GDST008毒株(105.19PFU·mL-1),差异极显著(P<0.01)。以上结果提示,V303/YNJH/2020在BHK-21细胞上的增殖能力明显强于GDST008。
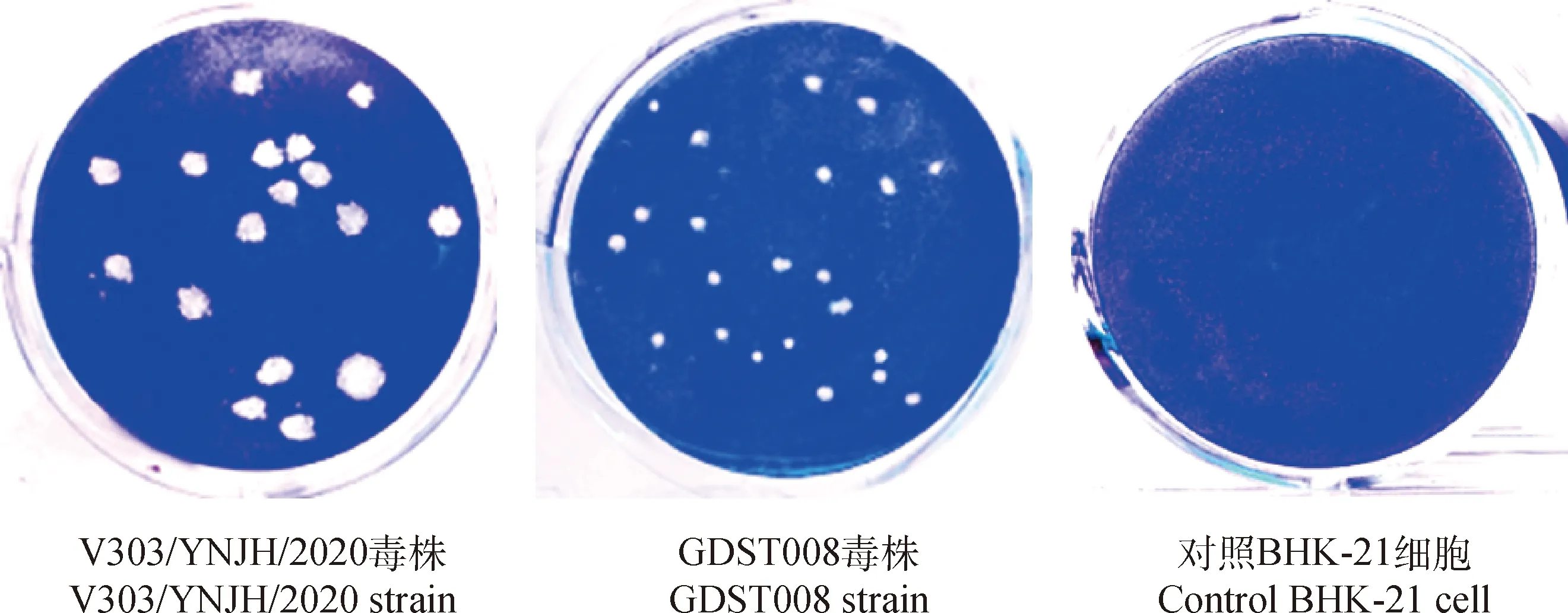
图2 V303/YNJH/2020与GDST008毒株在BHK-21细胞上形成蚀斑比较Fig.2 Compare viral plaque formations of GDST008 and V303/YNJH/2020 strains on BHK-21 cells
2.3 BTV全基因组扩增
提取V303/YNJH/2020毒株的dsRNA进行琼脂糖凝胶电泳,结果(图4A)显示病毒基因组dsRNA在凝胶上的电泳带型特征呈现“3-3-3”的迁移特征。通过FLAC技术[19]进行病毒基因组的RT-PCR扩增,电泳结果(图4B)显示,扩增的病毒基因组DNA在琼脂糖凝胶上的电泳带型特征与基因组dsRNA电泳带型一致,表明成功扩增了病毒全基因组。

*.差异显著,P<0.05;**.差异极显著P<0.01*.Difference is significant,P<0.05;**.Difference is extremely significant,P<0.01图3 BTV-7型GDST008与V303/YNJH/2020在BHK-21细胞上增殖曲线比较Fig.3 Viral growth curves of BTV-7 GDST008 and V303/YNJH/2020 strains on BHK-21 cells
2.4 NGS测序
V303/YNJH/2020毒株的基因组PCR产物的高通量测序结果显示,得到1.4 G的原始测序数据,共产生49 375 600条reads。经数据过滤处理后得到42 804 300条高质量的reads,其中,98.3%的reads可被进一步组装形成10个contigs,每个contig上单碱基位点的平均测序深度达5 000~20 000,测序结果表明对V303/YNJH/2020毒株的基因组进行了深度测序(基因组序列特征见表1)。

M.DL 5000 DNA相对分子质量标准;1.V303/YNJH/2020 毒株全基因组扩增产物M.DL5000 DNA marker;1.RT-PCR products of V303/YNJH/2020 genome图4 病毒基因组dsRNA(A)与全基因组RT-PCR扩增产物(B)电泳Fig.4 Agarose-gel electrophoresis genomic dsRNA of V303/YNJH/2020 (A) and its whole genome RT-PCR products (B)

表1 V303/YNJH/2020毒株基因组序列特征Table 1 Genome sequence characteristics of V303/YNJH/2020
2.5 BTV毒株基因组序列特征分析
获取的V303/YNJH/2020毒株的基因组序列全长为19 154 bp,10个基因节段的G+C含量在41.84%~47.62%,长度为3 944 bp (Seg-1)至822 bp (Seg-10),各基因节段编码蛋白氨基酸残基数为1 302(VP1) 至216(NS3a)。基因组非编码区(non-coding regions,NCR)占整个基因组的4.07%,各基因节段5′端NCR的长度为34 bp(Seg-5)至8 bp(Seg-4)之间,3′ NCR的长度均大于5′端NCR,长度为133 bp(Seg-10)至27 bp(Seg-1)(表1),各个节段的5′ 与3′ NCR区均具有5′-GUUAAAA-------ACACUUAC-3′的保守序列。
BLAST比对分析结果显示,V303/YNJH/2020毒株的Seg-1至Seg-6、Seg-9与Seg-10等8个基因节段与BTV-7型GDST008毒株[9]的对应基因节段有着最近的亲缘关系,核苷酸与编码蛋白氨基酸(nt/aa)序列的相似度在98.8%/99.0%(Seg-2/VP2)至100.0%/100.0%(Seg-5/NS1)之间。V303/YNJH/2020毒株的Seg-7/VP7与Seg-8/NS2则分别与澳大利亚BTV-7型V6963毒株和BTV-15型DPP192毒株[11]具有最近的亲缘关系,序列相似度分别为94.8/99.1%和94.3/94.9%,与GDST008毒株的序列相似度仅为71.5/81.6%和79.6/84.4% (表1)。以上结果表明,云南省与广东两省分离的BTV-7型毒株虽有着最近的亲缘关系,但Seg-7与Seg-8基因节段出现了遗传多样性。
2.6 Seg-7与Seg-8的系统发生树
为分析BTV-7型V303/YNJH/2020与GDST008毒株Seg-7与Seg-8的遗传进化关系,分别构建两个基因节段的系统发生树。Seg-7构建的系统发生树显示,GDST008毒株与印度和中国分离的BTV毒株聚为Eastern 3地域亚型;而V303/YNJH/2020毒株则与澳大利亚、南非等地分离的BTV-7型和BTV-19型毒株聚为Western 6地域亚型(图5A)。Seg-8的系统发生树显示,V303/YNJH/2020毒株属Western型,与澳大利亚BTV-15型DPP192毒株聚为一簇,而GDST008毒株属Eastern型,与中国BTV-4、-15与-21型毒株聚为一簇(图5B)。以上结果提示,V303/YNJH/2020与GDST008毒株的Seg-7与Seg-8在进化上有着不同的来源。
2.7 BTV-7型毒株在哨兵牛上感染的回溯分析
通过qRT-PCR与血清中和试验对感染动物血液中的BTV核酸含量与血清中和抗体效价进行监测,对V303/YNJH/2020在哨兵牛上的感染情况进行回溯分析。将首次检测到BTV-7型病毒核酸的采血时间点设为第1周(Ct值:33.4),在感染后第2、3周,血液中病毒核酸含量处于高峰(Ct值:30.4);从第4周开始,病毒核酸含量虽呈下降趋势,但直到监测结束的第12周,血液中病毒的检测结果仍为阳性(Ct值:35.6)(图6)。
血清中和抗体检测结果显示,病毒感染哨兵牛的第2周,可检测到BTV-7的特异性中和抗体的产生(抗体效价1∶32),感染后的3周,血清中病毒中和抗体已到达最高点(抗体效价1∶256)并持续约6周时间,在检测期结束的第12周,抗体水平仍维持在较高水平(1∶113) (图6)。为分析V303/YNJH/2020是否感染同群的其他哨兵动物,取另两头哨兵牛5—8月每月最后一次采集的血液样本,分别进行BTV核酸的回溯检测,发现其中一头牛感染了BTV-4型,而另一头牛感染了BTV-1型,未检测到BTV-7型病毒的核酸。
3 讨 论
2012—2017年,在国家公益性行业(农业)专项的资助下,本实验室在我国云南省、广东省、广西壮族自治区以及江苏省相继分离出到12种血清型的BTV,分别为BTV-1、-2、-3、-4、-5、-7、-9、-12、-15、-16、-21与-24[26-29],显示我国南方地区流行BTV血清型的高度多样性。BTV-7型毒株于2014年在广东省设立的哨兵牛中首次分离[9],但在为期5年的监测过程中,其他省份设立的哨兵动物中均未分离出BTV-7型毒株,因此BTV-7型在我国的扩散、流行特征、演化规律与在动物上的感染特性尚不清楚。本研究在云南省景洪市设立的哨兵牛中分离出BTV-7型毒株,一方面确认了BTV-7型毒株在云南省的流行,另一方面也为比较分析我国不同地域流行BTV-7型毒株的遗传特征,进而推测病毒的演化提供了条件。
基因重配是BTV进化的主要动力,其发生频率很高,不同血清型毒株之间、弱毒疫苗毒株与野毒株之间、本地流行毒株与外来毒株之间均可发生重配,是引起BTV高度遗传多样性的主要原因[30]。对BTV-7型V303/YNJH/2020毒株全基因组序列比较分析显示,V303/YNJH/2020毒株的8个基因节段(Seg-1至Seg-6,Seg-9与Seg-10),与广东2014年分离的GDST008毒株序列高度相似,核酸序列相似度为98.8%(Seg-2)至100%(Seg-5),氨基酸序列相似度为99.0%(VP2)~100%(VP3、VP5与NS1)(表1),提示两个毒株之间有着最近的亲缘关系。V303/YNJH/2020毒株与GDST008毒株的Seg-7与Seg-8基因节段却有着明显的差异:Seg-7序列相似度仅为71.5%,分属Western-6 与Eastern-3地域型;Seg-8的序列相似度为79.6%,分属Western与Eastern地域型(图5)。以上结果表明我国流行的BTV-7型毒株很可能通过基因重配产生遗传多样性。

图中节点处的数字为各进化分支的自举检验值,比例尺为每个位点的核苷酸替代数。本研究分离的V303/YNJH/2020毒株以点表示,广东省分离的BTV-7型GDST008毒株以方块表示。Seg-7的Eastern-1~3、Western-1~7地域型与Seg-8的Western、Eastern地域型标注参照Maan等[3]的报道进行命名The number at the point of each branch indicates a bootstrap value.Scale bars indicate nucleic acid substitutions per site.V303/YNJH/2020 strain isolated in present study was indicated by dot and BTV-7 GDST008 strain isolated in Guangdong Province was indicated by squares.Eastern-1 to Eastern-3 and Western-1 to Western-7 toptypes of Seg-7,and Western and Eastern topypes of Seq-8 of BTV strains were assigned as per Maan[3]图5 基于邻近法构建的BTV Seg-7、Seg-8系统发生树Fig.5 Phylogenetic tree of BTV Seg-7,Seg-8 constructed by Neighbor-join (NJ) method

左边Y轴表示血液中病毒核酸的qRT-PCR检测结果的Ct值(实线表示Ct值曲线);右边Y轴表示血清中针对V303/YNJH/2020毒株的中和抗体滴度(虚线表示中和抗体滴度曲线)The Y axis on the left represents the qRT-PCR detection results of viral nucleic acids in the blood (Solid line indicates the curve of the Ct value);the Y axis on the right represents the titers of neutralization antibody against the V303/YNJH/2020 strain in serum (Dotted line indicates the neutralization antibody titers)图6 自然感染V303/YNJH/2020毒株哨兵牛血液中病毒核酸与中和抗体动态监测结果Fig.6 Detection of viral nucleic acids and neutralization antibodies in blood samples collected from sentinel cattle naturally infected with V303/YNJH/2020
基因组分节段RNA病毒的基因重配,对病毒的传播、致病性、感染特性与免疫原性等方面均有着深刻的影响,历史上几次大范围流感病毒的暴发与流行,均与基因重排产生变异毒株有关[31-32]。为分析基因重配是否改变我国BTV-7型毒株的感染特性,作者首先在细胞层面通过比较病毒蚀斑与增殖曲线,分析病毒在感染特性上的差异,发现V303/YNJH/2020毒株在BHK-21细胞上形成的蚀斑明显大于GDST008毒株的,同时增殖曲线分析也显示,V303/YNJH/2020毒株在感染BHK-21细胞后的72~96 h增殖能力明显强于GDST008(图2、3)。在基因组层面,V303/YNJH/2020 与GDST008毒株的Seg-7与Seg-8序列差异最大,2个毒株在细胞上增殖特性的差异是由病毒的Seg-7与Seg-8差异所导致,亦或是病毒蛋白某些关键氨基酸位点的突变所引起,这是一个值得探讨的问题。
BTV的Seg-7与Seg-3编码的VP7与VP3蛋白共同构成病毒的内层衣壳[4],研究已证实Seg-7是BTV的毒力基因之一[33]。V303/YNJH/2020毒株的Seg-3与Seg-7均为Western型,而GDST008毒株的Seg-3与Seg-7分属Western型与Eastern型。作者推测,Eastern型Seg-7编码的VP7蛋白与Western型Seg-3编码的VP3蛋白的结合能力较弱,导致了GDST008毒株内层衣壳蛋白组装效率低于V303/YNJH/2020毒株,引起GDST008病毒增殖能力减弱。BTVSeg-8编码的NS2蛋白在感染细胞中形成病毒包涵体,是BTV病毒粒子的组装“工厂”[34]。V303/YNJH/2020毒株的Seg-8为Western型,与欧洲强致病性BTV-8型毒株[3]具有更近的亲缘关系,核酸/氨基酸序列相似度为90.8%/96.3%;而GDST008毒株的Seg-8为Eastern型,与BTV-8型强致病性毒株亲缘关系较远,序列相似度仅为80.3%/86.2%。这可能也是导致V303/YNJH/2020毒株在细胞上增殖能力强于GDST008病毒的原因之一。以上只是初步推测,要证实这种推测,可通过BTV反向遗传体系[35]进行验证。
虽然早在2014年即从我国的哨兵牛上分离出了BTV-7型毒株,但该血清型病毒在易感动物上的感染特性是怎样的,尚无相关报道。因此作者对V303/YNJH/2020在哨兵牛上的病毒的核酸与中和抗体产生进行了回溯分析。结果显示,BTV-7型感染哨兵牛后,未观察到可见的临床症状,因此可认为牛在BTV-7型的传播链中起着存储宿主的作用,由于无临床症状的出现,因此BTV十分容易通过活牛的贸易进行扩散。对血液样本中BTV-7型病毒核酸的监测结果显示,V303/YNJH/2020感染动物后的两周病毒达到增殖的高峰,随后随着中和抗体的产生,虽然血液中病毒核酸含量有所下降,但是在为期12周的监测期内,血液中始终可检测到病毒核酸的存在。由于BTV-7型病毒核酸在血液中长期存在,是否意味着在较长时期内,库蠓叮咬感染动物后仍可继续传播病毒,值得进一步分析。
4 结 论
本研究从云南省哨兵牛上分离获得1株BTV-7型毒株V303/YNJH/2020,全基因组测序结果显示,该毒株与广东BTV-7型毒株之间有最近的亲缘关系,但Seg-7与Seg-8发生了基因重配,形成了新的变异毒株,导致其在细胞上的增殖能力明显增强。V303/YNJH/2020感染的哨兵牛上检测到病毒的复制与中和抗体应答,但未观察到临床症状。本研究结果将有助于开展我国BTV-7型毒株的演化规律和致病性研究。

