2-脱氧-D-葡萄糖通过诱导人非小细胞肺癌细胞线粒体功能障碍抑制肿瘤细胞增殖①
胡先华 赵春艳 张海迪 陈书志 母 波 (川北医学院医学检验系,南充637000)
癌症是威胁我国乃至全球人类健康的重大疾病,其发病率和致死率居各类慢性疾病之首[1]。然而,癌症作为一种长久以来存在的恶性疾病,一直难以攻克,这源于恶性肿瘤细胞独有的特征,包括不间断的生长信号刺激、强劲的自我复制能力、持续的血管生成、组织浸润和转移能力、逃避免疫系统的监控、细胞代谢异常、基因组的不稳定性和突变等[2]。其中,能量代谢的异常在近年来受到学界的广泛关注[3]。
肿瘤的发生发展和细胞代谢异常密切相关[4]。德国生化和生理学家OTTO WARBURG早在20世纪20年代就提出了著名的“Warburg效应”:即使有足够的氧气供应,肿瘤细胞仍偏好于借助糖酵解途径而不是能产生更多ATP的线粒体氧化磷酸化方式产生能量满足快速生长的需求[5]。
2-脱氧-D-葡萄糖(2-deoxy-D-glucose,2-DG)能竞争性地抑制葡萄糖转运体1和己糖激酶介导的磷酸化,其产生的6-磷酸2DG(2DG-6-phosphate,2DG-6P)聚集在细胞内无法被代谢利用,且半衰期长达50 min,2DG-6P通过竞争性抑制磷酸葡萄糖异构酶抑制6-磷酸葡萄糖转化为6-磷酸果糖,阻断糖酵解于起始阶段,从而发挥抗肿瘤效应[6]。糖酵解途径一直是肿瘤靶向的目标,而2-DG作为一种糖酵解抑制剂应用于肿瘤治疗方面的研究。目前研究表明2-DG能增强阿霉素和紫杉醇的抗肿瘤活性,和组蛋白脱乙酰酶抑制剂具有协同效应[7];2-DG与阿霉素或l-丁硫氨酸磺酰亚胺协同作用,可减少乳腺癌细胞的黏附和迁移,但是对于靶向抑制线粒体还鲜有报道[8]。
本研究旨在通过2-DG作用于非小细胞肺癌细胞后的一系列生物学行为改变来探讨线粒体在肿瘤发展中所发挥的作用。
1 材料与方法
1.1 材料 非小细胞肺癌细胞A549由川北医学院医学影像研究保存并传代。DMEM培养基、胎牛血清(FBS)购自美国Gibco公司;胰蛋白酶、青霉素链霉素购自HyClone公司;2-DG购自美国Sigma公司;线粒体膜电位检测试剂盒(JC-1)、Annexin V-FITC细胞凋亡检测试剂盒、细胞周期检测试剂盒均购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 A549细胞用含10%FBS、100 U/ml青霉素、100μg/ml链霉素的DMEM完全培养基,置于37℃、5%CO2的条件下培养,当细胞融合度达80%~90%时用0.25%胰蛋白酶按1:3消化传代,取对数生长期的细胞进行实验操作。
1.2.2 CCK-8试验 A549细胞以5×103个/孔接种于96孔板,培养24 h后更换新鲜培养基,并加入不同浓度的2-DG继续培养48 h,弃去培养基,每孔加入10μl CCK-8试剂,37℃ 孵育2 h,450 nm波长处测定吸光度值(A),计算细胞抑制率。
1.2.3 细胞凋亡试验 A549细胞接种于6孔板,培养24 h后更换新鲜培养基,加入不同浓度2-DG培养48 h后,重悬细胞后离心弃上清,按说明书分别加入Annexin V-FITC和碘化丙啶染色液,室温避光孵育20 min,最后用流式细胞仪测定。
1.2.4 细胞周期试验 A549细胞接种于6孔板,培养24 h后更换新鲜培养基,加入不同浓度2-DG培养48 h后,PBS重悬细胞,离心弃上清,70%乙醇固定2 h以上,再次重悬细胞,加入碘化丙啶染色液37℃避光温浴30 min,最后用流式细胞仪测定。
1.2.5 线粒体膜电位测定(JC-1) A549细胞接种于6孔板,培养24 h后更换新鲜培养基,加入2-DG培养48 h后,按说明书加入JC-1工作液,37℃孵育20 min,后续步骤按试剂盒说明书进行,最后用流式细胞仪分析。
1.2.6 线粒体基因组测定 不同浓度的2-DG处理A549细胞后,对对照组和处理组细胞进行高通量测序,对比其线粒体基因组变化情况。
1.3 统计学方法 应用GraphPad Prism5.0统计软件对实验数据进行统计学分析,组间以P<0.05为差异有统计学意义。
2 结果
2.1 2 -DG抑制非小细胞肺癌细胞A549增殖 分别用浓度为25μmo/lL、50μmo/lL、100μmo/lL、1 mmo/lL、10 mmo/lL的2-DG处理A549细胞48 h后,计算细胞抑制率,结果如图1所示。结果显示,作用48 h后,各浓度2-DG均可明显抑制A549细胞增殖,且随着药物浓度增大,A549细胞抑制率逐渐增大,其IC50约为10 mmo/lL。
2.2 2 -DG作用于A549细胞后凋亡测定 2-DG作用于A549细胞48 h后,流式细胞术检测肿瘤细胞凋亡结果如图2所示,2-DG对非小细胞肺癌细胞A549的凋亡抑制不明显。
2.3 2 -DG作用于A549细胞后周期测定 与对照组相比,不同浓度2-DG作用于A549细胞48 h后细胞周期均有所改变,且随着2-DG浓度增大,细胞周期更多阻滞在S期(图3、表1)。
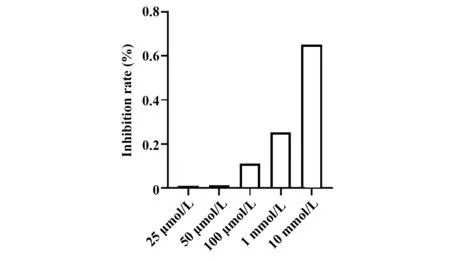
图1 不同浓度2-DG作用A549细胞48 h后细胞抑制率Fig.1 Cell inhibition rate of A549 treated with 2-DG at different concentrations for 48 h
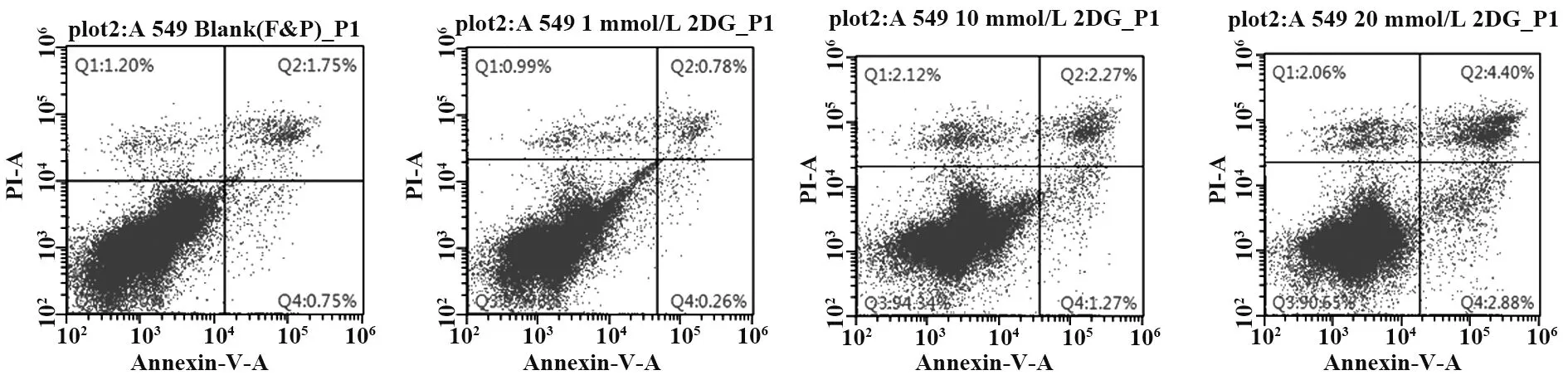
图2 不同浓度2-DG作用A549细胞48 h后细胞凋亡情况Fig.2 Apoptosis of A549 treated with 2-DG at different concentrations for 48 h
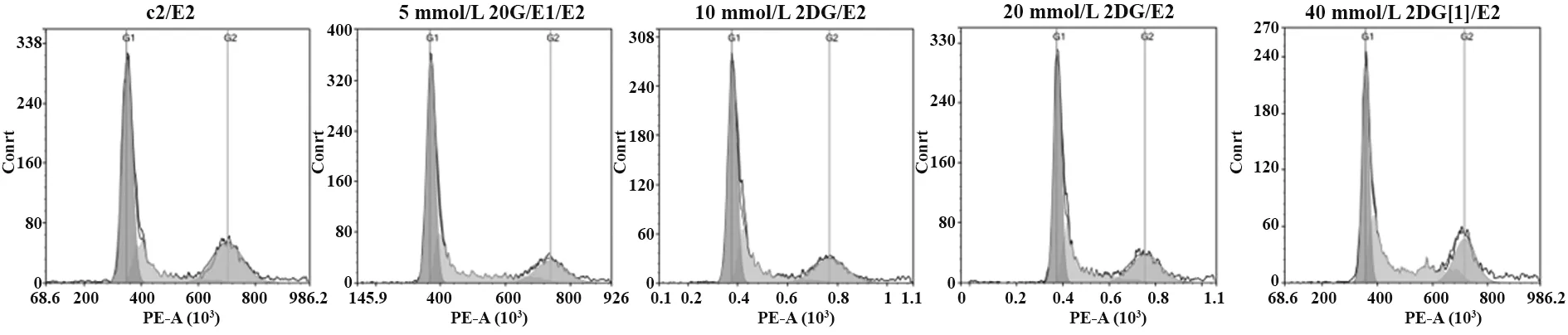
图3 不同浓度2-DG作用A549细胞48 h后细胞周期情况Fig.3 Cell cycle of A549 treated with 2-DG at different concentrations for 48 h
2.4 线粒体膜电位测定结果 如4所示,2-DG作用于A549细胞后,细胞群发生偏移,A549细胞膜电位从高到低,说明2-DG可诱导A549细胞的线粒体膜损伤。
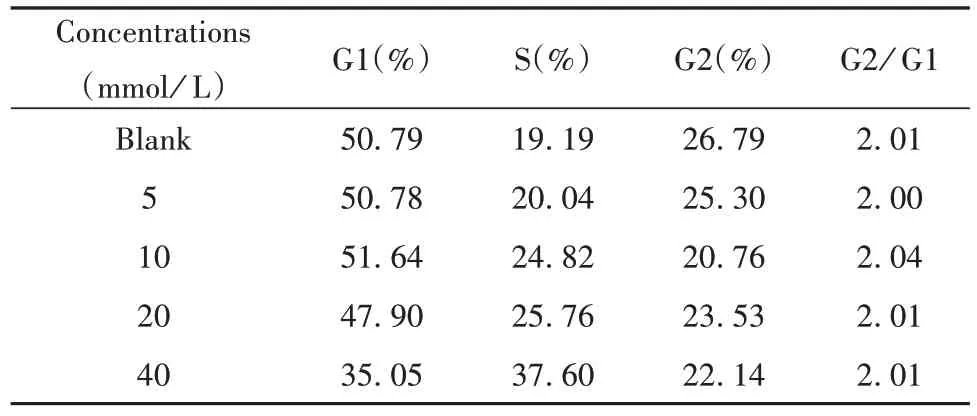
表1 不同浓度2-DG作用A549细胞48 h后细胞周期情况Tab.1 Cell cycle of A549 treated with 2-DG at different concentrations for 48 h

图4 不同浓度2-DG作用A549细胞48 h后线粒体膜电位(JC-1)变化情况Fig.4 Changes of mitochondrial membrane potential(JC-1)in A549atdifferentconcentrationsof 2-DGfor 48h
2.5 线粒体基因组测定结果 测序结果如图5所示,经2-DG处理后的细胞线粒体基因组结构与对照组相比无明显变异。本研究中的高通量数据Q30>95%(表2),且Amplicon覆盖均一性高(图6),表明本次测序质量的可信度高。

图5 2-DG处理A549细胞后线粒体突变频率Fig.5 Mitochondrial mutation frequency of A549 treated with 2-DG

表2 2-DG处理A549细胞后线粒体测序质量值QTab.2 Mitochondrial sequencing quality value Q of A549 treated with 2-DG

图6 高通量测序Amplicon覆盖均一性Fig.6 Coverage uniformity of high-throughput sequenc⁃ing Amplicon
3 讨论
线粒体被称为细胞的能量屋,在细胞生理学中发挥重要作用。真核细胞中,大部分细胞能量(ATP)是在线粒体中通过氧化磷酸化过程产生的,但肿瘤细胞却以产能效率更低的糖酵解方式获取能量,提示在肿瘤的发生发展过程中,线粒体氧化磷酸化途径的作用很可能被严重削弱[9]。研究证实,糖酵解和线粒体呼吸作用的失衡增强了肿瘤细胞对低氧环境的适应,有利于肿瘤的发生发展进程[10]。此外,糖酵解途径导致的乳酸增加还可分解破坏肿瘤细胞周围的细胞基质,促进肿瘤细胞迁移[11]。因此,在肿瘤的发展过程中,糖酵解是其主要的供能方式。
在氧化呼吸过程中,线粒体电子传递链通过一系列氧化还原反应将所产生的能量以电化学势能储存于线粒体内膜,造成内膜两侧质子及其他离子浓度的不对称分布从而产生电化学梯度,形成线粒体膜电位(mitochondrial membranepotential,MMP)[12]。正常的MMP是维持线粒体进行氧化磷酸化的先决条件,MMP的稳定有利于维持细胞的正常生理功能,也是评价线粒体功能完整性的关键参数。线粒体功能障碍、线粒体膜损伤、线粒体电子传递链异常等均可能导致MMP发生改变。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。JC-1有单体和多聚体两种形式存在,当膜电位较高时,形成发射红色荧光的多聚体,当凋亡发生即膜电位较低时,形成发射绿色荧光的单体形式,故而可以通过细胞群的偏移来检测线粒体膜电位的变化。
另外,研究发现多种肿瘤表现出线粒体DNA变异,其变异可导致氧化磷酸化功能受到抑制,活性氧物质增加,促使肿瘤细胞在不利条件下依然能够生长。由于线粒体DNA参与编码有氧呼吸的关键组成部分—呼吸链的多个复合体,因此,与细胞核DNA相比,线粒体DNA缺乏组蛋白,且对DNA的修复能力较弱。由药物刺激引起的肿瘤细胞的氧化应激反应可能导致线粒体DNA在转录水平发生异常[13]。同时,肿瘤细胞中线粒体DNA发生突变的频率较高,这些突变也可能引起线粒体功能异常[14]。
WARBURG曾假设,线粒体呼吸链的破坏是肿瘤细胞糖酵解增强的重要原因[18]。由于线粒体基因组编码了呼吸链中13个重要的蛋白组分,且线粒体DNA在肿瘤细胞中存在高频突变[19]。例如,在前列腺癌、结直肠癌等多种癌症中均可观察到线粒体DNA突变[20-21]。推测线粒体DNA的突变很可能影响其所编码蛋白的功能并影响呼吸链。
2-DG作为糖酵解抑制剂,在多种肿瘤中均表现出抗肿瘤活性。研究表明其可通过干预N连接糖基化,导致内质网内非正常蛋白质折叠反应,继而诱发内质网应激[15]。ZAGORODNA等[16]在淋巴瘤细胞的研究中表明,2DG诱导内质网应激,继而激活Bcl-2相互作用细胞死亡介导因子,通过对Bcl-2家族促凋亡蛋白的调控诱导细胞凋亡。程秀等[17]的研究显示,2-DG对乳腺癌细胞的增殖具有抑制作用,但其本身并不诱导细胞凋亡,而是通过明显增加临床乳腺癌常用治疗药物的疗效来诱导乳腺癌细胞凋亡,其机制可能是通过诱导细胞产生过度的ER应激反应,增强Caspase-3活性而发挥作用。本研究着眼于经2-DG作用之后的非小细胞肺癌细胞的行为学改变是否与线粒体DNA突变有关,并期望找到线粒体DNA的突变模式及其作用机制。
由CCK-8结果可知,经不同浓度的2-DG刺激后,A549细胞的增殖活性受到抑制,且随着药物浓度的增大,细胞生长抑制率逐渐增高,说明2-DG可有效抑制非小细胞肺癌细胞的增殖活性。然而,流式细胞术结果表明,在不同浓度2-DG的刺激下,A549细胞的凋亡并未明显增强,而随着2-DG浓度增大,A549细胞周期阻滞在S期,说明高浓度的2-DG刺激可有效抑制细胞周期进程,从而阻断肿瘤细胞增殖。
有研究显示,线粒体功能障碍与肿瘤的发生发展密切相关,化疗诱导的低水平线粒体DNA与肿瘤细胞获得性耐药和抗凋亡特性有关[22-24]。LIjIE‐MA[22]等研究了非小细胞肺癌(NSCLC)多药耐药的原因,发现线粒体DNA突变与NSCLC肿瘤发生发展有关,但与其多药耐药能力无关,另外,乳酸和ROS生成的差异提示线粒体功能障碍参与了NSCLC的多药耐药。因此,线粒体功能障碍可能是肿瘤细胞发展迅速的重要因素之一,线粒体功能障碍导致线粒体呼吸链的破坏或减弱,肿瘤细胞糖酵解得以增强。
本研究也测定了经2-DG处理后A549细胞的线粒体基因组序列,与对照组相比,线粒体基因组序列并未有所改变。然而JC-1结果显示,随着2-DG浓度的增加,细胞群发生偏移,线粒体膜电位(MMP)由高到低发生改变,说明2-DG诱导A549细胞线粒体膜发生损伤。结果表明,在2-DG的刺激下,A549细胞线粒体膜受到损伤,但并未导致基因组结构的破坏。
4 结论
本研究显示,2-DG能有效抑制非小细胞肺癌细胞A549的增殖活性,线粒体基因组检测并未发现细胞线粒体DNA突变,因此,2-DG对非小细胞肺癌的抑制作用可能并不是通过诱导DNA突变导致线粒体结构异常来实现的。推测2-DG可能主要作用于A549细胞的线粒体,通过诱导线粒体膜损伤,使线粒体功能发生障碍,进一步诱导细胞周期阻滞,从而抑制肿瘤细胞生长。然而,该的推测需要佐证,其具体作用途径尚需进一步研究。

