丰富环境对脑缺血再灌注损伤大鼠神经功能和缺血半暗带区葡萄糖代谢的影响
周文美,陶陶,吴霜,王廷龙,杨正奕,张莹
1.贵州医科大学附属医院康复医学科,贵州贵阳市 550001;2.贵州省人民医院康复医学科,贵州贵阳市 550002;3.贵州医科大学附属人民医院康复医学科,贵州贵阳市 550002;4.贵州省食品药品检验所,贵州贵阳市550004
缺血性脑卒中通常由栓塞或血栓性动脉阻塞引起,导致脑血流量减少,引起缺氧和目标脑区域葡萄糖供应中断,细胞出现能量代谢减慢、坏死和凋亡[1]。脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是缺血性脑卒中的继发损伤,由于侧支循环建立,在缺血中心区周围的半暗带,细胞仍可维持部分代谢活力[2]。防止缺血半暗带区演变为梗死区,恢复神经细胞活性,是缺血性脑卒中治疗研究的热点。
丰富环境是一种非侵入性干预方法,它依赖于自愿的身体活动、无压力的调节、社会互动和对新刺激的引入,已被证实可以促进脑缺血后神经发生和功能恢复[3]。缺氧诱导因子‑1α (hypoxia inducible factor‑1α,HIF‑1α)是机体缺血缺氧时触发内源性保护机制的始动因子和共同途径,能通过调控下游葡萄糖转运蛋白‑1(glucose transporter 1,GLUT1)和6‑磷酸果糖‑2‑激酶/果糖‑2,6‑双磷酸酶3 (6‑phosphofructo‑2‑kinase/fruc‑tose‑2,6‑bisphosphatase‑3,PFKFB3)的表达,改善葡萄糖代谢[4‑6]。丰富环境可上调CIRI 大鼠脑组织HIF‑1α表达,参与大脑神经功能保护[7‑8]。
本研究观察丰富环境对大鼠CIRI模型神经功能的疗效,观察脑组织病理结构改变,检测缺血半暗带区ATP、ADP 和AMP 含量,以 及HIF‑1α 及其下游GLUT1、PFKFB3 mRNA 和蛋白的表达,探讨丰富环境对CIRI大鼠的脑保护作用及其可能机制。
1 材料与方法
1.1 实验动物及分组
SPF 级成年雄性Sprague‑Dawley 大鼠72 只,体质量240~260 g,购于贵州医科大学实验动物中心,实验动物生产批准号SCXK(黔)2018‑0001。本实验在贵州医科大学分子生物学重点实验室和贵州省食品药品检验所进行,所涉及的动物操作严格遵循动物伦理学的相关规定和准则。
采用随机数字表法,分为假手术组、模型组和丰富环境组,各24只。
1.2 主要试剂与仪器
HIF‑1α 兔多克隆抗体、β‑actin 兔多克隆抗体:博奥森公司。PFKFB3 兔单克隆抗体:ABCAM 公司。GLUT1兔多克隆抗体:PROTEINTECH公司。PCR逆转录试剂盒和SYBR Premix Ex TaqTM试剂盒:TAKA‑RA 公司。线栓:北京西浓科技有限公司。ATP 标准品(93.0%)、ADP 标准品(85.3%)、AMP 标准品(92.7%):中国食品药品检定研究院。山羊抗兔抗体:THERMO FISHER公司。
LC‑20AT 高效液相色谱仪:日本岛津公司。实时荧光定量PCR 仪:美国ABI 公司。ND2000 型超微量紫外分光光度计:美国THERMO FISHER公司。所有引物均由上海生工设计和合成。
1.3 方法
1.3.1 动物模型建立[9]
大鼠术前禁食12 h。大鼠10%水合氯醛3.5 ml/kg腹腔注射麻醉,仰卧位固定,颈正中切口,分离右侧颈外、颈总和颈内动脉,依次结扎颈外和颈总动脉近心端,微动脉夹暂时夹闭颈内动脉。经颈总动脉近分叉处剪口,将直径约0.26 mm 的线栓(前端烧熔成半球形,18 mm处有标记)插入颈内动脉,至感受到轻微阻力,插入深度(距颈总动脉分叉口)约18.0 mm。60 min后,缓慢退出线栓。
假手术组大鼠行相同手术步骤,但不插入线栓。
术后24 h 采用改良神经损害严重程度评分(modi‑fied Neurological Severity Scores,mNSS)[10]进行神经功能评估。取7~12分大鼠进行后续实验,不合格大鼠剔除,按随机抽样原则抽取备用大鼠补齐。
1.3.2 丰富环境和标准环境设置[11]
丰富环境组于造模后立即饲养在丰富环境中。85×50×75 cm 金属网格笼,笼内有爬梯、链条、不同形状管道、色块、积木、球类和跑轮等玩具,每3 天重新布置环境1 次;每天持续播放舒缓音乐及多色光照射2 h,每笼饲养6只。
假手术组和模型组均饲养在标准环境中。25×15×20 cm 塑料笼,笼内仅放置垫料,每笼饲养2 只大鼠。所有动物笼内饲料、垫料和水均一致,12 h 明暗循环条件,共饲养28 d。
1.3.3 mNSS
于造模前(0 d)及造模后1 d、7 d、14 d、21 d、28 d,每组各取8只大鼠由一名不了解实验分组的研究者对各组大鼠行mNSS评定。评分越高,损伤越严重。
1.3.4 取材
各组于造模后1 d、28 d,行mNSS 评定后,10%水合氯醛3.5 ml/kg 腹腔注射麻醉后,断头处死大鼠,冰板上快速取出脑组织,预冷PBS 缓冲液洗净,切取缺血半暗带区脑组织[12],假手术组取对应部位,液氮速冻6 min 后,-80 ℃冰箱保存,用于mRNA、蛋白,以及ATP、ADP、AMP 检测。剩余脑组织4%多聚甲醛固定,用于HE染色。
1.3.5 HE染色
各组取3 只,脑组织4%多聚甲醛液固定24 h 以上,石蜡包埋,切片厚4 μm,常规HE 染色,光学显微镜下观察病理改变。
1.3.6 逆转录实时定量聚合酶链反应(reverse transcrip‑tion real‑time quantitative polymerase chain reaction,RT‑qPCR)
各组取6只大鼠脑缺血半暗带区组织,Trizol溶液提取总RNA,紫外分光光度计测定浓度和纯度,将RNA 逆转录成cDNA,用SYBR Green 试剂盒进行实时荧光定量多聚酶链式反应,计算2-ΔΔCt值。引物序列如下。
HIF‑1α:上游5'‑AGA GTG GTA CTC ACA GTC GG‑3';下游5'‑CCC TGC AGT AGG TTT CTG CT‑3'。
GLUT1:上游5'‑AGA GTC CAT CCC ATC CAC CA‑3';下游5'‑CCT GCC AAA GCG ATT AAC AA‑3'。
PFKFB3:上游5'‑ATT GAA TAT GCC GTC TCC‑3';下游5'‑CAC AAG ATA CAC ACA TGG‑3'。
β‑actin:上 游5'‑ATT TGG CAC CAC ACT TTC TAC‑3';下 游5'‑ATC TGG GTC ATC TTT TCA CGG‑3'。
1.3.7 Western blotting
各组6 只大鼠脑缺血半暗带区组织,充分研磨成匀浆,离心取上清液,紫外分光光度计下测量蛋白浓度。10%SDS‑PAGE 电泳分离,转膜2 h 后,5%脱脂牛奶封闭2 h,分别加入HIF‑1α(1∶1000)、GLUT1(1∶1000)、PFKFB3(1∶3000)和β‑actin(1∶5000)一抗,4 ℃摇床孵育过夜,次日洗膜后加二抗(羊抗兔IgG,1∶3000)室温孵育1 h,滴加ECL 液显色。以β‑actin为内参,利用Image J 软件分析各条带相对灰度值,测量3次,取均值。
1.3.8 高效液相色谱法
各组取3 只,称取缺血半暗带区脑组织500 mg,冰上用0.4 mol/L HCLO4制成10%匀浆。超声粉碎后,低温离心取上清液。加3 mol/L K2CO30.1 ml中和,离心、过滤后制成试品溶液,-80 ℃储存。
采用高效液相色谱法测定ATP、ADP、AMP 含量。色谱条件:Waters Bridge R C18 反相色谱柱(4.6×150 mm,5 μm)。流动相:0.2 mmol/L 磷酸盐缓冲液(磷酸氢二钠35.8 g、磷酸二氢钾13.6 g、四丁基溴化氨1.61 g),95%甲醇摇匀。检测波长259 nm,流速1.0 ml/min,柱温20 ℃,进样量10 μl。
精密称取标准ATP 10.18 mg,ADP 10.87 mg,AMP 10.07 mg,超纯水溶解,稀释后ATP、ADP、AMP 的浓度分别为48.37 μg/ml、46.36 μg/ml、46.67 μg/ml。梯度稀释(2、2.5、5、10、50、100 倍),取各浓度梯度对照品溶液10 μl 进样,得到标准曲线,计算样本ATP、AMP、ADP浓度,并进一步计算能量负荷(energy charge,EC)[13]。
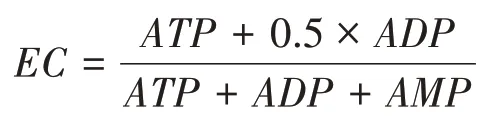
每个样本进样3次。
1.4 统计学分析
采用SPSS 22.0 统计软件进行数据分析。计量资料以()表示,多组间比较采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 mNSS
各组造模前及假手术组各时间点mNSS 评分均为0,行为无异常;造模后1 d,模型组和丰富环境组均出现行走时向一侧倾倒或转圈,感觉、平衡异常等神经功能缺失症状,mNSS 评分高于假手术组(P <0.05);术后14 d 开始,丰富环境组mNSS 评分较模型组降低(P <0.05)。见表1。

表1 各组各时间点mNSS比较
2.2 HE染色
假手术组脑组织结构清晰,神经细胞规则排列,胞核居中,胞核胞质染色均匀一致。术后1 d,模型组和丰富环境组脑组织出现明显梗死区,可见细胞水肿,神经元脱失或出现核固缩边缘化、核仁消失,组织疏松呈空泡样排列和拉网状改变。术后28 d,模型组和丰富环境组水肿、神经元脱失、核固缩、空泡等病理改变减少,丰富环境组细胞水肿等病理改变较模型组改善。见图1。
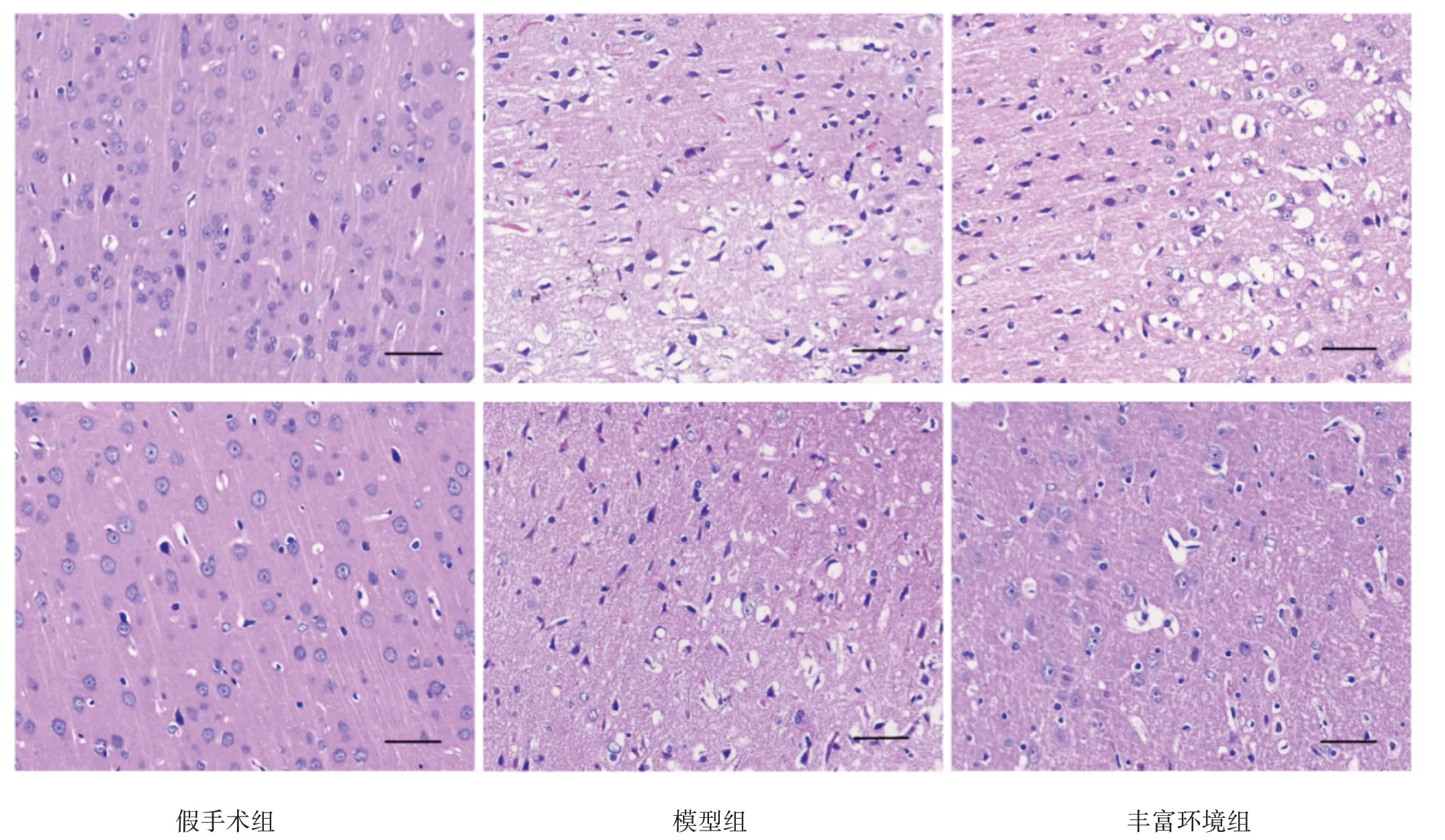
图1 各组脑病理改变(HE染色,bar=50 μm)
2.3 RT‑qPCR
术后1 d,模型组和丰富环境组HIF‑1α、GLUT1和PFKFB3 mRNA 均较假手术组增高(P<0.05),但两组间无显著性差异(P>0.05)。术后28 d,模型组和丰富环境组HIF‑1α、GLUT1 和PFKFB3 mRNA 表达虽有下降,但仍高于假手术组(P<0.05),丰富环境组各mRNA表达高于模型组(P<0.05)。见表2。
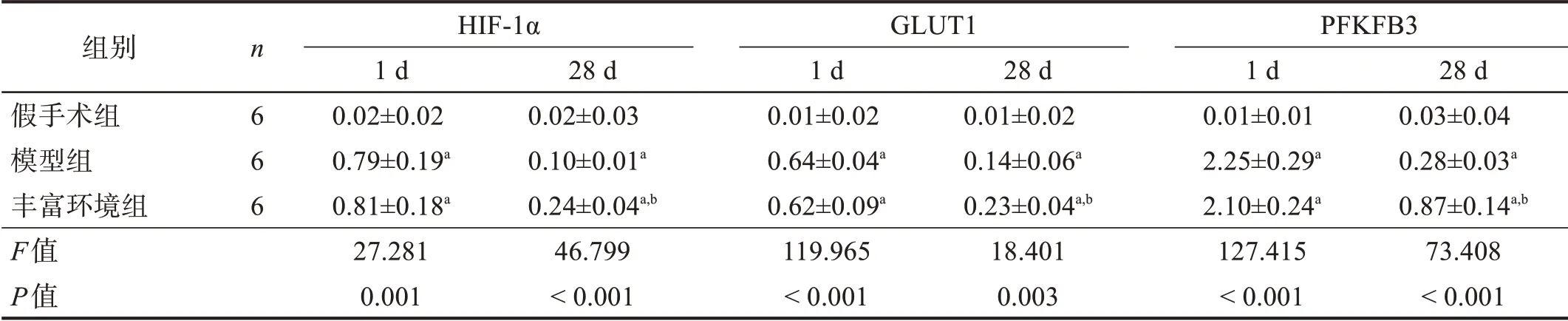
表2 各组HIF-1α、GLUT1和PFKFB3 mRNA表达(2-ΔΔCt)
2.4 Western blotting
术后1 d,模型组和丰富环境组HIF‑1α、GLUT1和PFKFB3 蛋白量均较假手术组增高(P<0.05),但两组间无显著性差异(P>0.05)。术后28 d,模型组与丰富环境组HIF‑1α、GLUT1和PFKFB3蛋白量降低,但仍高于假手术组(P<0.05);丰富环境组各蛋白量高于模型组(P<0.05)。见图2、表3。
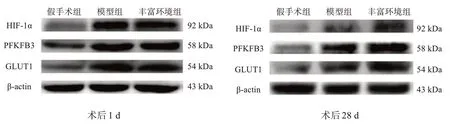
图2 各组HIF-1α、PFKFB3和GLUT1蛋白表达(Western blotting)
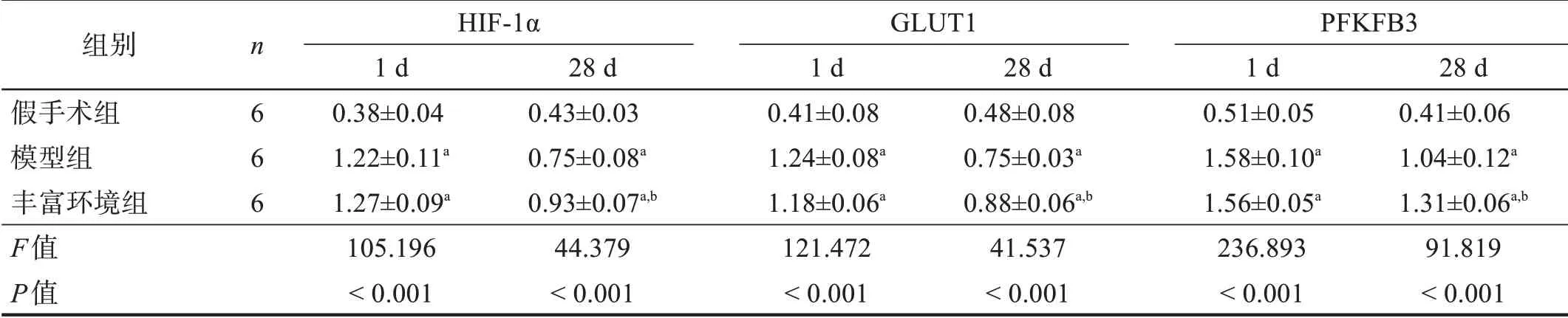
表3 各组HIF-1α、PFKFB3和GLUT1蛋白表达(/β‑actin)
2.5 高效液相色谱法
出峰次序依次为AMP、ADP 和ATP,保留时间分别为7.928 min、8.944 min 和13.438 min,与脑组织杂质峰分离良好。见图3。
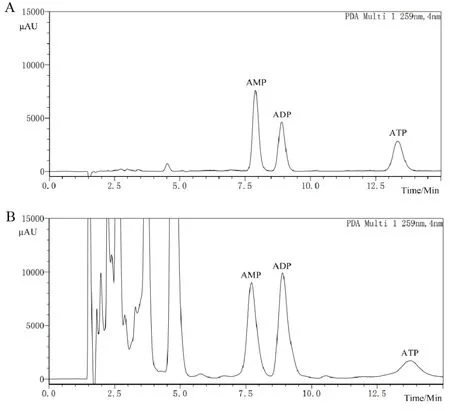
图3 高效液相色谱法分离ATP、ADP和AMP色谱图
术后1 d,与假手术组相比,模型组、丰富环境组ATP、ADP 和EC 下降,AMP 上升(P <0.05);术后28 d,模型组、丰富环境组ATP 和EC 低于假手术组(P <0.05),但丰富环境组高于模型组(P <0.05)。见表4。
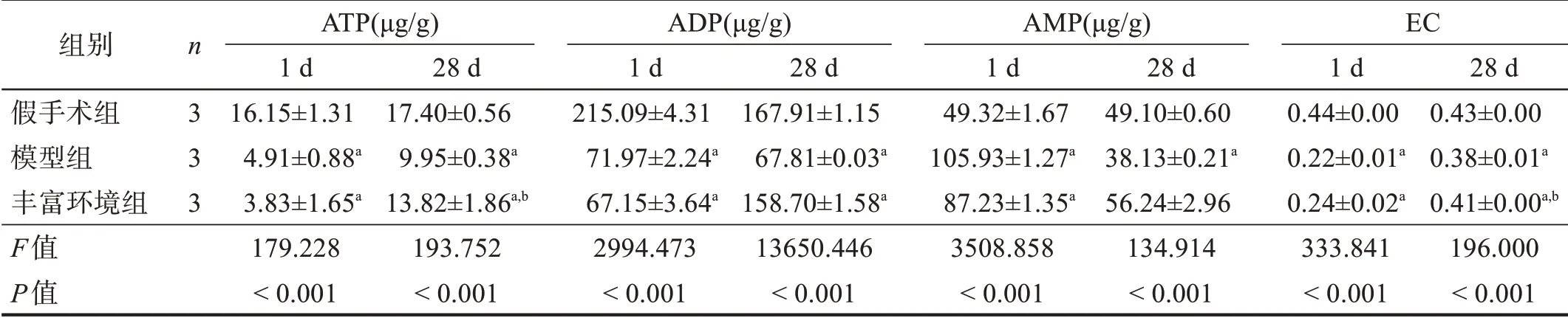
表4 各组ATP、ADP、AMP和EC变化
3 讨论
CIRI 会加重脑组织损伤和神经功能障碍[14]。脑缺血后神经功能恢复除受到生理、病理因素影响外,还与环境因素密切相关[15]。
丰富环境通过配备各种有康复作用的玩具,提供温馨的生活环境,给予研究对象感觉、运动、社会交往等方面的综合刺激,发挥神经保护作用[16‑17]。神经功能依赖于脑组织能量代谢,而能量代谢障碍在脑组织器质性病变发生之前就已经出现[18]。长期丰富环境干预可通过增强突触活动、调节神经炎症反应等方式,恢复缺血后能量代谢紊乱,发挥神经保护作用[19‑20]。
脑的能量代谢状况可通过ATP 的变化观察。在脑缺血模型中,ATP 从缺血核心区到缺血半暗带区呈增加趋势,细胞也表现出从坏死向凋亡的转变[21]。本研究显示,丰富环境干预28 d 后,缺血半暗带区脑组织ATP 较模型组增高,反映细胞能量状态的EC 进一步增大;同时,神经功能改善,缺血半暗带组织病理改变减轻。
Amaral 等[22]发现,脑缺血缺氧后,糖酵解成为脑组织的主要能量来源,缺氧细胞倾向于消耗更多葡萄糖满足能量需求。葡萄糖转运的关键蛋白GLUT1 表达增高代表这种适应性转变[23‑24]。PFKFB3有很强的净激酶活性,抑制PFKFB3 导致糖酵解减少,其介导的葡萄糖代谢是神经保护的重要靶点[25]。本研究显示,丰富环境干预后,GLUT1、PFKFB3 表达上调,提示丰富环境可能增加葡萄糖转运和糖酵解速度,改善能量供应,从而发挥神经保护作用。
HIF‑1α 可改善缺血后神经元存活,促进神经功能恢复[26‑27]。本研究显示,脑缺血后,缺血半暗带区HIF‑1α表达立即增加,丰富环境干预后,HIF‑1α表达较模型组增高。与以前的研究相符[7‑8]。组织缺氧时,HIF‑1α主要通过与其下游低氧反应元件结合,介导相应蛋白产物表达,激活机体应对缺血缺氧引起的病理性损伤[5]。HIF‑1α激活后,上调GLUT1表达,为糖酵解途径补充葡萄糖[28]。在PFKFB3基因增强子区域中含有2 个拷贝的HIF‑1α 结合基序(5'‑ACGTG‑3')[29],在缺氧条件下通过HIF‑1α 介导PFKFB3 表达上调[30],进而增强糖酵解途径,提高细胞对缺氧的耐受。本研究显示,丰富环境干预后,缺血半暗带区HIF‑1α、GLUT1、PFKFB3 的mRNA 与蛋白表达趋势一致,推测丰富环境可能通过上调HIF‑1α 的表达,上调GLUT1 和PFKFB3 的表达,改善缺血区葡萄糖代谢,促进神经元的存活。
综上所述,丰富环境可促进CIRI大鼠神经功能恢复,其机制之一可能通过上调脑缺血半暗带区HIF‑1α及其下游GLUT1、PFKFB3 的表达,提高葡萄糖转运和糖酵解速度,调节脑损伤后能量稳态,从而改善其神经功能。进一步可通过敲除或过表达HIF‑1α 基因,来检测GLUT1、PFKFB3 表达水平,明确丰富环境对HIF‑1α以及GLUT1、PFKFB3的调控关系。
丰富环境作为一种辅助手段,对脑卒中患者神经功能,特别是认知功能和日常生活能力有促进作用[31],有良好的应用前景。但临床丰富环境的设置及干预时间、强度等问题还需要进一步深入研究。
利益冲突声明:所有作者声明不存在利益冲突。

