半边红李炭疽病病害调查及病原菌鉴定
王 群,毕云青,何成兴,郭志祥,钟德卫,李君洪,陈乾昭,游继华,黄正会,李进斌
(1云南省农业科学院农业环境资源研究所,昆明 650205;2云南省昭通市绥江县农业农村局农技推广中心,云南绥江 657700;3绥江县渔业技术服务站,云南绥江 657700)
0 引言
李子(Prunussalicina)是蔷薇科李属植物,其果实含有丰富的营养成分,且酸甜可口,从而深受广大消费者的喜爱[1]。半边红李(P.salicina‘Banbianhong’)在绥江已有70余年种植历史,种植面积已超过5400 hm2,是绥江县的主要支柱产业。由于其优良的品质及较高的经济价值,现被引种到昭通多个县区以及四川、重庆、贵州、江西等省份。但随着种植面积的不断扩大,绥江半边红李病害每年都有发生。主要的病害有炭疽病、红点病、褐腐病和穿孔病等,其中炭疽病尤为严重。炭疽病病菌主要为害叶片、嫩芽及果实,会导致叶片腐烂、枯萎以及果实掉落,严重的时候影响李子的生长和产量。
炭疽病的病原菌为炭疽菌属Colletotrichum真菌,种类十分的复杂繁多,在全球范围均有分布,寄主十分广泛,涉及粮食、经济、果树、花卉、蔬菜等重要作物[2-3],对作物生产安全造成重要影响。自19世纪30年代Corda建立炭疽菌属以来[4],其分类一直较混乱。炭疽菌属发展的初期,分类依据以寄主范围为主,750个新种被描述[4],导致了许多异名同物的出现。20世纪50年代,Arx J.von对所报道的绝大多数真菌标本作了细微的观察与比较后,主要依据寄主上病原菌孢子、产孢细胞等显微形态特征,并结合纯培养特征等将750余种合并为11个种[5]。由于Arx分类系统中种的范围太大,导致了同名异物的出现,实际运用非常不便。20世纪八、九十年代,Sutton在Arx系统的基础上,以纯培养物上产生的分生孢子和附着孢形态特征、大小为主,结合纯培养物特征和寄主范围,把Arx系统中的11个种扩展到39个种,其中包含了部分复合种,如C.gloeosporioides、C.acutatum和C.dematium[3,6]。Sutton的分类系统普遍得到了真菌研究者的认可,但该分类系统中许多形态相似的种仍然难以区分。因此,炭疽菌的分类鉴定一直是菌物学家的研究热点。近年来,分子生物学技术对炭疽菌属的分类鉴定方法产生了重要的影响,属下分类单元也不断增加。目前该属的分类主要包括胶孢炭疽复合群C.gloeosporioidesspecies complex、博宁炭疽复合群C.boninensespecies complex、尖孢炭疽复合群C.acutatumspecies complex、暹罗炭疽复合群C.siamensespecies complex、长直孢炭疽复合群C.gigasporumspecies complex、禾生炭疽复合群C.graminicolaspecies complex、圆孢炭疽复合群C.orbicularespecies complex、平头炭疽复合群C.truncatumspecies complex、白蜡树炭疽复合群C.spaethianumspecies complex、毁灭炭疽复合群C.destructivumspecies complex、束状炭疽复合群C.dematiumspecies complex和尾状炭疽复合群C.caudatumspecies complex等12个复合群和部分独立种[7-16]。真菌rDNA由18S、5.8S、28S三个亚基组成,三亚基之间的内转录间隔区(Internal transcribed spacer,ITS)是核糖体DNA(rDNA)上的非编码区。18S、5.8S及28S rDNA序列进化缓慢且相对保守,但3个基因序列之间的ITS序列则进化相当迅速,因而核糖体rDNA序列广泛用于真菌各级水平的系统学研究[17-18]。ITS区具有鉴定范围最广、成功率最高及种内、种间变异具有最清晰明确的条形码间隔等特点,可作为通用的真菌条形码标记[19]。ITS序列分析现已广泛应用于炭疽菌、疫霉菌、锈菌等植物病原真菌的分类和系统发育的研究。因此,炭疽菌ITS序列对种及种以下的划分具有一定的意义[20-21]。
国内外对李树炭疽病病原菌鉴定研究较少。根据病原菌形态、培养特性和致病性,布朗李(P.americana)炭疽病菌有性世代鉴定为Glomerella cingulata,无性世代为C.gloeosporioides[22]。利用形态学和分子系统学,韩国研究者从日本李(P.salicina)果实上分离鉴定了4种炭疽菌,分别属于胶孢炭疽复合群中的C.gloeosporioidessensu stricto(s.s.)、暹罗炭疽复合群中的C.siamense、尖孢炭疽复合群中的C.nymphaeae和C.foriniae[23],其中C.siamense和C.foriniae首次在李炭疽病中报道。国内对李树(P.salicina)产区的炭疽菌种类还未见报道。本研究对绥江县半边红李炭疽病的为害进行了初步调查,并对其病原菌进行了采集、分离,结合致病性测定、纯培养物上产生的分生孢子形态特征及核糖体ITS序列对其进行初步鉴定,为李树炭疽病的诊断及防治提供理论依据。
1 材料与方法
1.1 试剂及实验地点
CTAB购自Sigma公司;ITS引物合成自上海生工公司;2×Taq PCR Master Mix试剂、Marker DL2000,购自天根生化科技(北京)有限公司;DNA回收试剂盒,购自北京百泰克公司;其他试剂均为国产分析纯。病害调查于2018年7月云南省昭通市绥江县半边红李主要种植区进行,病原菌分离、培养、鉴定及ITS序列分析实验均于2018年8月—2019年12月在云南省农业科学院农业环境资源研究所作物病害实验室进行。
1.2 主要仪器
Sorvall Legend Micro 21R离心机,德国Themo Scientific公司生产;C1000 Touch DNA扩增仪,美国Bio-Rad公司生产;BIO-RAD PowerPacTM Basic电泳仪,美国Bio-Rad公司生产;DYCP-31DN电泳槽,北京六一仪器厂;ChemiDocTM XRS+凝胶成像系统,美国Bio-Rad公司生产;MGC-400B光照培养箱,上海一恒科学仪器有限公司;Nikon 80i显微镜,日本Nikon公司生产。
1.3 炭疽病病害调查及标样的采集
2018年7月,采用5点取样法分别对云南省昭通市绥江县半边红李2个主要种植区会仪镇及新滩镇各3个果园进行炭疽病的病害调查。每点随机选取5株,每株从东南西北4个方向每个方向随机采集10片叶片调查病害发病级别。根据病斑面积占叶面积的比例,李子炭疽病病害分级标准参照辣椒炭疽病的0~9级分级标准[24]。分级标准如下:
0级:无病斑;高抗
1级:1%~2%的叶片病斑侵染面积或有一个水浸状病斑;抗病。
3级:坏死性病斑叶面积>2%~5%,可能出现分生孢子盘,或5%的叶片出现水浸状病斑;中抗。
5级:坏死性病斑叶面积>5%~15%,有分生孢子盘,或25%的叶片出现水浸状病斑;中感。
7级:坏死性病斑叶面积>15%~25%,有分生孢子盘;感病。
9级:坏死性病斑叶面积>25%,有大量分生孢子盘;高感。
发病率和病情指数分别用公式(1)和公式(2)计算[25-26]。

采集炭疽病症状典型的发病叶片为标样,病害标样在病菌分离前4℃储存。
1.4 病原菌组织、单孢菌株的分离及分生孢子形态观察
病原菌组织分离参照杨树炭疽菌的分离方法[27]。方法如下:健康组织和病变组织交界面切取3个5×5 mm的样品,用70%乙醇浸泡1 min,然后用1%次氯酸钠浸泡3~4 min,用无菌水洗涤3次。然后将叶段置于马铃薯葡萄糖琼脂(PDA)培养基表面,在25℃下培养。1~2天后将叶段发育的真菌菌丝生长边缘转移到新的PDA平板上以供后续研究使用。
单胞分离参照方中达的方法分离[28]。蘸取分生孢子团至无菌水中,稀释至105孢子/mL,取10 μL上述孢子液均匀涂布在WA(1%水琼脂)平板上,25℃培养12 h后在光学显微镜下挑取萌发的单孢子接种于PDA平板上,5天后观察菌株菌落及分生孢子形态。各菌株随机选取10个孢子利用ImageJ软件测量孢子大小,并计算长度及宽度的比值,采用Duncan’s新复极差测验进行多重比较。
1.5 半边红李炭疽病病原菌致病性鉴定
病原菌致病性鉴定根据柯赫氏法则进行。采集半边红李树健康叶片,自来水清洗叶片表面,再用无菌水冲洗3~4次;将分离的菌株活化后,接种到PDA平板上,25℃培养3天,用直径为5 mm的无菌打孔器沿菌落边缘打取菌丝块,接种到叶片上。对照为直径5 mm的清水培养基块。由于炭疽病菌具有潜伏侵染特性且潜伏期较长,采用刺伤法(接种针刺破叶片表皮,但不刺穿叶片)接种,保持湿度90%以上,温度23℃。接种4天后,移去菌株块,7天后记录发病情况。并镜检病原菌形态,与分离菌比较。
1.6 半边红李炭疽病菌的分子鉴定
1.6.1 菌丝的收集及基因组DNA的提取 菌丝培养:将培养3天的菌株沿菌落边缘挑取5个菌丝块,移入装有80 mL PDB(配方同PDA培养基,但不含琼脂)的三角瓶中,在100 r/min的摇床上25℃培养5天,4层纱布过滤收集病原菌的菌丝,-80℃保存。用CTAB法提取基因组DNA[29]。
1.6.2 病原菌rDNA基因转录间隔区序列(ITS)的PCR扩增及测序 利用真菌ITS通用引物ITS1(5'TCCGTAGGTGAACCTGCGG 3')和 ITS4(5'TCCTCC GCTTATTGATATGC 3')[30],以病原菌基因组DNA为模板扩增包含ITS1、5.8S rDNA、ITS2、部分18S rDNA和28S rDNA的DNA片段。PCR反应体系为30 μL,包含Mix 15 μL,引物各1 μL,DNA模板1 μL,ddH2O 12 μL,于 DNA扩增仪上进行扩增。PCR扩增反应程序为:98℃预变性3 min;98℃变性10 s,55℃退火10 s,72℃延伸10 s,共35个循环;最后72℃延伸5 min,4℃保存。用1%琼脂糖凝胶电泳检测扩增结果。利用DNA回收试剂盒回收PCR扩增产物,方法参见试剂盒说明书。PCR产物送昆明硕擎生物科技有限公司进行测序,每个反应重复3次。
1.6.3 病原菌ITS片段的序列分析 用LasergenV7.1.0中的seqman软件对序列进行拼接,并手工校正,两端进行修剪。将拼接的序列导入Genbank中进行Blast分析,下载同源性高的序列进行比对分析。序列比对在CLUSTAL W 1.81中进行[31];系统进化分析利用MEGA7.0[32-33],采用极大似然法构建系统树。基于Tamura-Nei model的核酸替代模型,各位点间的进化速率为一致,缺失或空位记为完全缺失。
Bootstrap法进行系统树检验,重复次数为1000。
2 结果与分析
2.1 炭疽病病害调查结果
炭疽病危害叶片的症状主要有两类:一类沿叶缘开始发病,病斑由小至大,典型病斑成轮纹状扩展;另一类病斑多在叶片尖端开始发病,叶片边缘发病较少,病斑较大,典型的轮纹状病斑,病斑边缘紫褐色。炭疽病病害调查结果见表1。由表1可以看出,会仪镇黄坪村3个果园炭疽病的发病率为20%,病情指数为20.4;新滩鲢鱼村3个果园炭疽病的发病率达到50%,病情指数为78.5。同时,从海拔梯度来看,500~700 m海拔危害程度最严重,其次是700~900 m海拔,380~500 m海拔发病程度最轻,表明会仪镇黄坪村和新滩镇鲢鱼村的半边红李果园有不同程度的炭疽病危害,其中新滩镇鲢鱼村比会仪镇黄坪村的危害程度严重,不同海拔果园炭疽病的危害程度也不相同。
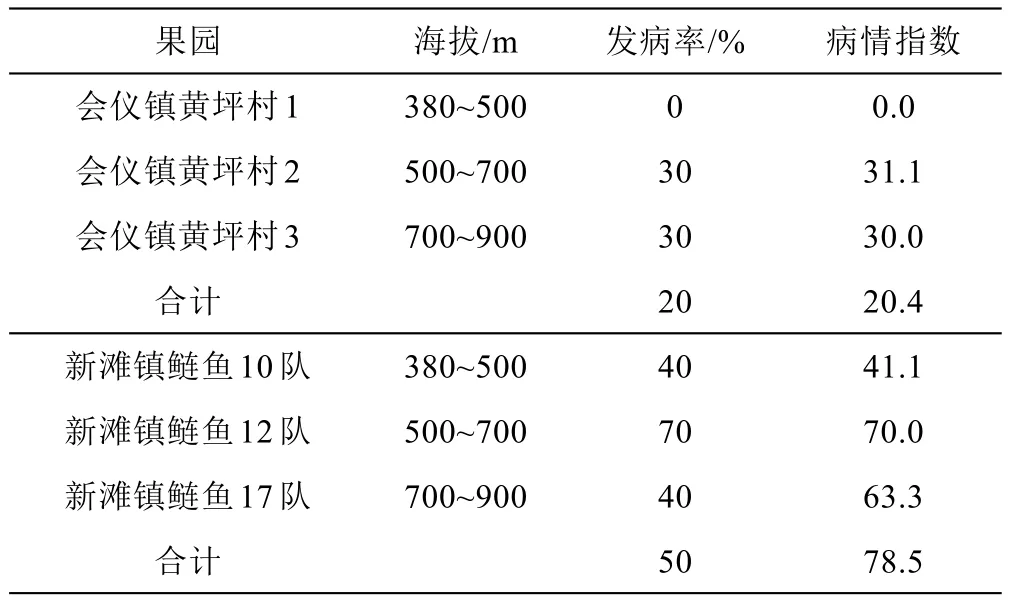
表1 基于0~9级分级标准的绥江6个半边红李果园炭疽病发病率及病情指数
2.2 半边红李炭疽病菌形态学鉴定
对绥江县会仪黄坪镇黄坪村、新滩镇鲢鱼村半边红李果园采集的症状典型的炭疽病叶片进行了单孢分离,共获得15株分离株。根据分生孢子形态,发现4种类型的分生孢子(图1),其代表菌株分别为18-8-D1、18-4-C2、18-8-C1及18-5-B1。其中18-5-B1菌株的分生孢子梭形,直孢,末端钝;18-8-C1菌株的分生孢子为圆柱状,直孢;18-8-D1菌株的分生孢子为弯孢型,端钝,有3-5隔;18-4-C2菌株的分生孢子为纺锤型,两端渐尖,2隔,具1-3根附属丝。平板菌落形态没有明显的差异,菌落白色,菌丝生长茂密厚实,菌落背面中心颜色较深,为淡黄色或黑绿色(图1)。4种分生孢子大小测量结果见表2。表2可以看出,分生孢子长度以菌株18-8-D1最长,达21.94±2.25 μm,其次是菌株18-4-C2;除18-5-B1与18-8-C1长度差异不明显外,其余菌株间长度差异均达极显著。分生孢子宽度以菌株18-4-C2最宽,达4.72±0.64 μm,其次是18-5-B1(4.35±0.53),18-8-D1最窄(2.62±0.52);除18-4-C2与18-5-B1、18-5-B1与18-8-C1之间宽度差异不显著外,其余菌株间均达极显著;分生孢子长宽比以菌株18-8-D1为最大,其中18-8-D1与其他菌株间差异极显著,其他菌株间差异均不显著。
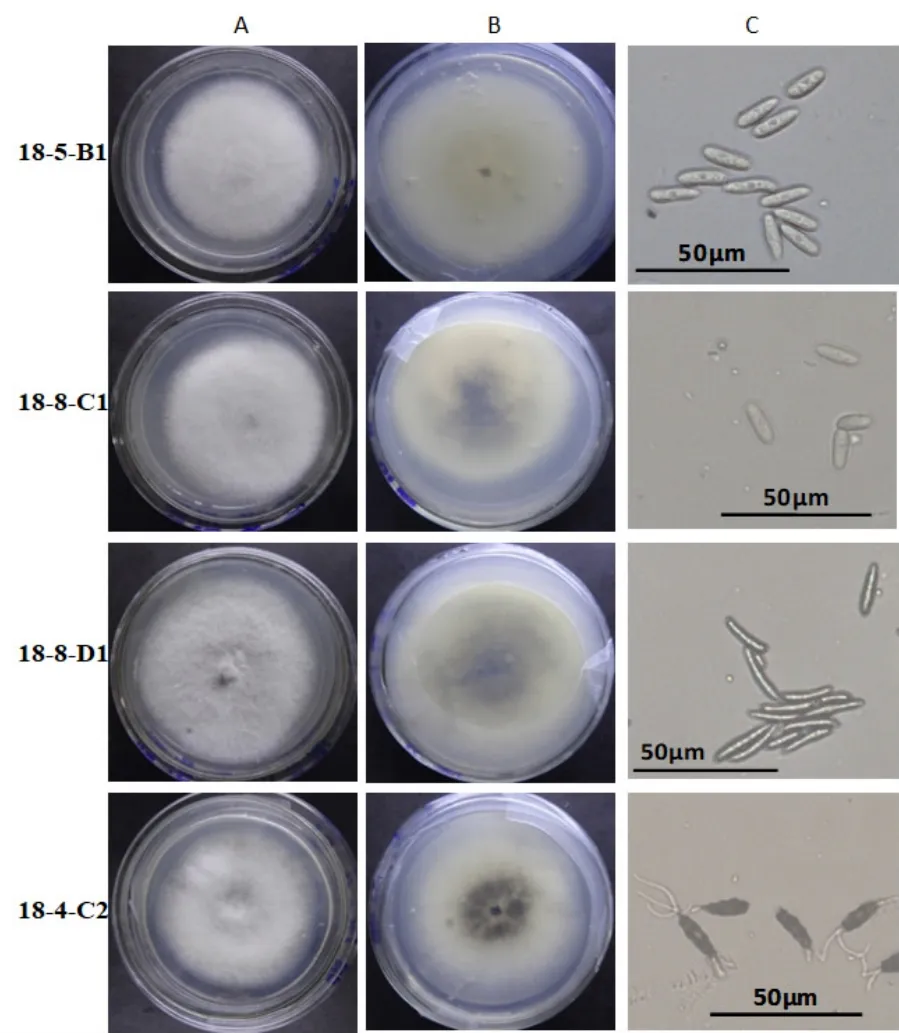
图1 半边红李炭疽病菌株18-5-B1、18-8-C1、18-8-D1和18-4-C2菌落及分生孢子形态

表2 云南绥江半边红李炭疽病分离菌株分生孢子大小
2.3 李炭疽菌的Korho验证
根据柯赫氏法则,将分离到的病原菌接种在健康的李树叶片进行了离体鉴定,部分结果见图2。回接的鉴定结果表明前述分离到的病原菌均产生了特征明显的炭疽病病斑,并从病斑上分离获得与接种相同的病原菌。这个结果说明本研究成功分离到了李炭疽病的致病菌,且分离到的菌株均致病。

图2 半边红李炭疽病分离菌株18-8-C1、18-5-B1接种离体叶片9天后的发病症状
2.4 李炭疽病病原菌ITS序列分析
利用真菌通用引物ITS1和ITS4分别扩增了15个菌株的rDNA ITS片段,部分扩增结果见图3。除去1个菌株没有扩增产物外,其余14个菌株均成功扩增出了ITS区段。

图3 部分半边红李炭疽病菌分离株ITS引物PCR扩增电泳图
对4种分生孢子类型的代表菌株18-5-B1、18-8-C1、18-8-D1和18-4-C2的ITS PCR扩增产物进行了测序,在Genbank中对其序列进行了同源性比较(http://www.ncbi.nlm.nih.gov),发现这4条序列与炭疽菌属ITS序列同源性较高。鉴于Genbank中炭疽菌ITS序列数量巨大,物种信息及ITS序列质量难以获得保障,为了进一步鉴定半边红李炭疽菌,选择经过模式标本和序列质量、长度验证后重新注释和格式化后的参考序列(refseq,Genbank中序列前缀为NR-)为主,已发表论文中引用的Genbank序列为辅,下载了12个炭疽菌复合群内的110种、2亚种共139条ITS序列进行系统分析,Genbank序列号见附录1。下载序列中,胶孢炭疽复合群包括23种2亚种27条序列,博宁炭疽复合群15种15条序列,尖孢炭疽复合群32种37条序列,暹罗炭疽复合群6种11条序列,长直孢炭疽复合群7个种7条序列,禾生炭疽复合群1个种1条序列,圆孢炭疽复合群7个种7条序列,平头炭疽复合群1种1条序列,白蜡树炭疽复合群1种1条序列,毁灭炭疽复合群11种11条序列,束状炭疽复合群1种1条序列,尾状炭疽复合群5种20条序列。构建的ML系统树为无根树(图4),SBL=0.4998,似然比值(log likelihood=-1744.35),模型为 TN93,Ts/Tv=2.1680。由图4可以看出,半边红李分离到的4个菌株(18-8-D1、18-4-C2、18-8-C1和18-5-B1)与胶孢炭疽复合群、暹罗炭疽复合群以及一个长直孢炭疽聚在一个分支中,暗示这些菌株与胶孢炭疽复合群和暹罗炭疽复合群亲缘关系较近;其余复合群都各自聚为一支,暗示ITS序列可以作为一个很好的分子标记用以区分炭疽复合群之间的关系。菌株18-8-C1与NR120142、18-8-D1与 NR144783、18-4-C2与NR120133及菌株18-5-B1与GQ485601关系较近(图4),但支持率不高。由附录1,可知NR120142、NR144783及NR120133分别为胶孢炭疽复合群中的C.clidemiae、C.fructicola及C.aeschynomenes的ITS序列,GQ485601为暹罗炭疽复合群中的C.hymenocallidis的ITS序列。分别将本研究中分离到的菌株分生孢子形态大小及菌落形态与C.clidemiae[15]、C.fructicola[15,34]、C.aeschynomenes[15]、C.hymenocallidis[35]的相比较,发现均存在一些差异。因此,本项研究仅可以初步鉴定绥江半边红李炭疽病为胶孢炭疽复合群和暹罗炭疽复合群中的炭疽菌引起,具体种类归属有待进一步研究。
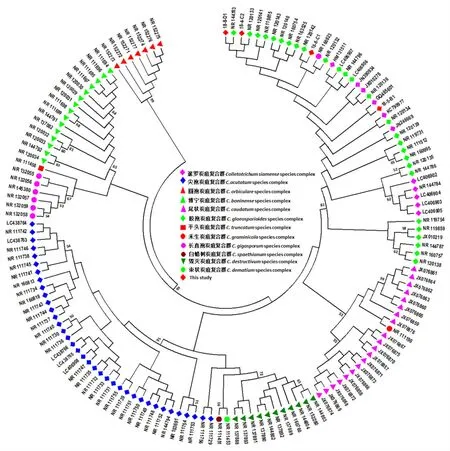
图4 基于4个半边红李炭疽病菌及Genbank中下载的139条炭疽菌ITS序列的ML系统进化分析
3 讨论
炭疽病是粮食、经济、果树、花卉、蔬菜等重要作物上的一种比较严重的病害,不仅会影响作物的产量,还会影响作物的品质。掌握病害的为害状况对炭疽病的防控有重要的指导意义。笔者对昭通绥江半边红李炭疽病为害状况调查表明,会仪镇黄坪村和新滩镇鲢鱼村的半边红李果园有不同程度的炭疽病危害,其中新滩镇鲢鱼村比会仪镇黄坪村的危害程度严重,新滩鲢鱼村的发病率达到50%,病情指数为78.5;从海拔梯度来看,500~700 m海拔危害程度最严重。因此,对炭疽病为害较严重的半边红李果园要加强防控,且重点关注海拔500 m以上的果园。
病原菌的鉴定对病害的确诊及防治有重要的参考价值。炭疽病菌因分布广泛,寄主范围复杂多样,形态特征差异较大而使其系统分类也变得扑朔迷离。其分类历史经历了依靠寄主阶段、寄主上繁殖体显微形态特征及纯培养特征阶段、纯培养物上产生的分生孢子和附着孢形态特征大小及纯培养物特征和寄主范围阶段,一直到现在的分子生物技术手段结合分生孢子和附着孢的形态特征及大小阶段。每个分类阶段都对炭疽菌的分类知识有新的认知。由于形态特征稳定性差且易受培养条件的影响,单独依靠形态特征进行系统分析是不可靠的,所以利用遗传特征稳定的性状来研究炭疽菌种间差异和系统学关系非常关键。分子标记技术的发展对真菌分类造成了很大的影响。目前炭疽菌的分类依据主要结合前辈的分类系统,以附着孢、分生孢子的形态特征、大小,纯培养特征以及进化速率合适的分子片段的序列构建系统进化树来确定其归属。基于ApMat标记,芒果炭疽菌属于C.siamensesensulato,包括C.jasminisambac、C.hymenocallidis、C.melanocaulon和C.siamensesensustricto等4个种以及3个新的潜在的未定名的系谱[14]。北京4个地区杨树炭疽病由胶孢炭疽菌(C.gloeosporioideoes)和新种C.populi引起[27]。中国茶树炭疽病菌基于形态特征和分子系统分析鉴定为尖孢炭疽复合群和胶孢炭疽复合群[36]。比利时苹果苦腐病果实中分离鉴定了6种炭疽菌,分别是C.godetiae、C.fioriniae、C.salicis、疑似C.kahawae、C.nymphaeae、C.rhombiforme和C.acutatum,分属胶孢炭疽复合群和尖孢炭疽复合群[37]。其中C.godetiae是比利时果园中最常见的致病菌。不同国家不同地区辣椒约有10多种炭疽菌引起炭疽病[38-43]。例如,美国辣椒炭疽病由C.acutatum、C.coccodes和C.gloeosporioides引起;澳大利亚辣椒炭疽病由C.acutatum、C.dematium、C.gloeosporioides和C.truncatum引起;韩国辣椒炭疽病由C.acutatum、C.coccodes、C.dematium、C.gloeosporioides和C.panacicola等引起[43]。印度辣椒炭疽病是由C.coccodes、C.fructicola、C.siamense和C.truncatum引起的[42];中国辣椒炭疽病由C.acutatum、C.gloeosporioides、C.truncatum、C.coccodes、C.fioriniae、C.fructicola、C.scovillei、C.conoides、C.grossum、C.liaoningense、C.aenigma、C.cliviae、C.endophytica、C.hymenocallidis、C.incanum、C.karstii和C.viniferum等引起[38-39,41]。因此,炭疽病菌不仅因寄主而多样复杂,也因不同地域而多样化。
本研究首次对中国李树地方品种半边红李上的炭疽病病原菌进行了分离,获得4种类型分生孢子,经回接验证均对李子叶片致病。仅从半边红李炭疽菌分生孢子形态来看,18-4-C2与其他菌株形态差异较大,分生孢子具1~3根附属丝。附属丝被认为是尾状炭疽复合群中炭疽菌特有的形态特征[16],但ITS序列分析暗示18-4-C2并不属于尾状炭疽复合群。由于附属丝环境条件的不同而变化[44],其作为炭疽菌的分类特征存在争议,因此18-4-C2是否是胶孢炭疽复合群的新种有待进一步研究。结合分生孢子形态大小、菌落特征及其ITS序列构建的系统树,初步将所分离到的炭疽菌归入胶孢炭疽复合群C.gloeosporioidescomplex species和暹罗炭疽复合群C.siamensecomplex species。系统树表明半边红李炭疽菌与胶孢炭疽复合群中的C.clidemiae、C.fructicola、C.aeschynomenes及暹罗炭疽复合群中的C.hymenocallidis有一定的联系(图4),但支持率不高,且分生孢子形态及菌落与这些相关种之间存在一定差异。仅从涉及的复合群可以看出,半边红李炭疽菌与韩国日本李炭疽菌部分相同。这个结果与辣椒炭疽菌结果类同,即不同区域相同寄主炭疽菌种类不同。为明确中国李树炭疽病的种类,还应对其他地区的李树炭疽病进行鉴定。
胶孢炭疽复合群包括C.asianum、C.cordylinicola、C.fructicola、C.gloeosporioides、C.horii、C.kahawaesubsp.Kahawae、C.musae、C.nupharicola、C.psidii、C.siamense、C.theobromicola、C.tropicale、C.xanthorrhoeae、C.aenigma、C.aeschynomenes、C.alatae、C.alienum、C.aotearoa、C.clidemiae、C.kahawaesubsp.Ciggaro、C.salsolae、C.ti和C.queenslandicum等22种1个亚种[15],暹罗炭疽复合群包括C.jasmini-sambac、C.hymenocallidis、C.dianesei、C.siamense、C.endomangiferae、C.communis及身份模糊的C.murrayae等7个种[45]。由于胶孢炭疽复合群和暹罗炭疽复合群所涉及的种类较多,且ITS标记并不能很好地区分胶孢炭疽复合群和暹罗炭疽复合群内一些种间的关系[14-15],因此绥江半边红李炭疽菌的鉴定还有待联合多个分子标记对其进行分析。
4 结论
云南省绥江半边红李炭疽病为害状况调查表明半边红李果园有不同程度的炭疽病危害,其中新滩镇鲢鱼村比会仪镇黄坪村的危害程度严重,新滩鲢鱼村的发病率达到50%,病情指数为78.5,会仪镇黄坪的发病率达到20%,病情指数为20.4;且500~700 m海拔危害程度最严重。
单孢分离获得15株李炭疽病分离株,各分离株平板菌落形态略有差异,获得4类不同的分生孢子,经回接验证均致病。rDNA ITS序列系统进化分析初步推定半边红李炭疽病的病原菌为胶孢炭疽复合群Colletotrichumgloeosporioidesspecies complex和暹罗炭疽复合群C.siamensespeciescomplex。
与韩国研究人员对日本李树炭疽菌所属种类比较,半边红李炭疽菌不涉及尖孢炭疽复合群中的种类,涉及的胶孢炭疽复合群和暹罗炭疽复合群中的种类是否与韩国的相同有待半边红李炭疽菌种类确定后再做讨论。仅从涉及的复合群可以看出,半边红李炭疽菌与韩国日本李炭疽菌部分相同。

