5株纤维菌属菌株的分离、鉴定及产酶活性研究
王光琴,黄 莺,温明霞,芶剑渝,代 飞,丁梦娇
(1贵州大学烟草学院,贵阳 550025;2贵州省烟草品质研究重点实验室,贵阳 550025;3贵州省烟草公司遵义市公司,贵州遵义 563000;4贵州省烟草公司安顺市公司,贵州安顺 561000)
0 引言
全世界秸秆年产量超过29亿t,中国是粮食生产大国,也是秸秆生产大国,每年生产的作物秸杆超过7亿t,约占全世界秸秆总量的20%~30%[1]。作物秸秆作为农业生产的生物质副产品,具有巨大的潜在利用价值[2],特别是在改良土壤养分上被广泛认可。秸秆还田可为作物生长提供必需的C、N等营养元素,也能改善土壤通气疏水性,是构建肥沃耕层、提升土壤质量的重要措施[3-4]。作物秸秆结构极为稳定,其中纤维素是主要成分,占总量的35%~50%,是自然界中储量最丰富的生物高分子[5],只有浓酸溶液、高浓度的氯化锌水溶液、铜氨溶液和离子液体才可能破坏纤维素的晶体结构使其溶解[6]。所以秸秆直接还田降解速度慢不仅影响下茬作物的种植,还田不当也会造成农田面源污染[7]。
生物降解法是绿色高效分解纤维素的主要途径之一,近年来,中外大量学者从多种材料中筛选出具有纤维素降解能力的菌株,菌剂的施用不仅有效加快秸秆腐解,还对土壤养分、土壤微生物及作物产量有一定的促进作用。金海洋等[8]研究表明与秸秆直接还田相比,水稻秸秆还田中应用由分解纤维素的芽抱杆菌属(Bacillus)和分解脂肽梭菌属(Clostridium)7个菌株组成的菌剂,可以降低水稻秸秆的强度,增加土壤纤维素酶的活性,加速秸秆的降解,增加下季作物产量。赵伟等[9]通过3年菌剂降解秸秆直接还田试验,菌剂降解秸秆直接还田增加了土壤有机质、微生物量碳、全氮、微生物量氮含量和C/N。Hart等[10]筛选的一株真菌添施于小麦秸秆,显著降低了其C/N值,提高了土壤团聚体稳定性。
但大部分筛选的秸秆分解菌剂存在生产周期长,产品质量不稳定,易污染,纤维素酶活较低等问题。基于此,本研究以贵州典型烟区植烟土壤为高效筛选纤维素分解菌材料,以玉米秸秆粉为碳源,旨在筛选出具有高效降解玉米秸秆能力、适宜于贵州烟区秸秆还田适用菌株。
1 材料与方法
1.1 试验材料
1.1.1 土样采集 供高效纤维素分解菌筛选的土壤以无菌方式采自贵州典型植烟区安顺、毕节和遵义,玉米秸秆粉来自安顺平坝。试验是在贵州省烟草品质研究重点实验室,于2019年11月—2020年10月份进行。
1.1.2 主要培养基及主要试剂 培养基:富集培养基[11];分离培养基:NA培养基,马丁氏琼脂培养基,改良高氏Ⅰ号培养基[12];鉴别培养基(CMC培养基)[13];液体发酵产酶培养基[14]。
试剂:0.1%刚果红染液;0.05 mol/L柠檬酸-柠檬酸钠缓冲液(pH 4.8);1%CMC-Na溶液;3,5-二硝基水杨酸显色剂[15]。
1.2 研究方法
1.2.1 纤维素分解菌的富集、分离纯化与初筛 称取10.0 g土样于90 mL灭菌含玻璃珠的蒸馏水中,并在摇床上以150 r/min振荡1 h后静置5 min,随后取2 mL上清液于已灭菌冷却的富集培养基中,20℃180 r/min振荡培养3天。按无菌操作要求,将富集后的培养液梯度稀释,取稀释液10-6、10-7、10-80.1 mL涂布于NA培养基用于细菌的分离、取稀释液10-4、10-5、10-60.1 mL分别涂布于孟加拉红培养基用于真菌的分离和高氏一号培养基用于放线菌的分离。每个梯度分别设置3组平行,细菌于37℃倒置培养1~2天,真菌、放线菌于28℃倒置培养6~7天。将平板中长出的单菌落在相应培养基中纯化,用无菌接种环挑取纯化单菌株三点法将其点接在CMC-Na鉴别培养基上,选择能在培养基上生长的菌株,用0.1%刚果红染液染色10 min,再用1 mol/L NaCl溶液脱色15 min,倒出平板上多余的溶液,最后,根据培养基平板上透明圈直径(D)与菌落直径(d)比值的大小,初步筛选出纤维素优势分解菌。
1.2.2 菌株拮抗实验 将初筛纯化后获得的单菌株于LB培养基上两两相交划线,28℃倒置培养2~3天,待长丰满看菌株相交处是否有抑菌圈产生,没有抑菌圈产生表示菌株间没有拮抗作用,可进行复合菌剂的制备。
1.2.3 生长曲线测定 挑取纯化活化单菌株于LB培养基中28℃180 r/min培养,每隔4 h取样,用可见分光光度计测定其浓度,绘制生长曲线,对浓度大的菌悬液用未接种的LB培养基适当稀释后测定,使其OD值在0.10~0.65以内,经稀释后测得的OD值乘以稀释倍数。
1.2.4 单菌株及复合菌剂的酶活测定
(1)粗酶液的制备。分别将在CMC-Na鉴别培养基上D/d值大于2.5的纯化菌株于LB培养基28℃180 r/min振荡培养制成种子液。取2 mL的种子液接种至100 mL的产酶发酵培养基中,28℃180 r/min的摇床中培养连续培养10天后5000 r/min离心15 min,收集上清,作为粗酶提取液。
(2)羧甲基纤维素钠酶活力(CMCase)测定。取0.5 mL粗酶液,依据刘霄[16]测定纤维素酶活方法,得出菌株纤维素酶活性,每隔24 h取样测定。酶活力单位(U/mL)定义为:1 mL酶液1 min催化底物水解生成1 μg葡萄糖所需要的纤维素酶量为一个单位酶活。
1.3 菌株形态学鉴定
将菌株分别于LB培养基与高氏一号培养基进行纯化,菌株生长稳定进行菌落形态描述。采用革兰氏染色法对筛选得到的纤维素分解菌进行革兰氏染色试验,通过显微镜观察形态特征,通过染色反应呈现颜色不同判定属革兰氏阳性菌(G+)或革兰氏阴性菌(G-)。
1.4 菌株分子生物学鉴定
1.4.1 菌株DNA的提取 本研究选择使用天根生化科技(北京)有限公司的细菌基因组DNA提取试剂盒(离心柱型)进行菌株DNA的提取。
1.4.2 PCR扩增 PCR扩增引物采用细菌16SrDNA通用引物,正向引物为27F(5'-AGAGTTTGATCCTG GCTCAG-3'),反向引物为 1492R(5'-GGTTACC TTGTTACGACTT-3')。PCR反应体系25 μL:1.1×T3 Super PCR Mix 22 μL,引物 27 F(10 μmol/L)1.0 μL,引物 1492 R(10 μmol/L)1.0 μL,Template DNA 1 μL。PCR热循环条件:98℃预变性2 min 98℃变性10 min,55℃退火 10 s,72℃延伸 20 s,72℃修复延伸 2 min,4℃终止反应∞,32个循环。取2 μL PCR产物在2%的琼脂糖凝胶上进行电泳检测。
1.4.3 序列测定 将PCR扩增产物通过1%琼脂糖凝胶电泳确定条带亮度。将PCR扩增产物送往北京擎科生物科技有限公司重庆分公司进行基因序列的测定,将测序结果通过国家生物技术信息中心(NCBI)BLAST程序进行序列相似性搜索。并利用MEGA X.0软件构建系统发育树。
1.5 菌株对玉米秸秆降解率的测定
选择最佳处理菌剂(单菌剂或复合菌剂)以5%的接种量添施于已灭菌的玉米秸秆,通过失重法测定其降解率。秸秆处理为2~3 cm长度,称取20 g放置于500 mL的容量瓶盖上封口膜以保持其充足的透气空间而不被污染,将容量瓶放置于室温(28℃左右)下,约2天晃动一次,当观察到明显腐解现象时测定其降解率。将培养相应时间的秸秆用无菌水清洗数次以除去秸秆表面大量菌体,弃去液体部分,60℃烘干至恒重后称重计算失重率。秸秆腐解率的计算见公式(1)。
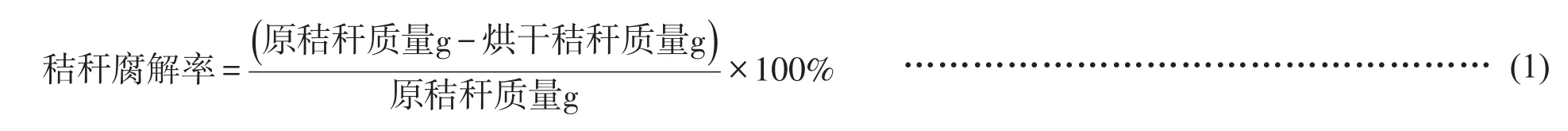
2 结果与分析
2.1 纤维素分解菌的富集、分离与纯化
通过以玉米秸秆为唯一碳源富集培养基培养,细菌、放线菌、真菌培养基上单菌株的分离、纯化,最终共获得纯菌株44株。
2.2 纤维素分解菌的初筛
通过在CMC鉴别培养基平板上利用刚果红染色法对分离纯化的菌株进行染色,对纤维素分解菌进行初步筛选。根据培养基平板上是否能产生水解圈以及透明圈直径(D)与菌落直径(d)比值的大小,初步筛选出能够分解纤维素以及降解效果较好的菌株,共20株,其中细菌8株、放线菌8株、真菌4株。D/d越大,说明菌株产生的纤维素酶活性高或其纤维素酶量越大,因此初步筛选出5株优势纤维素分解菌,其中3株来源于遵义湄潭烟区土壤,命名为FCM-1、FCM-10、FCM-11、1株来源于安顺杨武烟区土壤,命名为FCY-2,1株来源于毕节威宁植烟土壤,命名为FCW-2。经过2天培养后,刚果红染色结果发现,5株菌株菌体直径较小(约为0.2 cm)却产生了较大的透明圈(图1),其中比值最大的是FCM-10,D/d为4.2(表1)。

图1 纤维素分解菌菌株刚果红染色

表1 纤维素分解菌菌株刚果红染色初筛结果
2.3 纤维素分解菌的拮抗实验
通过对初筛出的5株纤维素分解菌进行拮抗实验,结果显示,5株菌株生长交接处无抑菌圈或抑生孢子产生,说明菌株间无拮抗作用,可进行复合菌剂的配制。通过菌株两两配制,共得到10个复合菌剂。这可能是由于这些菌株都是由贵州烟区植烟土壤中筛选而得,生长环境大致相同,所以菌株间无拮抗作用。
2.4 纤维素分解菌生长曲线的测定
通过对5株纤维素分解菌生长曲线的测定(图2),可知5株菌株4~12 h为生长迟缓期,16 h开始一直到44 h较快增长,48 h后趋于稳定。对数期酶系活跃,代谢旺盛,所以选择16~44 h时间段作为提取菌株DNA最佳时期以及测定酶活最佳接种期。

图2 纤维素分解菌菌株生长曲线
2.5 纤维素分解菌酶活力测定
通过发酵产酶培养,对菌株FCM-1、FCM-10、FCM-11、FCY-2和FCW-2及其配制的复合菌剂共15个处理分别于2、5和7天测定其CMCase活性,结果表明(表2),5株纤维素分解菌单菌株中FCM-10菌株除了5天时与FCM-11差异不显著,在2天和7天时CMCase活性最大,在7天达最大(260.45 U/mL)与其他单菌株呈显著性差异,其次为FCM-11菌株,在5天达最大(243.85 U/mL)。在10种复合菌剂中,不同时间不同菌株复合所产酶活不同,在2天时CMCase活性值最大的是15号菌剂FCY-2+FCW-2,达290.38 U/mL,是其单菌株的1.48倍和1.98倍;在5天时CMCase活性值最大的是11号菌剂FCM-10+FCY-2,达314.39 U/mL,是其单菌株的1.2倍和1.53倍;在7天时CMCase活性值最大的是6号菌剂FCM-1+FCM-10,达358.11 U/mL,是其单菌株的2.51倍和1.37倍。
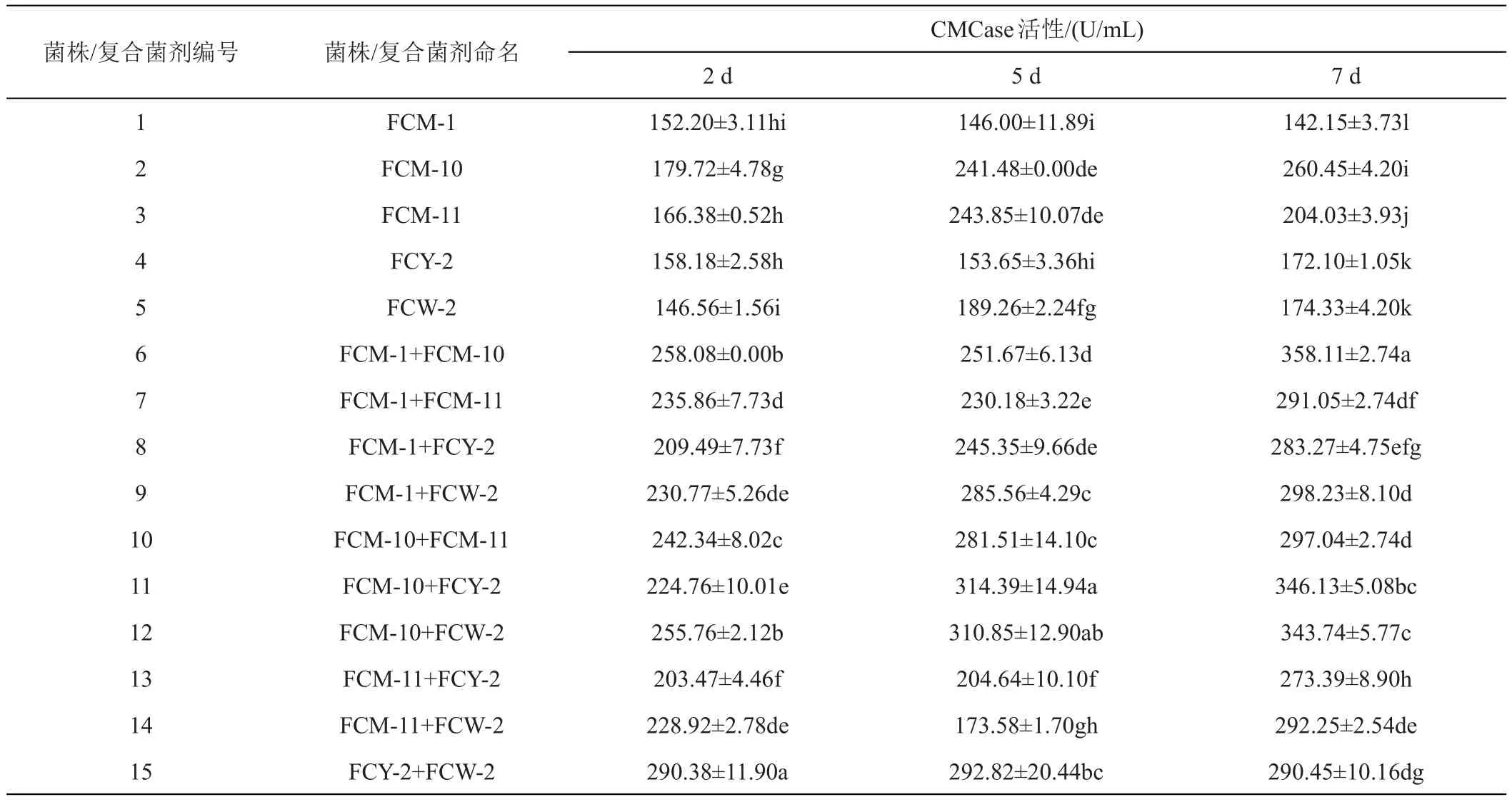
表2 纤维素分解菌菌株及其复合菌剂CMC酶活性
2.6 5株纤维素分解菌菌株鉴定
2.6.1 形态学鉴定 将5株纤维素分解菌分别于LB培养基与高氏一号培养基平板上划线纯化,28℃培养箱内培养,48 h后观察。5株高效纤维素分解菌在同一种培养基上外观形态差异不大,但在不同培养基之间却有较大差别(图3)。2种培养基上生长的菌落在大小、颜色、形成单菌落的划线区、生长速度不相同。LB培养基上的菌落颜色为柠檬黄,菌落略大(0.2~0.4 cm),约2天于划线C区长出单菌落,易挑起;而高氏一号培养基的菌落颜色较浅,偏白,菌落小(0.1~0.2 cm),约4天于划线B区长出单菌落,C区菌落数较少,不易挑起。2种培养基上的菌落都为圆形、湿润、光滑、隆起、有光泽、不透明,有可见基质菌丝。5株菌株都为革兰氏阳性菌,在油镜下观察菌体细短而密集。

图3 维素分解菌菌株形态及其革兰氏染色
2.6.2 分子生物学鉴定 对5株纤维素分解菌16S rDNA的PCR扩增产物在1%琼脂糖凝胶电泳上验证,得到1500 bp左右的条带,送至北京擎科生物科技有限公司重庆分公司进行基因序列的测定,FCM-1、FCM-10、FCM-11、FCY-2和FCW-2菌株的序列长度分别为1359、1355、1373、1373、1337、1364 bp。将测得的序列在NCBI中比对,发现其与Cellulosimicrobium cellulans与Cellulosimicrobiumfunkei16S rDNA序列一致性高达100%。将测序序列信息提交Genbank,下载该属其他序列及所隶属科相近序列,利用MEGA X基于邻接法构建菌株的系统发育进化树(图4)。结果显示此5株菌隶属于Cellulosimicrobium属,与Cellulosimicrobiumcellulans与Cellulosimicrobium funkei及Cellulosimicrobiumaquatile,结合菌株形态学和革兰氏染色结果,可初步判定该菌隶属纤维菌属(Cellulosimicrobium)。
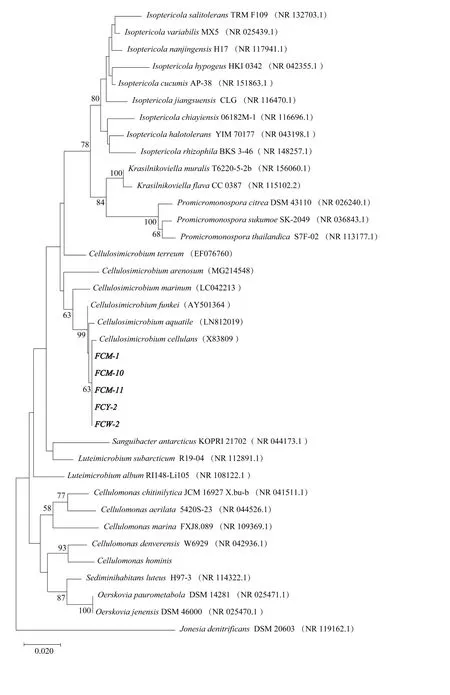
图4 基于16S rDNA序列同源性纤维素分解菌菌株的系统发育树
2.7 菌株对玉米秸秆的降解率测定
通过5株菌株及其复合菌剂的纤维素酶活测定,FCM-10+FCY-2菌剂在时间(5天)与酶活(314.39 U/mL)综合优于其他处理,所以将FCM-10+FCY-2作为优势菌剂进行玉米秸秆降解实验,将其单菌剂与未添施菌剂处理设置为对照。培养25天后,菌剂处理秸秆相较未添施菌剂处理秸秆来看,颜色变黑、腐烂,秸秆微微塌陷,三角瓶底部也出现了少量液体,其中复合菌剂处理出现乳白色液体(图5)。通过对秸秆降解率测定可以看出(图6),菌剂处理降解率高于未添施菌剂处理,经过25天降解,复合菌剂降解率达53.35%,是对照的1.87倍,是单菌剂处理的1倍多,FCM-10处理略高于FCY-2处理。表明FCM-10+FCY-2复合菌剂对玉米秸秆的降解作用强于单菌剂及未添施菌剂处理,具有实际应用价值。

图5 25天玉米秸秆的降解外观形态变化
图6 25天各菌剂玉米秸秆的降解率
3 讨论
研究从贵州典型植烟土壤中筛选获得5株具有高效降解纤维素的微生物菌剂,通过形态学及系统发育分析,初步鉴定为Cellulosimicrobiumcellulans与Cellulosimicrobiumfunkei,目前cellulosimicrobiumsp.对于秸秆生物质资源降解的研究较少,该菌株具有较高的纤维素酶活,菌株间复合其纤维素酶活高于单菌株,并对秸秆表现出较强的降解率,是有效降解农业生产副产品的微生物资源。cellulosimicrobiumsp.作为纤维素与半纤维素分解的微生物,目前仅包括7个有效发表的种(www.bacterio.net/chryseobacterium.html),各菌株可产生多种降解酶,如葡萄糖苷酶、蛋白酶、糖苷水解酶和几丁质酶,广泛应用于纤维素和木聚糖的生物降解和酒精发酵[17]。Cellulosimicrobiumcellulans通过凝脂多糖(EPS)中的木聚糖体粘附于纤维素表面,从而有效降解纤维素底物[18]。该菌株于多种生境中分离出,可降解苯并(a)芘(BaP)[19]、高集凝乳凝胶[20]、海洋污染物烃等碳氢化合物[21]等,且具有较高的木糖酶活促进了7-木糖紫杉烷向紫杉醇的转化[22]。Cellulosimicrobiumfunkei从人类学液中分离得到[23],研究表明该菌株具有较高的Cr(Ⅵ)还原能力,可降低其毒性,进行土壤修复[24]、可降解黄曲霉毒素B1[25],以保护作物生长。Cellulosimicrobiumcellulans和Cellulosimicrobiumfunkei是对于环境友好、资源有效利用的优质微生物资源。
5株来源地不同的纤维素分解菌菌株经鉴定具有较高的同源性,但相同培养条件下菌株间酶活存在差异,说明即使同属相同的种,研究所筛选得到的菌株间仍存在差异,这与刘霄[17]、王元明等[26]的研究结果相似,进一步区别还需验证。根据前人研究成果,Cellulosimicrobiumcellulans与Cellulosimicrobium funkei是非常重要的微生物资源,将Cellulosimicrobiumcellulans与Cellulosimicrobium funkei制成菌剂添施于秸秆资源还田对于资源充分利用与修复损坏土壤具有重要意义。
贵州因其特殊的地形地貌使得植烟土地破碎而不连贯,限制了秸秆还田技术与规模的发展,作为烤烟主要轮作作物秸秆——玉米秸秆,将其有效还田对于克服烤烟连作或单一轮作障碍具有较强的现实意义。就地筛选得到的菌株添施秸秆原位还田具有生态适应性的特点,实际生产应用还需进一步的验证。
4 结论
本研究以贵州典型烟区植烟土壤为高效筛选纤维素分解菌材料,以玉米秸秆粉为唯一碳源,通过初筛、复筛获得高效纤维素分解菌5株。其中透明圈直径(D)与菌落直径(d)比值的大小在2.8~4.2之间,其中以一株湄潭菌株D/d最大,为4.2。通过CMCase活力测定结果显示,菌株间的复合酶活优于单菌株,在5天时FCM-10+FCY-2 CMCase活性达314.39 U/mL,是其单菌株的1.2倍和1.53倍,表明5株菌虽都属于Cellulosimicrobium cellulans与Cellulosimicrobium funkei,且具有较高的同源性(100%)但菌株间仍存在差异,可能是由于生产适宜环境(温度等)不同或不能发酵核糖和糖原等原因[27]。选择最佳复合菌剂处理FCM-10+FCY-2制成菌剂降解玉米秸秆,25天时秸秆外观出现变化,与对照相比其颜色变黑、秸秆腐烂,微微塌陷,秸秆降解率达53.35%,是对照的1.87倍,是单菌剂处理的1倍多。结果表明,5株纤维素分解菌具有较好的玉米秸秆降解能力,是适宜于贵州烟区秸秆还田的潜力菌株。由于5株菌株的高度相似于Cellulosimicrobium cellulans和Cellulosimicrobium funkei都达100%,系统发育树无法精准区别,还需进一步进行鉴定工作;菌株的降解特性、降解机理等多方面内容也还需作进一步的深入研究。

