肝癌患者外周血环状RNAs诊断价值分析*
郭长春,朱 鹏,李凤艳,曾启昂△
广东省深圳市坪山区人民医院:1.麻醉科;2.中心实验室,广东深圳 518118
环状RNAs(circRNAs)是一种内源性非编码RNA,不含蛋白质编码基因,在体内同时调节多个基因,具有结构稳定性、高序列保守性、丰度和特异性表达等特点[1]。有研究发现,circRNAs与癌症、系统性红斑狼疮和炎性感染等疾病有关[2]。circRNAs能够抑制miRNA的表达,从而起到miRNA海绵的作用,以此来减弱miRNA调控mRNA的功能[3]。ZHAO等[4]研究发现,circFADS2通过调节miR-498的表达促进肺癌的发展,而circFADS2的高表达与非小细胞肺癌(NSCLC)的TNM分期、淋巴结转移、分化差、总生存期短有关。最近有报道显示,circRNAs还调节或降解RNA结合蛋白,并影响RNA表达的翻译[5],如ZHANG等[6]发现,ankyrin重复结构域52在细胞核中丰富源于基因内含子,能积极调节RNA聚合酶Ⅱ。因此,circRNAs参与了生物的发生、发展和疾病过程,有望成为一类新的临床生物标志物。原发性肝癌(PLC)是最常见的五大癌症之一,全球每年大约有841 000例新发病例和782 000例死亡病例,其中大约一半发生在中国[7-8]。PLC的发展和形成机制非常复杂,早期临床症状不明显,大多数患者就诊时已为中晚期,失去了最佳治疗时机。有研究显示,circRNAs可作为肝癌早期诊断和预后评估的新型生物标志物[9-10],PLC患者外周血中circRNAs的分布如何改变,以及它们是否可用于PLC的诊断或预后评估尚不清楚。因此,本研究通过微阵列芯片技术鉴定PLC患者外周血中circRNAs表达谱的差异,结合生物信息学分析,发现其可作为PLC诊断或预后评估的潜在生物标志物。
1 资料与方法
1.1一般资料 选取深圳市某三甲医院4例PLC患者(PLC组)和4例健康对照者(对照组)外周血。本研究经本院伦理委员会审查批准,所有受试者均知情同意并签署知情同意书。
1.2仪器与试剂 总RNA提取试剂TRIzol和用于去除线性RNA的Rnase R,以及circRNAs芯片的选择、探针设计及数据分析等均由上海康成生物公司提供。
1.3方法 总RNA提取:分别将PLC组和对照组4例受试者外周血标本混合(每份标本0.5 mL),应用抽提试剂TRIzol按照试剂说明分别从两组标本中提取总RNA。使用NanoDrop ND-1000进行RNA纯度和浓度测定,同时应用标准变性凝胶电泳对RNA完整性和纯度进行评估;RNA标记:使用Rnase R试剂处理RNA,富集circRNAs,然后采用Arraystar Super RNA Labeling转录和扩增circRNAs成荧光标记的circRNAs;芯片杂交:将上述所得circRNAs纯化后在circRNAs芯片上杂交,并在Agilent杂交炉上以65 ℃孵育17 h;芯片扫描:杂交后的芯片进行洗片,最后用Agilent ScannerG2505C进行扫描。
1.4统计学处理 将芯片扫描得到的微阵列图片导入Agilent Feature Extraction软件提取原始数据,应用R软件包对原始数据进行归一化处理,两组标本间差异表达的circRNAs通过差异表达(fold change)值进行筛选。
2 结 果
2.1差异表达的circRNAs 相对于对照组,PLC组共有26种circRNAs具有fold change,其绝对值≥4.0,其中14种表达上调,12种表达下调,见表1。
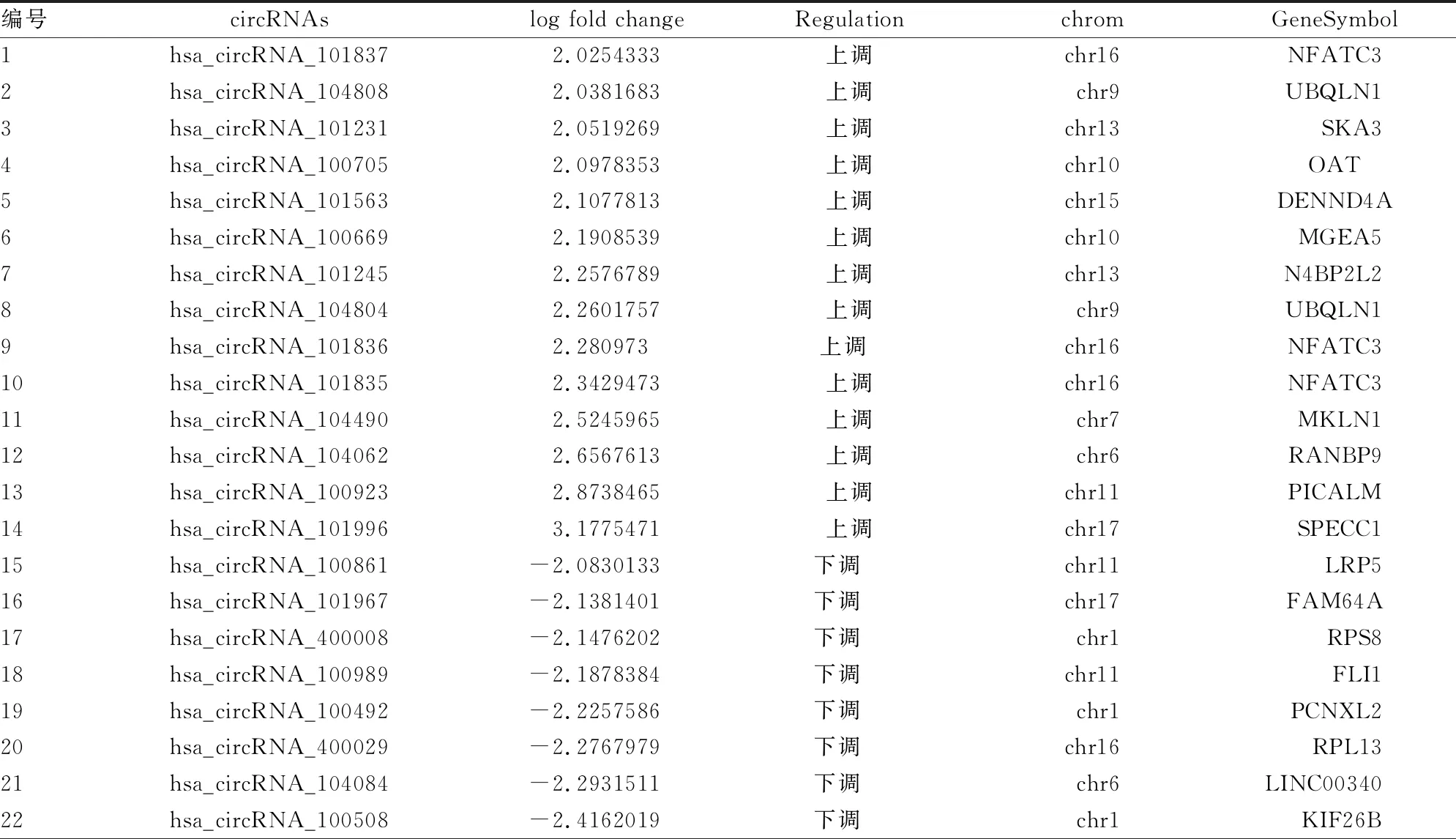
表1 表达差异log值≥2.0的circRNAs
2.2生物信息学分析
2.2.1circRNAs的基因本体(GO)分析 PLC组fold change的26种circRNAs中上调的14种circRNAs的亲本基因包括:NFATC3、UBQLN1、SKA3、OAT、DENND4A、MGEA5、N4BP2L2、MKLN1、RANBP9、PICALM、SPECC1;下调的12种circRNAs的亲本基因包括:LRP5、FAM64A、RPS8、FLI1、PCNXL2、RPL13、LINC00340、KIF26B、WBSCR17、NUP214、GPI、GRB10。将分析得到的明显fold change的circRNAs的亲本基因从细胞组件、分子功能和生物学进程3个方面进行GO功能注释。选择富集程度较明显的前10位,较为明显的生物过程为有丝分裂纺锤体组织、核仁输出核糖体小亚单位及细胞质分裂的调节,较为明显的细胞功能为核质,较为明显的分子功能为组蛋白丝氨酸激酶活性和转录因子活性。见图1。
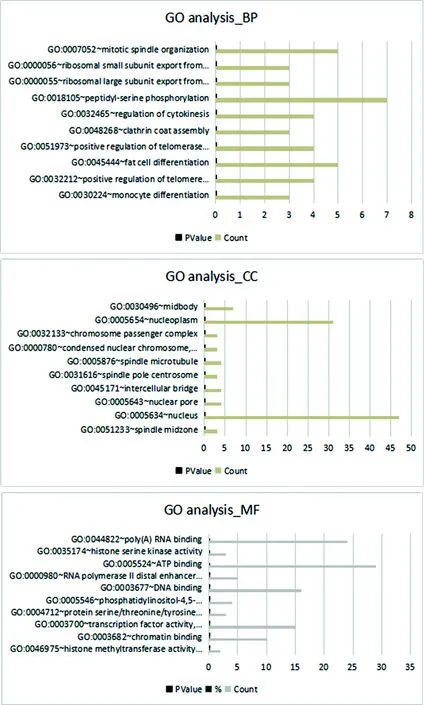
图1 fold change的circRNAs GO富集分析
2.2.2基因功能(KEGG)pathway分析 进一步对有明显差异的circRNAs的亲本基因与KEGG数据库进行pathway注释,得到差异基因参与的富集pathway term,较为明显的离子通路为RNA转运及内质网中蛋白质的加工,特别是在大肠癌和胰腺癌中,见图2。

续表1 表达差异log值≥2.0的circRNA
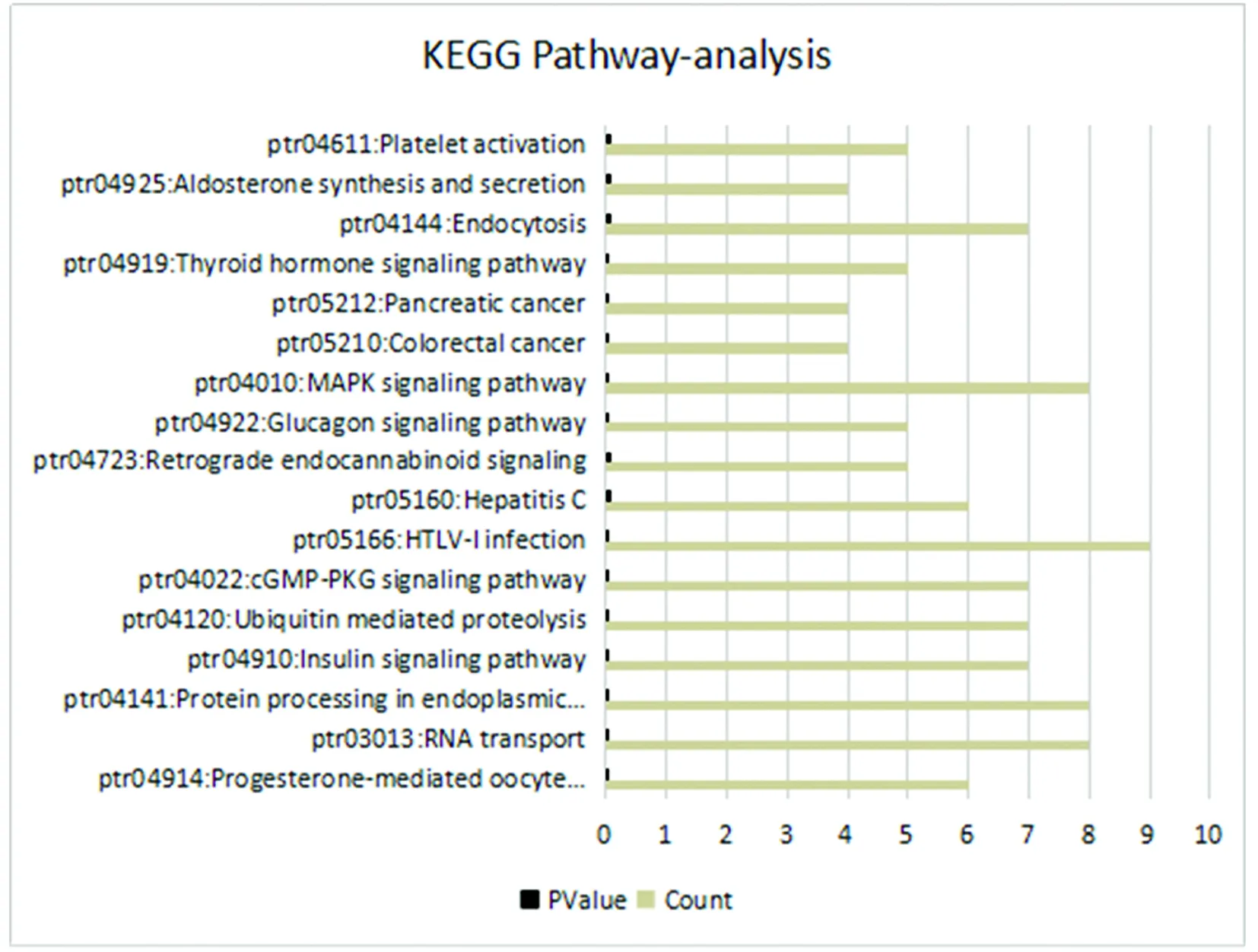
图2 fold change的circRNAs KEGG pathway 分析
3 讨 论
PLC的恶性程度高,目前血液检测项目血清甲胎蛋白的灵敏度不高,仍有早期肝癌漏诊病例,迫切需要新的生物学诊断标志物,以提高PLC的诊断效率。有研究显示,相对于蛋白类标志物,circRNAs在肿瘤的发展中较先出现,并且能够在血清中稳定表达,具有很好的临床应用前景[11]。近年来,由于生物信息学的快速发展,众多circRNAs及其功能逐渐被发现,如circRNAs调节其亲本基因的表达、circRNAs翻译蛋白等[12]。
目前,对PLC发生机制的了解尚不足,以往的研究大多局限在单个基因对肿瘤的影响,事实上在肝癌的发展过程中会不断出现多个基因突变和表观遗传学改变,并且基因之间存在相互作用,并通过调控网络发挥作用[13]。陈林波等[14]用R语言从肝癌芯片表达谱中筛选出fold change基因,对其进行功能注释及通路分析,并构建蛋白质相互作用网络,筛选出TOP2A、CENPF、ASPM等10个关键基因,显示与肿瘤细胞碳代谢等通路有关,证明生物信息学能有效筛选和分析肝癌相关fold change基因。2017年白文萱等[15]应用JMP等软件对另一组肝癌芯片数据进行分析发现,除磷脂酰肌醇蛋白聚糖3(GPC3)在肝癌中表达上调外,MBL2、sDs、sLCOlB3、 TD02、sAA4、sPP2在肝癌中均表达下调。表明GPC3有望成为肝癌特异性的免疫治疗靶点。因此,从多基因水平及它们的相互作用网络分析肿瘤基因表达谱,有助于更好地探索发病机制,基因芯片作为新一代高通量检测技术,可以同时检测上万个基因的表达水平,是一种研究基因组和基因间相互作用的强有力的工具。
本研究将PLC患者与对照者进行比较,发现两组人群中出现了fold change的circRNAs,同时用生物信息学技术对亲本基因进行富集分析,结果显示,fold change的circRNAs的GO term富集主要涉及转录因子活性、序列特异性DNA结合、RNA转运RT等功能,通过内质网蛋白质加工、泛素介导的蛋白质水解、cGMP-PKG信号通路等参与肝癌的疾病进展,其中fold change较为明显的为NFATC3、FLI1、UBQLN1、SPECC1等亲本基因。由此可见,PLC的发生和发展与基因的调控有一定关联,可能存在新的路径或通路。同时也从一定程度上验证了与全基因组测序相同的结论,PLC的发病与基因调控存在一定的关联性。迄今为止已发现多种基因与PLC相关,本研究也发现,相对于对照组,PLC组Fli1呈明显fold change。F1i1属于Ets家族中的一个转录因子,参与多种基因的转录调控,近年来越来越多的研究发现,F1i1表达失衡可参与多种肿瘤的发生和发展[16-17]。Fli1可能在肿瘤的发展过程中发挥癌基因的作用,这是因为高表达的Fli1可激活Rho GTPase信号通路,最终导致肿瘤细胞的侵袭和迁移。王慧玲[18]应用Western blot和实时荧光定量聚合酶链反应检测肝癌组织和肝癌细胞株中Fli1的表达,分析其与肝癌患者临床病理的相关性,结果发现,Fli1过表达组的肝癌细胞克隆、迁移和侵袭能力均明显增强,Fli1敲减组情况相反,大部分细胞内调控信号随着肝癌的侵袭转移也发生了改变,如PI3K-AKT、Integrin及Wnt等信号通路。信号的改变说明它们在肝癌的侵袭转移过程中发挥了作用,并且Fli1在肝癌中发挥了癌基因的功能。SPECC1L蛋白是一种细胞骨架蛋白,具有3个螺旋卷曲结构域和一个钙调蛋白结构域,能够同时与细胞微管蛋白及肌动微丝蛋白相互作用,具有稳定细胞微管蛋白、参与纺锤体形成的功能,对细胞黏附发挥重要调控作用,并参与Integrin信号、PI3K-AKT及Wnt信号通路的调节。2018年中南大学湘雅医院发明了专利 CN201810051721.3,明确了SPECC1L在治疗肝癌或术后预防肝癌复发药物中的应用。
综上所述,从多基因水平及它们的相互作用网络分析肿瘤基因表达谱有助于更好地探索PLC的发病机制,从而发现新的治疗靶点。目前缺乏对肝癌早期诊断和预后评估的新型生物标志物,因此,还需要进一步对PLC基因进行新位点鉴定,对新发现的相关基因及相关蛋白进行深入研究。本研究以微阵列芯片表达谱为基础,通过生物信息学技术分析PLC患者外周血中fold change的circRNAs及它们的亲本基因,发现了明显改变的基因,但具体发病机制及亲本基因参与的通路还需深入研究。