NARS2在卵巢癌组织中的表达水平及生物学意义
杨 帆,王宇波,张小琦,赵梅平,朱 梅
陕西省汉中市中心医院产科,陕西汉中 723000
卵巢癌是女性生殖系统常见的恶性肿瘤,由于其缺乏可靠的早期筛查诊断方法,确诊时多为晚期[1]。因此,卵巢癌在妇科肿瘤中病死率最高,晚期患者术后5年生存率低于30%。现阶段治疗卵巢癌以外科手术切除病灶为主,辅以紫杉醇类药物及铂类药物化疗、放疗、靶向药物等治疗[2]。然而,即使化疗药物初期效果明显,但大部分患者仍会出现耐药、复发等情况[3]。由于线粒体可独立合成电子传递链复合体中的13种蛋白,进而与细胞核编码的蛋白共同完成线粒体相关的多种生命活动,因此,线粒体又是细胞内唯一一种半自主细胞器[4]。与真核细胞质中翻译体系类似,线粒体基因的翻译系统也包括信使RNA(mRNA)、转运核糖核酸(tRNA)、核糖体及翻译所需的起始因子等[5]。氨酰-tRNA合成酶是生命进化过程中最早出现的一类蛋白质,主要负责将氨基酸结合到其对应的tRNA上,进而完成蛋白质的合成[6]。放疗可增加线粒体翻译,进而增强线粒体的呼吸能力和线粒体三磷酸腺苷(ATP)的产生,从而更有效地修复辐射诱导的DNA损伤[7]。因此,抑制线粒体翻译系统可能是一种有效抑制肿瘤恶性进展的新手段[8]。本研究以天冬酰胺基-线粒体转运核糖核酸合成酶2(NARS2)为代表,研究其在卵巢癌组织中的表达及生物学意义,进而为开发卵巢癌的新型预后生物标志物及潜在的治疗靶点提供理论线索。
1 资料与方法
1.1一般资料 选取本院2008-2017年卵巢癌患者组织标本244例,皆为术中取得后立即置于液氮保存。标本纳入标准:(1)初治患者均行手术治疗;(2)组织病理学检查为卵巢癌;(3)病理切片通过2位独立的病理医师重新评估。此外,本研究还选取了本科室实验室保存的正常卵巢上皮组织标本9例。所有研究对象均知情同意并签署知情同意书。
1.2方法
1.2.1免疫组织化学 采用EnVisionTM(K5007,DAKO)免疫组织化学试剂盒开展试验,具体步骤如下:将上述卵巢癌及正常卵巢组织切片,60 ℃拷片后经脱蜡水化,再行柠檬酸-磷酸二氢钠缓冲液抗原修复,利用3% H2O2失活内源过氧化氢酶,随后加正常山羊血清于28 ℃进行封闭,加入稀释好的兔源NARS2多克隆抗体(ab254714,Abcam)于湿盒中4 ℃过夜。PBS清洗后加二抗在37 ℃条件下放置20 min,滴加DBA工作液显色,之后放入苏木精染液中复染5 min,再次清洗、分化,乙醇脱水。显微镜(CX41,奥林巴斯)下对切片进行观察拍照。免疫组织化学结果量化标准:(1)阳性率,1分为阳性细胞占细胞总数的25%以下,2分为25%~50%,3分为>50%~75%,4分为75%以上;(2)显色强度评分,0 分为无着色,1 分为浅黄色,2 分为棕黄色,3 分为棕褐色。最终总评分为(1)、(2)的乘积。
1.2.2细胞培养 人卵巢癌细胞系SKOV-3购于美国ATCC细胞库并由本实验室常规液氮保存。培养时采用加入10%胎牛血清(四季青生物)的RPMI-1640培养液(上海生工生物),培养箱内CO2浓度为5%,温度为37 ℃。
1.2.3质粒转染 采用汇合率为70%的处于对数期的SKOV-3人卵巢癌细胞进行转染。弃去培养皿中的培养液后每皿加入 1.5 mL RPMI-1640培养液及0.5 mL pcDNATM3.1-NARS2质粒(本实验室保存)与lipofectamine 2000混合的转染复合物液。轻轻混匀,孵育箱中培养 6 h后更换培养基。用G418筛选稳定细胞株。
1.2.4蛋白质免疫印迹法(Western blot) 采用RIPA蛋白裂解液裂解SKOV-3细胞并提取细胞总蛋白,加入上样缓冲液后煮沸5 min。而后行聚丙烯酰胺凝胶电泳、湿转法将蛋白转印至PVDF膜上,用5%脱脂奶粉封闭1 h后,依次加入用5%脱脂奶粉稀释过的NARS2(ab254714,Abcam)、Cleaved-Caspase3(ab2302,Abcam)、Cleaved-Caspase9(ab2324,Abcam)及β-actin抗体于4 ℃孵育过夜,用TPBS洗膜3次后加入二抗并在室温下继续1 h,用TPBS洗膜3次后采用化学发光法对条带进行发光显色。
1.2.5线粒体氧耗速率测定 参照使用说明书,在Seahorse细胞能量代谢分析仪(Seahorse Bioscience XF-24)测定氧耗速率。线粒体ATP合酶抑制剂:寡霉素[Oligomycin(495455)];氧化磷酸化解耦联剂:三氟甲氧基苯腙羰基氰化物[FCCP(C2920)];传递链复合物Ⅰ抑制剂:鱼藤酮[Rotenone(R8875)];电子传递阻断剂:抗霉素[A(D8815)]购于默克公司并保存于本实验室。
1.2.6线粒体复合体活性测定 参照使用说明书,使用Complex Ⅰ(ab109721,Abcam)、Complex Ⅲ(ab109908,Abcam)、Complex Ⅳ(ab109911,Abcam)活性检测试剂盒检测各复合体活性。
1.2.7细胞凋亡测定 消化计数1×105个细胞,1 000 r/min离心5 min,弃去上清液,加入100 μL PBS重悬,加入Annexin-V 染液,室温下避光孵育20 min,PBS清洗后,碘化丙啶(PI)染色10 min,PBS清洗后,400 μL PBS重悬,利用流式细胞仪检测细胞凋亡比例。

2 结 果
2.1NARS2在卵巢癌组织中的表达 首先采用免疫组织化学法检测卵巢癌及正常卵巢组织中NARS2的表达变化,见图1A、1B。正常卵巢组织(n=9)中NARS2的免疫组织化学评分最高为8分,最低为0分,平均(4.40±0.80)分。而在卵巢癌组织(n=244)中NARS2的免疫组织化学评分最高为12分,最低为0分,平均(7.95±0.37)分。卵巢癌组织中NARS2的免疫组织化学评分明显高于正常卵巢组织,差异有统计学意义(t=3.08,P=0.002 8)。
2.2NARS2表达水平与卵巢癌患者预后的关系 将244例卵巢癌组织按NARS2免疫组织化学评分分为高表达组和低表达组,并进行Kapla-Meier生存分析,见图2。高表达组预后明显差于低表达组,差异有统计学意义(P=0.003)。肿瘤组织中高表达NARS2是较差预后因素,高表达与患者生存期缩短明显相关。
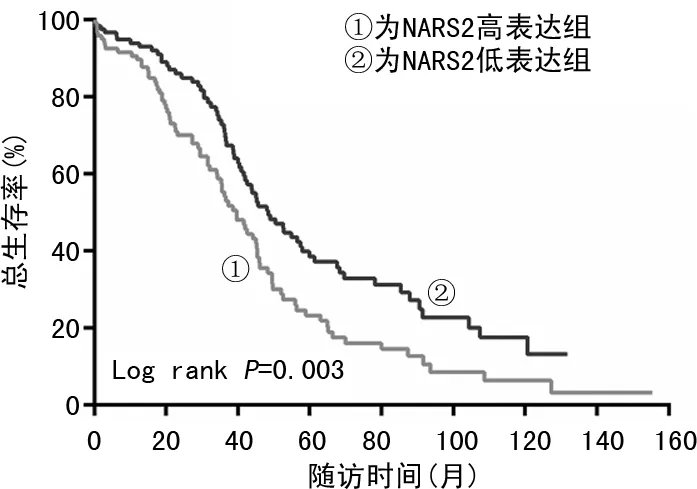
图2 NARS2表达水平与卵巢癌患者预后
2.3NARS2高表达明显促进卵巢癌细胞氧化呼吸功能 NARS2高表达可明显提高卵巢癌细胞线粒体基础呼吸速率、添加寡霉素质子泵抑制剂阻断ATP合酶后的质子泄漏耗氧速率及FCCP处理后线粒体最大氧耗速率(图3A)。进一步分析发现,NARS2的高表达可明显促进线粒体复合体Ⅰ及复合体Ⅳ的活性(图3B)。
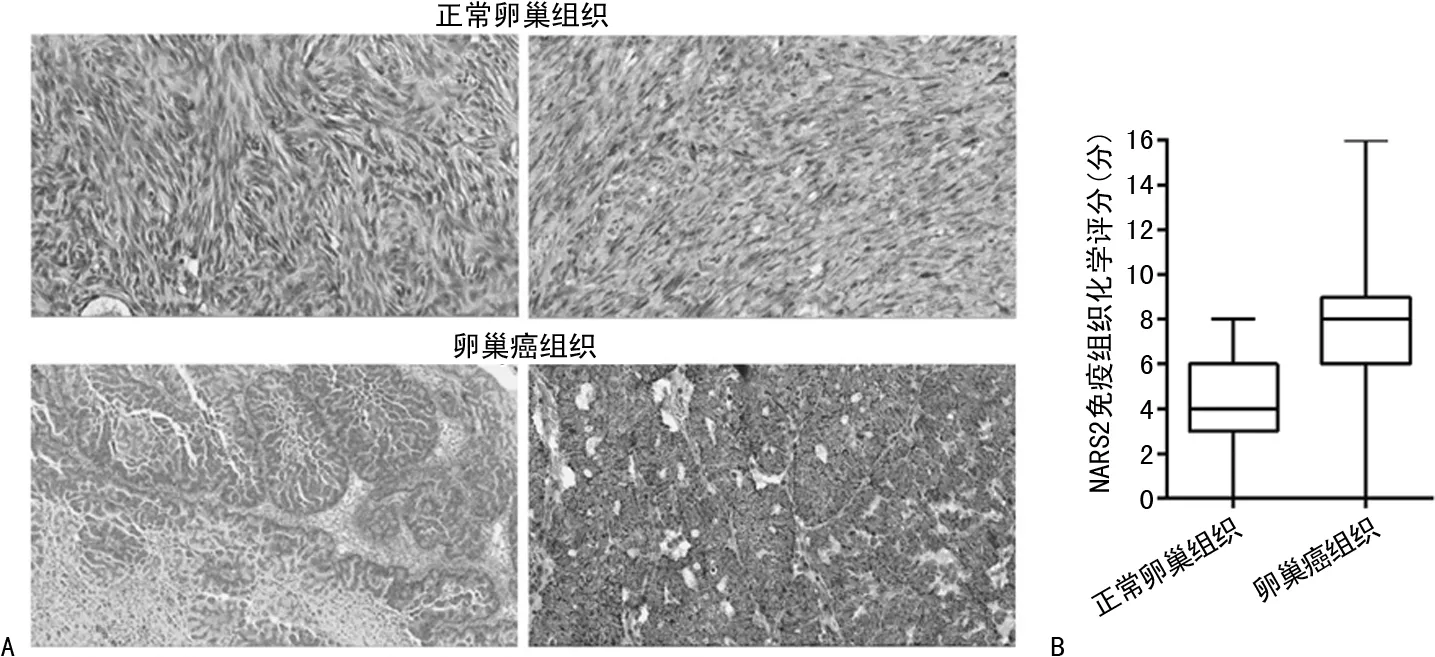
注:A为H&E染色及免疫组织化学染色结果;B为免疫组织化学评分。图1 卵巢癌和正常卵巢组织中NARS2的免疫组织化学评分
2.4NARS2高表达明显促进卵巢癌细胞凋亡抵抗能力 细胞凋亡检测结果显示(图4A、4B),经氧化磷酸化的解耦联剂FCCP处理可诱导卵巢癌细胞的凋亡,而NARS2的高表达可明显减少FCCP诱导的细胞凋亡[(29.67±1.44)%vs.(51.07±1.10)%,P=0.000 3]。进一步Western blot结果显示(图4C),NARS2的高表达可明显减少CCCP诱导的Caspase 3和Caspase 9的切割。
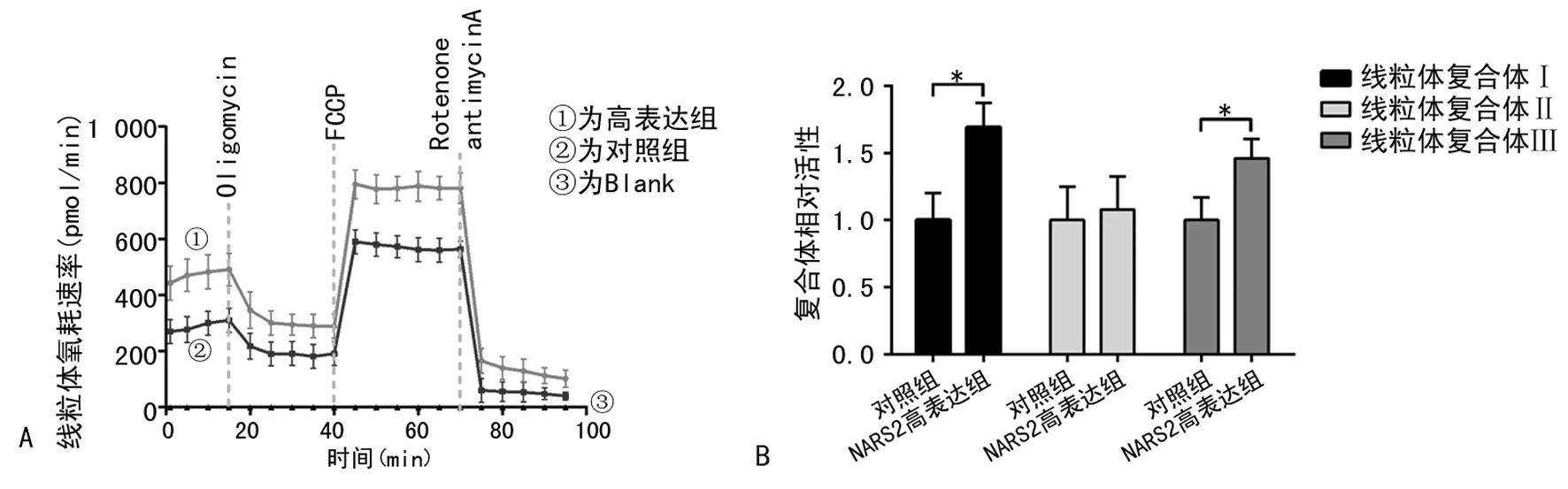
注:A为线粒体氧耗速率检测,Oligomycin为寡霉素质子泵抑制剂,FCCP为氧化磷酸化的解耦联剂,Rotenone为鱼藤酮复合体1抑制剂,antimycinA为抗霉素A复合体3抑制剂;B为线粒体复合体活性检测;与对照组比较,*P<0.05。图3 NARS2高表达对线粒体功能的影响
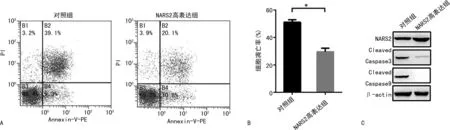
注:A为流式细胞术检测结果;B为细胞凋亡检测结果;C为Western blot 检测结果;与对照组比较,*P<0.05。图4 NARS2高表达对卵巢癌细胞凋亡的影响
3 讨 论
线粒体是细胞内能量产生的重要细胞器,并在信号转导、稳态维持和细胞凋亡等方面发挥关键的调控作用[9]。此外,线粒体还拥有独立于细胞核的DNA,负责编码对线粒体正常功能至关重要的呼吸链亚基[10]。大部分肿瘤细胞具有独特的线粒体代谢特征,并依赖线粒体呼吸提供能量。而抑制线粒体翻译功能则可导致线粒体呼吸受损及线粒体功能障碍,并被证实是消除实体瘤及肿瘤干细胞的有效手段[8]。例如,Tigecycline是美国食品药品监督管理局批准的具有有效抗癌活性的抗菌药物。Tigecycline除通过抑制Wnt/β-catenin和诱导自噬外,还可直接与线粒体核糖体结合并抑制线粒体翻译,起杀伤肿瘤细胞的作用[11]。
NARS2基因编码NARS2是核编码的线粒体酰氨基tRNA合成酶之一,对维持线粒体功能至关重要[6]。NARS2基因产物可催化特定氨基酸与其相关的tRNA的结合,是线粒体蛋白质合成的关键步骤。近年来,越来越多的研究发现,NARS2基因突变与癫痫、脑萎缩[12]、阿尔珀斯综合征[13]、婴儿神经退行性疾病[14]的发作密切相关。然而,有关NARS2基因异常与人类肿瘤的关系少见报道。
本研究发现,NARS2免疫组织化学评分在卵巢癌组织中明显高于正常卵巢组织,且肿瘤组织中NARS2高表达的患者预后明显差于低表达者。进一步分析还发现,过表达NARS2可明显促进线粒体的呼吸功能、电子传递链复合体Ⅰ及Ⅳ的活性,并且明显提高卵巢癌细胞的抗凋亡能力。与本研究结果相类似,SIMON等[15]在研究非综合征性耳聋和李氏综合征时发现,在HEK293T细胞中敲除NARS2可导致线粒体氧耗速率和电子传递链复合体Ⅰ、Ⅲ、Ⅳ活性明显降低,恢复NARS2表达则可逆转上述表型。
NARS2有望成为一种新型卵巢癌患者预后评估标志物及药物治疗靶点,但其致病机制未阐明。因此可预见,探索NARS2在包括恶性肿瘤在内的各种人类疾病中的异常状态、关键生物学功能及其潜在分子生物学机制,可能是基础及临床医学的下一个研究热点。