多房棘球绦虫葡萄糖转运蛋白1重组抗原肽构建及原核表达方法建立※
华国勇,郭建琴,李 旻,张晓岩,汤 锋,李润乐
(1.青海省人民医院,青海 西宁 810007;2.青海大学医学院,青海 西宁 810001)
多房棘球绦虫与其他寄生虫一样通过宿主获取生命活动所必须的营养物质,其代谢脂类和氨基酸的能力有限,因此需要从外界摄入糖类作为主要的能量来源。多房棘球绦虫本身无消化道,通过体表吸收宿主环境中的葡萄糖并以糖原形式储存,以此维持自身能量代谢进行生命活动。葡萄糖作为一种极性分子它不能以自由扩散的方式通过细胞膜脂质双层结构的疏水区,多数情况下需要葡萄糖转运蛋白(GLUT)的协助[1,2]。GLUT1是目前所发现的分布最广泛的转运体,负责组织与血液间葡萄糖的转运[3]。2018年Jun Matsumoto团队[4]研究发现多房棘球绦虫摄取宿主葡萄糖的过程依赖EmGLUT1,如以葡萄糖转运蛋白为抗原,能切断多房棘球蚴能量来源从而抑制其增殖。本文拟对EmGLUT1结构进行预测,筛选其氨基酸序列中的非跨膜区域进行串联,设计序列插入到原核表达载体中用以表达及纯化,获得纯度较高的重组表位肽,为后续疫苗研究寻找有效工具。
1.材料与方法
1.1 材料
pCzn1载体、Artic express表达菌株(Zoonbio);限制性内切酶Nde I和Xba I(Takara);IPTG和氨苄青霉素钠、质粒提取试剂盒,蛋白胨、酵母粉、DNA纯化回收试剂盒(Tiangen);兔抗His抗体、山羊抗兔IgG抗体(Bioss);Ni-NTA sepharose(Make Research Easy)。
1.2 方法
1.2.1EmGLUT1跨膜结构预测
使用生物信息学软件TMHM(http://www.cbs.dtu.dk/services/TMHMM/)和TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)对EmGLUT1蛋白进行跨膜结构在线预测。
1.2.2 表位肽的筛选及串联设计
根据EmGLUT1蛋白跨膜结构预测结果,删除位于跨膜结构区域的肽段,保留的表位肽段之间添加GS和KK氨基酸序列,以利于多肽链的空间构象和保持抗原的特异性,防止表位肽之间互相干扰。将设计的EmGLUT1表位肽命名为GLEP。
1.2.3 pCzn1-GLEP质粒构建
参照前期实验方法[5,6],对GLEP序列进行大肠杆菌密码子偏爱性优化,并添加限制性内切酶NdeI和XbaI酶切位点,序列如下(划线区域为酶切位点):
CATATGACCCATCTGCTGAATACCACCACACTGGGCAGTAATAGCAGCGAAATGCTGAAAGGTGCAAATGTTTCCAGTGATGGCAGCAACAGCGATGGTGTGGTTAATAAAATGCCATTTGTTCTGGTTAAAAAGCCGTCTCTGAATGGTCTGCTGAAAGGTGGTAGTATGCCTGAAACGAAAAACCGTACCTTTGATGAAGTGGCACGCGATCTGGCGTTTGGCAGCATTGTTGTTGGTAAACGTACAGCGGCACTGCAGAGCCCGGTTTTTACAAAAGAAGATGAAGAAGCGGCAACCGCACTGCGTCGTACCGATGATGATAGCAAAGTTGATGCGTAATCTAGA
上述序列送生工生物工程上海股份有限公司进行合成,经酶切、连接入pCzn1载体并转化入大肠杆菌TOP10后,挑选阳性菌落并提取质粒,采用测序及酶切法判断质粒pCzn1-GLEP构建是否成功。
1.2.4 pCzn1-GLEP重组表达菌构建及表达部位鉴定

1.2.5 GLEP可溶蛋白纯化
将诱导表达后的菌液离心(4℃,10000r/min,5min),收集菌体用缓冲液洗涤3次,加入蛋白纯化上样缓冲液进行超声破碎(功率:70%;破碎3s暂停4s),离心(4℃,10000r/min,10min)后收集上清用Ni-NTA-Sepharose亲和层析法纯化GLEP蛋白,获得电泳纯级的GLEP蛋白。使用His标签抗体对重组蛋白进行免疫印迹检测。
2.结果
2.1 GLUT1蛋白跨膜结构预测
生物信息学软件分析结果如图1所示,EmGLUT1为12次跨膜蛋白,跨膜区域为8-30、59-81、94-116、121-143、121-143、148-170、148-170、264-286、301-323、332-354、369-391、404-423、433-452;细胞内区域为1-7、82-93、144-147、203-263、324-331、392-403、453-509;细胞外区域为31-58、117-120、171-179、287-300、355-368、424-432,根据分析结果删除跨膜区域及12次跨膜细胞内区域及氨基酸残基小于5的序列区域,选定171-179、287-300、355-368和424-432跨膜胞外区及453-509胞内区共5个肽段为研究对象。
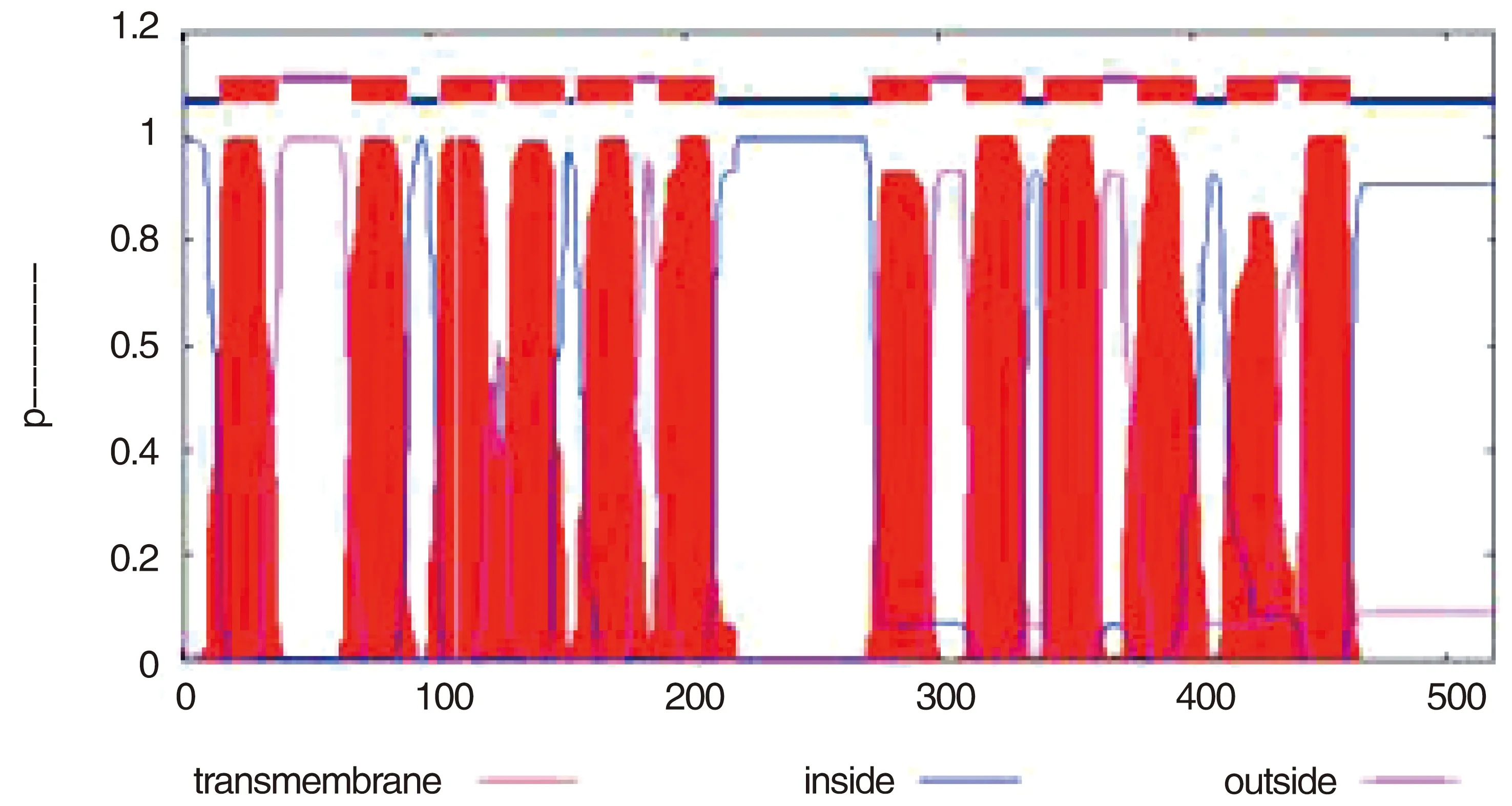
图1 GLUT1蛋白跨膜结构预测图
2.2 重组质粒pCzn1-GLEP酶切及测序验证
重组质粒pCzn1-GLEP的双酶切验证显示,大小约350 bp,与实际大小符合,且阳性克隆序列测序结果与预期序列吻合度达100%(经BLAST比对),如图2~3所示。
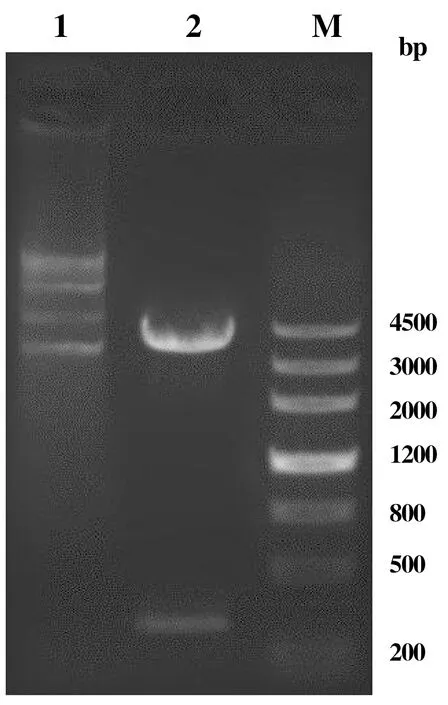
M:DNA标志物;1:pCzn1-GLEP阳性克隆质粒;2:pCzn1-GLEP经Nde I和Xba I双酶切后的质粒
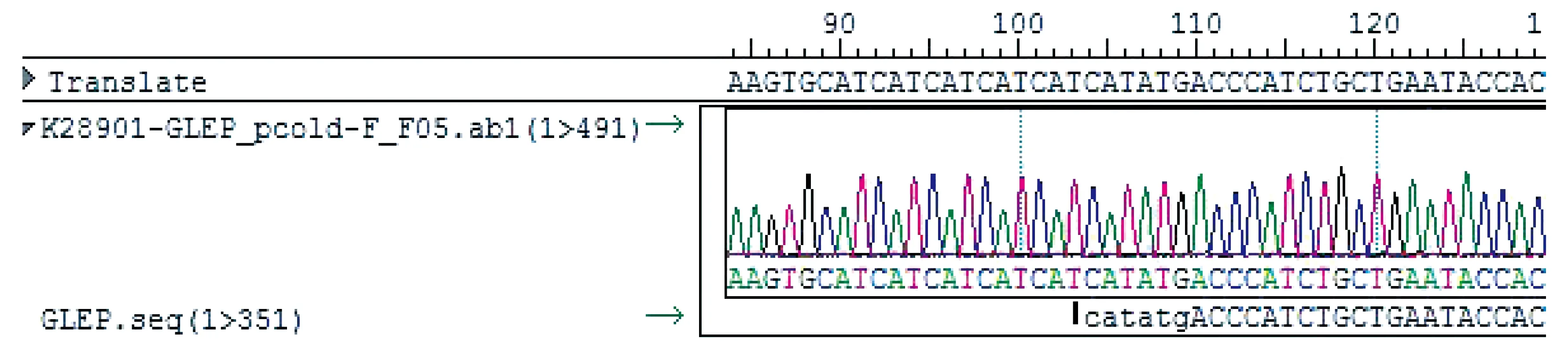
图3 阳性克隆序列比对结果图
2.3 重组蛋白GLEP表达部位鉴定
将重组表达菌株经诱导(0.4nM IPTG,26℃),菌体用蛋白纯化上样缓冲液超声破碎后,分别取菌体诱导前、诱导后、破碎后上清(可溶蛋白)及破碎后沉淀(包涵体蛋白),用12%SDS-PAGE鉴定表达部位,结果如图4所示,经IPTG诱导后,菌体出现与目的蛋白相一致的条带(约13.3kDa,泳道2),超声破碎上清与沉淀物均在13.3kDa处出现明显条带,表明GLEP蛋白以可溶性蛋白和包涵体蛋白两种形式表达。从后续大规模生产及蛋白空间结构的稳定性考虑,选择可溶性蛋白进行纯化。

M:蛋白质分子质量标值;1:未经0.4nM IPTG诱导;2:经0.4nM IPTG诱导;3:诱导破碎后上清;4:诱导破碎后沉淀
2.4 重组蛋白GLEP纯化
根据上述实验结果,GLEP以可溶性蛋白的形式表达,因此将菌体破碎后上清经Ni-NTA-Sepharose纯化,收集洗脱液,采用12%SDS-PAGE考查纯化蛋白的纯度。结果如图5所示,纯化后蛋白在13.3kDa左右处有明显单一条带,且未发现杂蛋白。

M:蛋白质分子质量标值;1:菌体经破碎后的样品;2:样品上样后的流出样;3~4:经250nM咪唑洗脱后的样品
为检测纯化后GLEP蛋白的纯度及其特异性,采用His抗体对GLEP蛋白进行免疫印迹检测,结果如图6所示,纯化后的GLEP能特异性的与His抗体结合,未见其他条带,表明经Ni-NTA亲和柱层析获得了目的蛋白GLEP。
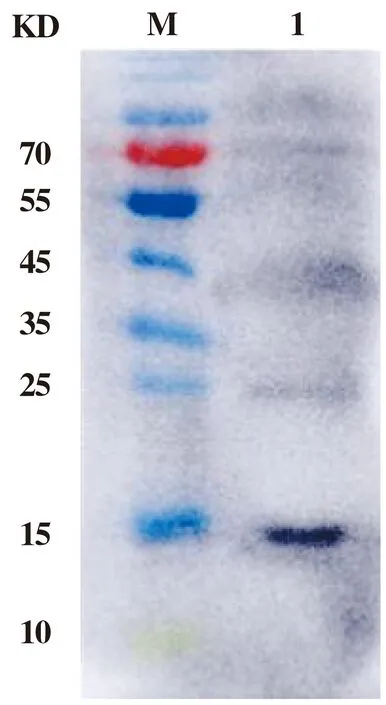
M:蛋白质分子质量标值;1:纯化后的GLEP
3.讨论
近年来,包虫病基础研究一直致力于寻找具有良好抗原性和免疫原性的抗原,因为棘球绦虫具有复杂的生命周期且体外培养困难,阻碍了对免疫现象和相关机制的研究[7,8]。尽管如此,在细粒棘球绦虫中也发现了一些优势抗原具有良好的抗原性,如EG95[9]、EgB[10,11]、Eg mefAg-1[12]等,这些抗原蛋白大多数为膜蛋白和分泌蛋白。与寄生虫营养相关的一些蛋白具有预防性,如日本血吸虫腺苷酸转运蛋白[13]、精氨酸转运RNA酶[14]、谷胱甘肽S-转移酶[15]等。
寄生虫经过漫长的演化适应了宿主环境,像绦虫消化系统完全消失,主要依靠皮层主动运输营养物质并输入实质组织中以糖原形式储存。寄生虫主要的营养物质为葡萄糖,大部分寄生虫从宿主获取葡萄糖均依靠Na+葡萄糖协同转运蛋白实现,目前葡萄糖转运蛋白家族包含14个具有共同结构特征但功能不同的亚型,都含有跨膜12次的结构域、位于细胞质侧的N-和C-末端以及N-糖基化位点。Jun Matsumoto等[4]研究发现多房棘球蚴中可检测到两种葡萄糖转运蛋白(EmGLUT1和EmGLUT2),其中EmGLUT1是一种易化扩散的葡萄糖转运体,不依赖Na+和H+对葡萄糖有高度特异性,而EmGLUT2是与寄生虫发育无关的转运蛋白。因此EmGLUT1可能是多房棘球蚴从宿主环境获取葡萄糖的一个重要转运体,本文表达和纯化EmGLUT1是为后续疫苗研究寻找有力工具。
跨膜蛋白采用原核表达时,其细胞器较简单,无法像真核细胞一样对蛋白质进行修饰、包装并分泌,并且跨膜蛋白中含有大量的疏水性序列会对蛋白质的翻译过程产生抑制作用,较难表达,并且在表达过程中如与原核膜结构融合会形成毒性[16],因此很难在原核表达系统内表达和纯化。目前真核表达系统常用哺乳动物细胞、昆虫细胞和酵母表达系统,虽然它们表达蛋白活性高,对于需要多修饰的蛋白易于表达,但存在成本高、表达量低、筛选时间长等问题,原核表达系统成本低廉、速度快、表达量高等优势有利于后续疫苗的研发及推广,因此仍然选择原核表达系统。
葡萄糖转运体(sGLT)以易化扩散的形式进行葡萄糖转运,其12次跨膜结构是完成其易化扩散的关键结构,因此以该结构作为抗原诱导机体产生抗体或能够达到抑制其功能的目的。通常情况下,一般对于跨膜蛋白的原核表达选择胞外肽段进行原核表达,如EB病毒潜伏膜蛋白1(LMP1)[17]、跨膜蛋白P185[18]、肿瘤坏死因子相关凋亡诱导配体[19]、鸡细胞毒性T细胞相关抗原-4(CTLA-4)[20]等。因此本文通过对EmGLUT1跨膜结构的预测,删除该氨基酸序列中跨膜和部分胞内区域,选定171-179、287-300、355-368、424-432跨膜胞外区及453-509胞内区共5个肽段,使用柔性序列KK和GS将其间隔并加以连接,以保证各表位肽之间的独立性和特异性,避免相邻表位肽连接部位出现新的表位,使各表位独立发挥免疫原性。本文将串联后的GLEP序列插入到pCzn1载体中,该载体能够低温诱导蛋白表达,促进可溶蛋白的产生,因此采用26 ℃诱导目的蛋白表达,GLEP以可溶性蛋白表达,形成的融合蛋白稳定性较好,经Ni-NTA亲和柱层析纯化后获得电泳纯级的GLEP蛋白,并通过His标签抗体对重组蛋白进行免疫印迹验证。在此建立的GLEP表达及纯化方法,为后续疫苗研究提供了有力工具。

