28例重症COVID-19患者临床资料分析※
王 皓,孙 斌&,阿祥仁,李霞媛,王 昀,杨正平
(1.青海省人民医院重症医学科,青海 西宁 810007;2.青海省检验医学重点实验室,青海 西宁 810007;3.青海大学附属医院消化内科,青海 西宁 810000)
本研究收集2020年1月31日至2020年3月17日在武汉市新洲区人民医院重症医学科收治的28例重型和危重型患者的临床资料进行相关分析。现将有关结果报告如下。
1.对象与方法
1.1 研究对象
收集2020年1月31日至2020年3月17日在武汉市新洲区人民医院重症医学科收治的28例重型和危重型患者的病历资料,所有患者均由核酸检测确诊为COVID-19感染[1]。胸部CT示:磨玻璃密度影,出现实变及间质改变[2,3]。纳入标准:入住ICU治疗的所有患者均符合国家卫生健康委员会办公厅发布的《关于印发新型冠状病毒肺炎诊疗方案(试行第七版)的通知》中的重型及危重型诊断标准,重型:成人符合以下任何一条,①气促,RR≥30次/分;②静息状态下氧饱和度≤93%;③动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg,肺部影像学示24~48小时内病灶明显进展,病灶>50%。危重型:成人符合以下任何一条,①呼吸衰竭,且需要机械通气;②休克;③合并其他器官功能衰竭需ICU监护治疗。收集患者入ICU时的APACHE II、CURB-65、SOFA评分,RR、SBP、PLT和降钙素原水平(procalcitonin,PCT)、白蛋白水平(albumin,ALB)、肌酐水平(creatinine,CREA)、肌酸激酶同工酶水平(creatine kinase isoenzyme,CK-MB)、乳酸脱氢酶水平(lactate dehydrogenase,LDH)、氯离子浓度(chloride ions,Cl-),凝血酶原时间(prothrombin time,PT)、国际标准化比值(international normalized ratio,INR),动脉氧分压(arterial partial pressure of oxygen,PaO2)、吸氧浓度(fraction of inspired oxygen,FiO2)。
1.2 检测方法
血常规用日本希森美康公司生产的检测仪(XN9000)检测。生化分析用德国西门子全自动生化分析仪(ADVIA®2400)分析。BNP用美国贝克曼库尔特公司生产的检测仪(DXi800)检测。PCT用德国罗氏公司生产的检测仪(Cobas 8000)检测。CRP用美国贝科克曼库尔特公司的检测仪(AU5800)检测。检测试剂均使用生产厂商的配套试剂。
1.3 治疗方法
吸氧[4](面罩吸氧,无创呼吸机,有创呼吸机),抑酸保护胃黏膜(泮托拉唑),抗感染(头孢哌酮钠舒巴坦钠,左氧氟沙星,阿奇霉素,亚胺培南西司他丁钠),抗病毒(奥司他韦,干扰素,洛匹那韦利托那韦),调节免疫(甲泼尼龙琥珀酸钠,地塞米松),保肝(还原型谷胱甘肽),化痰平喘(氨溴索,痰热清,多索茶碱),其他治疗(免疫球蛋白,人血白蛋白,连花清瘟胶囊,中草药方剂[5])。
1.4 统计学方法
采用SPSS 22.0统计软件进行数据处理。符合正态分布的计量资料采用均数±标准差表示,两组间比较采用独立样本t检验。非正态分布的计量资料采用P50(P25,P75)表示,两组间比较采用Mann-Whitney U检验。计数资料采用Fisher确切概率法。检验水准α=0.05。
2.结果
2.1 患者一般情况比较
咳嗽和发热是所有患者最常见的入院症状,发病后体温波动在38.5 ℃~40.0 ℃之间。死亡组患者发热阳性率较存活组明显为低(54.5% vs 94.1%,P<0.05),详见表1。
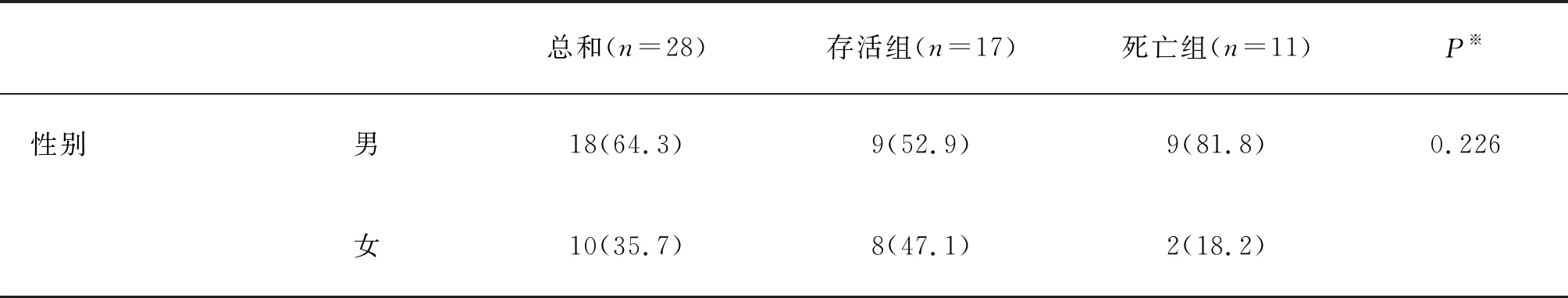
表1 患者的一般情况[n,(%)]
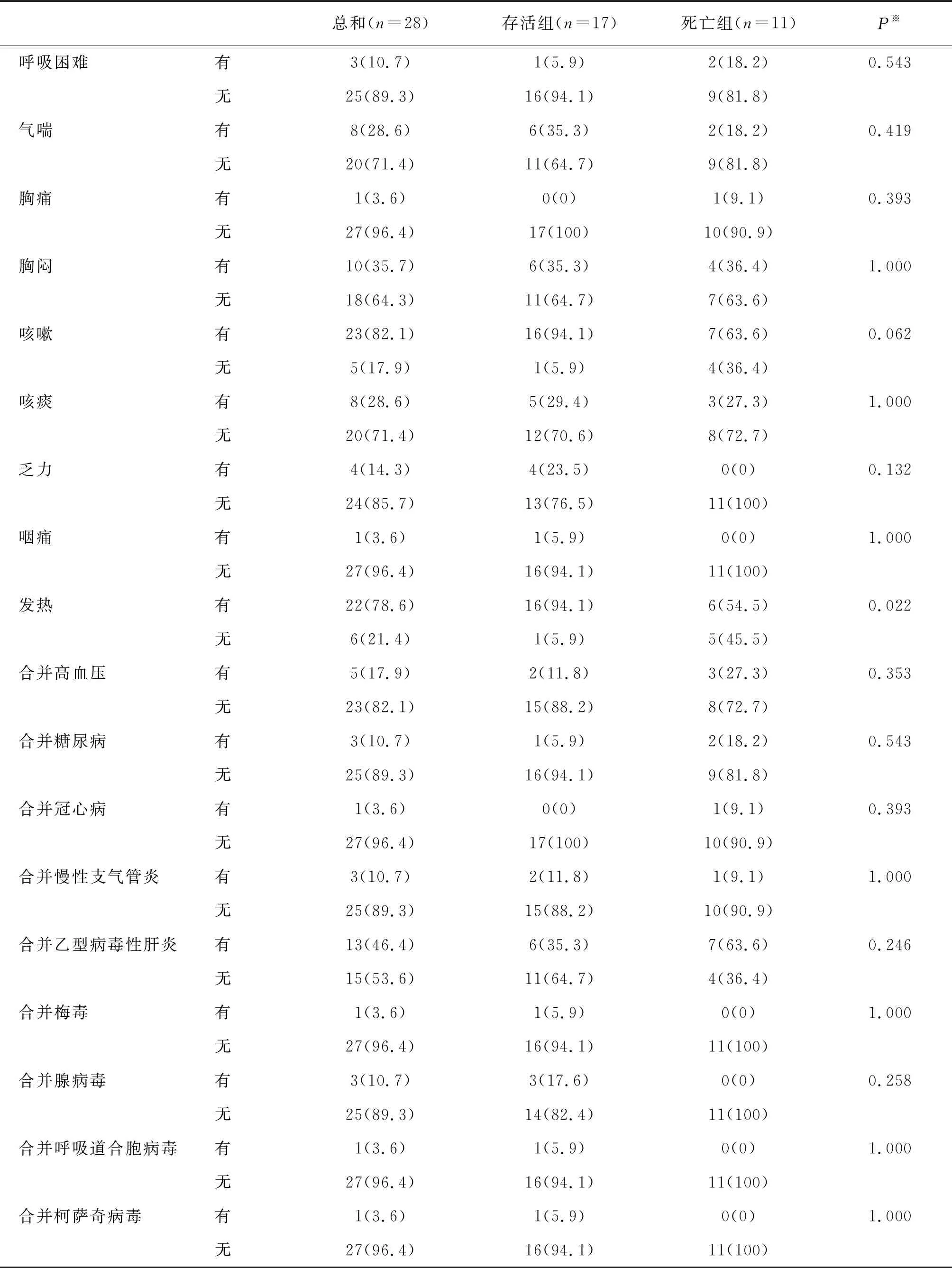
续表:
2.2 入院指标比较
存活组与死亡组年龄及入院时的SBP、LY、ALB、TBIL、LDH存在差异。余入院指标均无统计学差异(P>0.05),详见表2~3。

表2 入院指标在存活组与死亡组间的比较结果
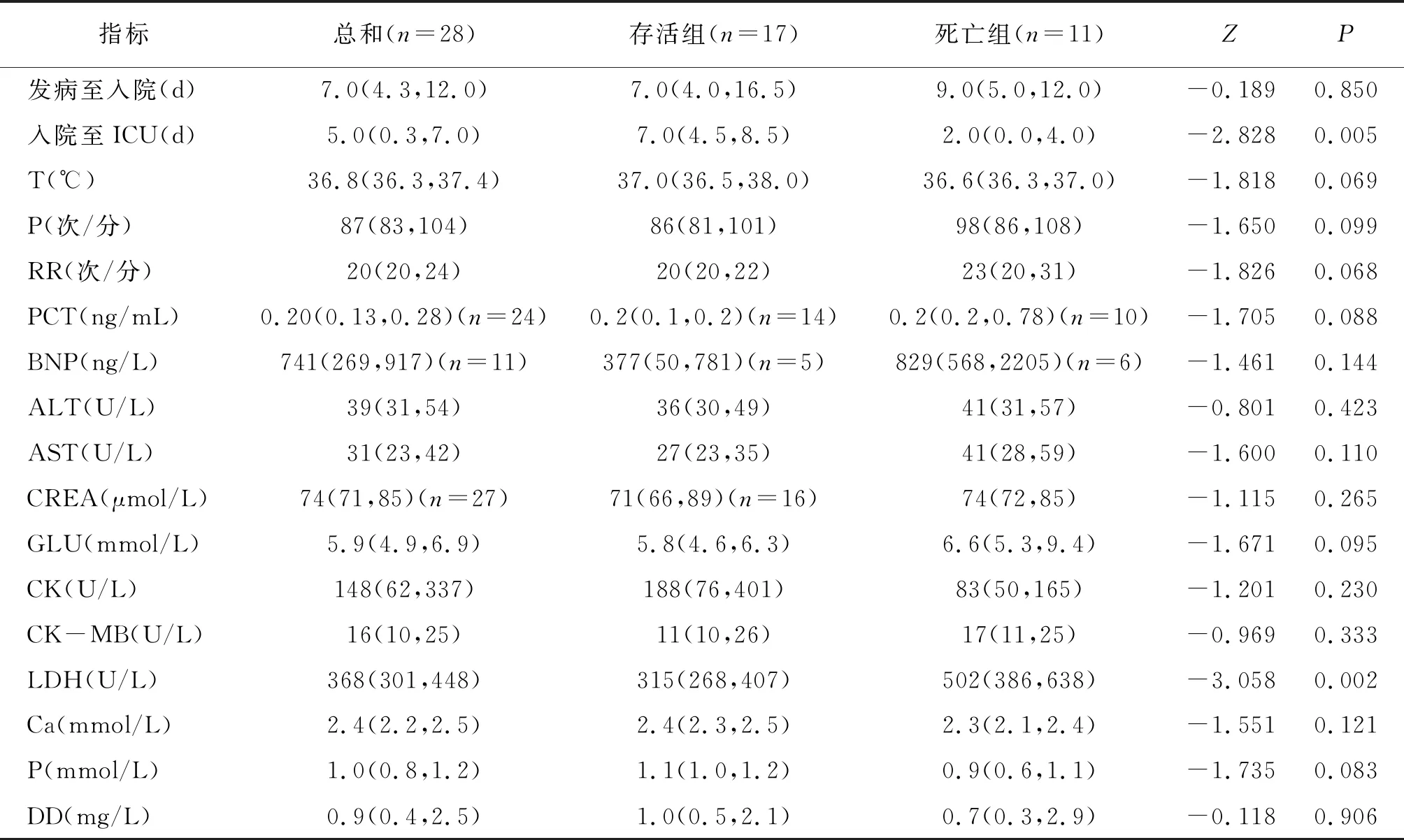
表3 入院指标在存活组与死亡组之间的比较结果[P50(P25,P75)]
2.3 入ICU者指标比较
存活组与死亡组在APACHE II、CURB-65、SOFA、RR、SBP及PLT、PCT、ALB、CREA、CK-MB、LDH、Cl-、PT、INR、PaO2、FiO2上存在差异。余入ICU指标均无统计学差异(P>0.05),详见表4~5。

表4 入ICU指标在存活组与死亡组之间的比较结果

表5 入ICU指标在存活组与死亡组之间的比较结果[P50(P25,P75)]

续表:
2.4 随访
所有死亡患者均未行尸体检查。于2020年5月8日完成随访,存活17例患者中2人失访。出院后12例复查胸部CT,5例示渗出未完全吸收。所有病例复查核酸示阴性。
3.讨论
本组28例重型和危重型患者中男性18例、女性10例;患病年龄54.8±15.1岁,与其他报道[6,7]的年龄范围相仿,也是男性比例高。15例患者患有一种或多种基础疾病,包括高血压、糖尿病、冠心病、慢性支气管炎等。发病至就诊的中位时间为7天,其中死亡组患者就诊中位时间为9天,但二者没有统计学差异,这与一些研究显示的从疾病发作到首次就诊的平均持续时间为5.8天(95%CI 4.3至7.5天)相似[8-10]。在临床表现中,本组22例患者的症状为咳嗽和发热,这与其他报告的研究结果一致[11-14]。本组13例患者合并乙型病毒性肝炎。尚不清楚乙型病毒性肝炎是否可以使人群易感COVID-19。有研究显示COVID-19患者有肠道受累的症状[15],而本组患者并没有胃肠道症状。总体来看,所有患者入院体温的中位数为36.8 ℃,未现体温过高者,可能与患者发现发热后在入院前自行使用降温药物有关。死亡组在入院心率上比存活者高(98 vs 86次/分),但差异无统计学意义。死亡组呼吸频率中位数为23次/分,高于存活组(20次/分),差异无统计学意义。死亡组的收缩压及舒张压的均数均高于存活组(139 vs 123mmHg;85 vs 76mmHg),死亡组合并高血压3例,存活组合并高血压2例,基本可以排除是因高血压病导致的该结果。可能的原因是低氧导致机体心率升高使输出量增加引起。入院相关实验室检查示存活组患者LY升高明显,但死亡组和存活组的LY明显低于正常值,这与Dawei Wang等[16-18]的研究结果一致。而LY在机体免疫应答中起核心作用,LY主要包括T淋巴细胞和B淋巴细胞,遗憾的是限于条件,我们没有做进一步的淋巴细胞亚群分类,死亡组的LY减少提示机体的免疫应答系统受损严重,相关的研究也显示LY下降提示预后不良[19]。存活组的ALB水平比死亡组明显为高。机体ALB的降低主要是由于病程中合成减少和消耗增加所致,合成减少可能是由于摄入营养不足和肝功能受损。存活组的TBIL水平明显为低,两组在HGB的比较上无明显差异,并且基本在正常值范围内,所以基本可以排除血液系统导致的TBIL升高,升高的可能原因为肝功能受损,相应地,死亡组的AST、ALT指标也比存活组高,但是无统计学差异。肾功能指标在两组中无差异。存活组的LDH水平降低明显。LDH分为5个亚型,LDH1、LDH2主要在心肌组织受损时表达,LDH3在肺组织受损时表达,LDH4、LDH5在肝脏组织受损时表达。本组患者的LDH明显升高,死亡组升高更明显,提示肺脏组织、心脏组织及肝脏组织受损。遗憾的是我们没有做亚型检测,所以无法验证SARS-CoV-2在疾病严重时存在肺外靶器官受损的猜想。一些研究[20-22]也显示患者的上述指标明显异常。凝血指标检测示无明显升高,存活组与死亡组的差异也无统计学差异,可能的原因是因其处于疾病初期。在疾病初期即使肝功能有损伤,但凝血功能未波及。
本组患者入院至收住ICU的中位时间为5天,存活组的中位时间为7天,而死亡组的中位时间为2天,考虑到两组年龄的差异,可以初步得出平均年龄较大(62.4岁)的患者病情进展更迅速、死亡风险更高。在因病情恶化进入ICU时存活组患者的APACHE II、CURB-65、SOFA评分更低,更高的评分提示预后不良,这与实际情况相符。在入ICU时死亡组患者的呼吸频率比存活组患者明显为高(33 vs 22次/分),由此可见,随着疾病恶化,呼吸频率增加是重症患者的主要临床表现,患者的呼吸衰竭可能与SARS-CoV-2侵袭神经有关[23]。入ICU后死亡组的收缩压平均值进一步上升(139 vs 141mmHg),并且比存活者显著为高(141 vs 126mmHg),在心率无明显变化的情况下出现血压升高,可能是应激导致血管收缩受体被激活。随着疾病的发展,存活组PLT比死亡组明显为高,PLT是宿主血管内免疫和炎症的关键调节者之一,除了参与凝血过程外,还能直接识别、隔离和杀死病原体,激活并引导中性粒细胞(neutrophile granulocyte)到感染和炎症的部位,增强它们吞噬和杀死病原体的能力,并诱导产生独特的效应功能[24]。本研究显示死亡组的PLT低于存活组,其原因可能是PLT参与机体炎症防御反应被损耗以及COVID-19造成脏器损伤,影响骨髓造血细胞产生不良反应使PLT合成减少[25],相关的研究显示PLT的减少可以增加院内死亡风险[26-28]。存活组与死亡组的PT及INR均有统计学差异,提示凝血紊乱可能与病情相关。虽然DD在两组里无统计学差异,但入ICU时该指标较正常值明显升高,提示纤溶系统功能紊乱。相关研究[29-31]提示凝血在该疾病的进展中发挥重要作用。死亡组PCT升高提示机体在感染SARS-CoV-2的同时继发了细菌感染,多重的感染直接致病情恶化,加重机体中毒反应。两组ALB水平在入ICU后均较入院时降低(37 vs 31;31 vs 27g/L),但死亡组降低更明显(27 vs 31g/L),肝功能的进一步损伤可以解释ALB的进一步降低,证据就是疾病后期出现凝血功能紊乱,实验室检查表现为PT延长、INR升高。肾功能在入院时无明显改变,但在入ICU时,死亡组患者的CREA明显升高,但只是轻度升高,这与刘洋[32]发现的COVID-19患者出现并不多见的严重肾损伤的情况基本一致。同时杨向红[33]的研究指出,重症患者约有4.3%出现CREA>133 μmol/L,AKI发生率为2.9%,本组CREA>133 μmol/L者仅1例(3.6%),病例特征:男性,67岁,死亡。随着SARS-CoV-2对多脏器的损害,LDH较入院时逐渐升高(368 vs 419U/L),提示肺脏、肝脏及心脏组织损伤进一步加重,同时死亡组CK-MB较存活组明显上升,从侧面证明SARS-CoV-2可能随着疾病的发展,对心肌的毒性作用逐渐增加[34-37]。虽然死亡组血液Cl-水平更高,但仍处于正常值范围内,升高的原因可能为呼吸性碱中毒所致。血气分析中两组PaO2、FiO2的差异有统计学意义,直接反映两组的肺损伤程度不同,死亡组PaO2/FiO2明显下降(115 vs 209,P<0.05)。许多感染SARS-CoV-2的患者,特别是重症患者,都有并发症发生,包括急性呼吸窘迫综合征、休克、急性肾损伤、急性心肌损伤和继发感染[38]。
本组治疗包括吸氧、保护胃黏膜、抗感染、抗病毒、调节免疫、保肝、化痰平喘及使用中草药制剂,取得了良好的疗效。氯喹和羟氯喹可能对治疗COVID-19有效[39]。本案重症患者死亡率为39.3%(11/28)。
患者入院时的发热和咳嗽是主要症状,可伴有胸痛、胸闷及呼吸困难。目前氯喹和羟氯喹可能对治疗COVID-19有效,在继发细菌感染的同时可以使用抗生素药物控制感染,使用中药能提高患者的机体免疫力,从而提高生存率。目前COVID-19的重症患者死亡率仍较高,对此有必要做进一步的研究。

