硅纳米粒子的功能化及生物分析应用*
李春荣,邹小勇,戴宗
1. 中山大学化学学院,广东广州510275
2. 中山大学生物医学工程学院,广东深圳518107
3. 黔南民族医学高等专科学校,贵州都匀558013
硅是地壳中含量第二大元素,为各种硅相关应用材料提供了丰富而低成本的资源支持。与20世纪90 年代就已兴起的半导体量子点(如CdSe,CdTe 等)相比[1-3],硅纳米粒子是一类由于量子限域效应而发展起来的具有优异光学性能的新型无机纳米材料。近年来,基于硅纳米粒子的发光性能、光稳定性、以及在荧光检测中的高灵敏和快速响应能力,硅纳米粒子在光学传感[4-5]、生物成像[6-8]、及生命医学领域受到广泛的应用并得到长足发展[9-10]。虽然单一硅前体制备的荧光硅纳米材料可以作为荧光信号调节介导,但缺乏对生物分子特异性识别能力,无法满足在荧光分析检测及生物医学领域需要。功能化修饰的硅纳米材料不仅能增强硅纳米粒子水溶性,同时还可以提供更加准确的生物成像及荧光分析检测信息,逐渐成为生物传感、荧光检测及成像领域的研究热点。本文概述了硅纳米粒子的功能化修饰,总结了硅纳米粒子在荧光检测、生物传感及成像等领域应用工作。并对基于硅纳米粒子功能化修饰后的前景及应用进行了展望。
1 硅纳米粒子功能化发展
1.1 金属离子掺杂
为了满足硅纳米粒子性能需要,通过掺杂金属离子得到功能改善的硅纳米粒子研究越来越受到关注。近年来,已研制了一系列的金属或者非金属离子掺杂的荧光硅纳米粒子,并被应用于光、电、催化、生化传感及肿瘤治疗等领域[11-17]。2015 年,Mcvey 等[18]通过掺杂的方法将铜、锰、镍金属分别掺杂入氯化硅得到荧光性能优异的掺杂硅纳米粒子,掺杂后的硅纳米粒子发射和吸收波长相比于未掺杂的纳米粒子红移近40 nm,并且激发态的动力学也发生了明显改变。金属离子掺杂硅纳米粒子通常需要利用金属掺杂的硅前体,通过多步反应制备得到,所得硅纳米粒子的掺杂浓度较高(约0.5%),并且通常是发出蓝色荧光。2017 年,Chandra[19]利用三乙氧基硅烷首先在金属(铜、钴、镍、锰)盐溶液中进行水解聚合,得到掺杂了金属离子的(HSiO1.5)n。然后对其进行高温热解、酸刻蚀和氢化硅烷化,反应后得到了具有良好尺寸分散,荧光发射峰处于近红外区的掺杂硅纳米粒子。
1.2 小分子配体修饰
尽管硅纳米粒子有毒性小、成本低、丰度高及光学性能独特等固有优点,硅纳米粒子作为典型量子点和商用有机染料的替代材料在发光和生物成像应用中已被广泛接受。但如何提高硅纳米粒子的光致发光性能(如超高量子产率、高稳定性、尖锐发射峰)仍是一个具有挑点性问题,制约了硅纳米粒子在生物荧光传感领域应用。因此,通过合理设计配体,对纳米粒子表面进行修饰,从而实现硅纳米粒子功能化,已经引起研究者们的广泛关注。在近10 年中,科研工作者们通过探究硅纳米粒子的表面特性,揭示硅纳米粒子与配体之间电子转移模式,选择设计合理的功能性分子配体,实现硅纳米粒子在量子产率以及发射波长的调控[20-24]。2011 年,Zong 等[25]利用聚乙烯亚胺(PEI)罗丹明B 异硫氰酸酯(RBITC)和异硫氰酸荧光素(FITC)支接在硅纳米粒子表面,形成多发射硅纳米探针。构建的探针分别在518 nm和580 nm 处有发射峰,Cu2+与PEI/RBITC 发生作用后,生成稳定的螯合物。导致从荧光团RBITC 到Cu2+螯合体中心的能量共振转移,探针在580 nm的荧光信号降低,因此完成了比率荧光法对水样中的铜离子的高灵敏检测,检出限为10 nmol/L。2016 年,Chu 等[26]用异硫氰酸罗丹明B 和多巴胺配体共同修饰在硅纳米粒子的表面(如图1所示),利用罗丹明B对pH不敏感以及多巴胺对pH敏感的性质,实现了比率型自校准pH 传感,结合硅纳米粒子自身的光学稳定性,并将修饰的硅纳米探针用于细胞质内pH 的示踪。2016 年,Li 等[27]报道了利用金属钠和萘在聚乙二醇溶剂中反应1 h 后,然后滴加溴化硅,继续搅拌,再向反应器中加入1,2,3,4-四氢咔氮唑进行表面氮包覆修饰,制备的硅纳米粒子量子产率高达90%,且半峰宽很窄(40 nm)的黄色荧光硅纳米粒子,制备的Silicon nanoparticles (SiNDs)可以与商业染料以及典型的量子点的荧光性能相比较。2017 年,Li 等[28]用抗体共轭硅量子点纳米颗粒和有机染料对活癌细胞进行了免疫染色的时间可控荧光成像,用于同时检测两个目标物并去除背景自发光信号。与其他常用生物荧光团的荧光寿命相比,共轭修饰的硅纳米粒子具有非常长的光致发光荧光寿命(约25 μs),这种巨大的荧光寿命差异使得时间可控成像成为可能。2018 年,Zhang 等[29]利用硅量子点表面自带的氨基基团,通过共价偶合方法将带有荧光基团的适配体修饰在硅纳米粒子表面,通过设计T-Hg2+-T 碱基结构,准确识别Hg2+,硅纳米粒子荧光不受Hg2+影响,适配体修饰荧光被淬灭,通过荧光比率方式实现了对血清样品中Hg2+的检测。
1.3 核酸修饰
DNA 功能化修饰纳米探针具备对目标物特异性识别作用,利用修饰的DNA 序列与纳米粒子的共价偶合或非特异性吸附作用,构成一种相对稳定的DNA 功能化纳米探针,基于修饰DNA 序列与核酸检测目标物之间的碱基互补配对作用,实现对目标分析物的特异性识别检测。2017 年,Zhang等[30]制备了水溶性硅纳米粒子SiNDs,将FAM 荧光染料标记的适配体AS1411 通过偶合反应交联剂Sulfo-SMCC 共价修饰至SiNDs,构建了一个比率型pH 探针。SiNDs 中氨基与过量Sulfo-SMCC 的琥珀酰亚胺作用,产物(SiNDs-Mal)可以作为对pH不敏感的荧光参比。通过将一端标记对pH 敏感的荧光素FAM,另一端标记巯基的AS1411 适配体与SiNDs-Mal之间发生迈克尔(Michael)反应,制备了对pH 敏感的适配体功能化比率型荧光探针(SiNDs-Apt-FAM)。2018 年,He 课题组[29]发现在Hg2+存在下,SiND 对富含T 碱基DNA 上标记的染料Rox有荧光淬灭作用,通过共价偶联作用,将富含T 碱基的DNA 链修饰到SiND,基于T-Hg2+-T作用,构建了一种小粒径,低毒性、抗酸碱性、水溶性比率型Hg2+探针,并实现了对人血清、尿样中Hg2+定量检测及HeLa 细胞中Hg2+成像。2018 年,Ji等[20]等用硫酸鱼精蛋白(ps)修饰硅纳米粒子,得到ps@SiNPs 基因载体。带负电荷质粒DNA(pDNA)可以通过静电相互作用,有效地结合在ps@SiNPs 基因载体表面,特别是这种基因载体具有稳定的高荧光性(光致发光量子产量PLQY:25%)。此外,基于ps@SiNPs 的基因载体对正常线粒体代谢活动表现出最小毒性作用(例如,人类视网膜色素上皮细胞(ARPE-19)在与相应载体孵育48h 后仍能保持90%细胞活力)。除此之外,通过选择适宜的反应原料,同样可以制备功能化硅纳米粒子。2019 年,Wei 等[31]采用(3-氨基丙基)-三乙氧基硅烷和二乙烯-三胺-五乙酸为前体,水热法制备了具有蓝色荧光的硅纳米粒子,硅纳米粒子作为铕离子(Eu3+)共价键配体,也是内部参考信号。在四环素(TCs)的作用下,Eu3+发光强度显著提高,而SiNDs发光强度降低,实现荧光比率型检测TCs的含量,该方法成功用于检测天然河流样品和牛奶样品中TCs的含量。
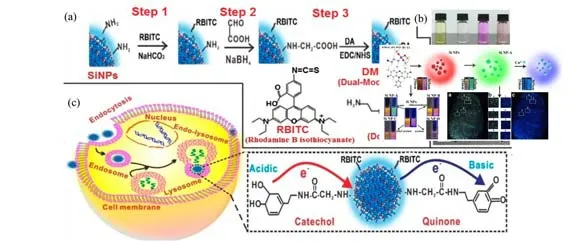
图1 基于双改性SiNPs(DMSiNPs)的pH传感器的构建[26]Fig.1 Construction of dual-modified SiNPs(DMSiNPs)-based pH sensor[26]
2 硅纳米粒子的荧光检测
2.1 离子检测
金属离子特别是微量元素金属离子作为生物大分子组成部分或辅助成分,或用于激素、维生素的构成,对维持机体正常生命活动起着非常重要作用。然而重金属离子含量超标不仅对环境带来危害,同时影响人类生命安全。2019 年,本课题组[32]提出了一种新颖的酶辅助目标回收扩增策略,该策略基于DNA 组装结构的等温扩增,结合内切酶辅助等温扩增,实现了对血清样品中Hg2+的高灵敏分析检测。随着纳米传感技术的发展,纳米粒子以独特的光学性能和对金属离子的特异性识别性能被广泛应用,特别是基于硅纳米粒子的传感平台越来越多的被开发出来。2018 年,Phan等[33]利用L-抗坏血酸与3-(2-氨基乙基酰胺)-丙基-三甲氧基硅烷(AEAPTMS)一步合成了蓝色荧光硅量子点,利用硅量子点作为荧光传感器。由于硅量子点表面官能团特殊,铬离子Cr(Ⅵ)能够选择性淬灭硅量子点特征发射峰,通过荧光淬灭机制实现对水样中Cr(Ⅵ)快速检测,硅量子点还可以实现肿瘤细胞荧光成像。2019 年,Tang等[34]利用臧红(T)与APTMS 制备了双发射的硅纳米粒子(SiNPs),实现基于硅纳米粒子发射波长变化的检测新途径(如图2 所示)。硅纳米粒子在不同的溶剂中分别显示不同荧光颜色。其中,SiNPs-A 对Cu2+有特定响应,在与Cu2+作用后,SiNPs-A 表面基团与Cu2+形成了配位化合物,导致SiNPs表面化学状态发生改变,在436 nm 处荧光增强比500 nm 处荧光增强更加明显。继续增加Cu2+浓度,SiNPs-A 的荧光逐渐从绿色转化为蓝色,实现了对Cu2灵敏检测,检出限为0.91 μmol/L。利用硅纳米粒子SiNPs-A 在254 nm 和365 nm 激发波长下不同荧光颜色,还可以实现复杂背景下潜在指纹的特征提取。
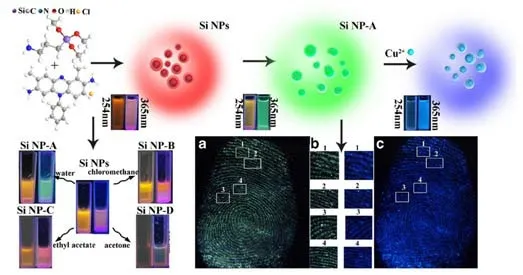
图2 臧红T与APTMS制备硅纳米粒子(SiNPs)及其硅纳米粒子在不同溶剂中的荧光,以及在水分散硅纳米粒子(SiNP-A)在潜在指纹(LFPs)检测和显示中的应用[34]Fig.2 Illustration of the method for preparation of safranine-dyes silica nanoparticle (SiNPs),the evolution of SiNP-A,SiNP-B,SiNP-C and SiNP-D,and the application of water-dispersed silica nanoparticles(SiNP-A)to the detection and visualization of latent fingerprints(LFPs)[34]
此外,硅纳米粒子还可应用于阴离子检测。2018年,Xiang等[35]首先将罗丹明B,APTMS、四乙氧基硅烷在氨气中室温条件下合成了染料罗丹明B修饰的硅纳米粒子。然后,再将有机硅烷修饰碳点包覆在硅纳米粒子表面,制备出双发射的硅纳米粒子(CD@RhB-SiNPs)。在波长460 nm 的发射来自碳点(CDs),波长572 nm 的发射来自罗丹明B荧光团。在酸性条件下,硅纳米粒子的荧光可以被溴酸根轻微淬灭,当再加入亚硝酸根后,两个发射峰强度都出现了明显降低。来自CDs的荧光发射峰强度降低比率更加显著。基于这一现象,实现了对食品及蔬菜中亚硝酸盐检测。据悉在食用盐中加入亚铁氰化钾(K4[Fe(CN)6])可以防止食盐结块,然而过量的K4[Fe(CN)6]及其分解产物对人类健康和环境都是有害的。2019 年,Na 等[36]利用3-(2-氨基乙氨基)丙基-二甲氧基硅烷(DAMO)和抗坏血酸钠(AS),一步合成了具有良好光、热稳定性和水溶性的新型蓝色荧光硅量子点。硅量子点的荧光可以通过静电作用被K4[Fe(CN)6]显著淬灭。基于这一现象,建立了一种选择性好、灵敏高、速度快的K4[Fe(CN)6]检测方法。该方法已成功地用于实际样品中K4[Fe(CN)6]测定。在0.05 ~8.0 g/mL 之间有较宽的线性范围,检出限为30 ng/mL。建立的荧光新方法适用于食盐和腌制食品样品中K4[Fe(CN)6]检测,结果满意。
2.2 生物小分子检测
生物小分子例如氨基酸、葡萄糖、三磷酸腺苷(ATP)、多巴胺,维生素,尿酸、抗坏血酸等在维持机体正常的生理功能方面发挥着非常重要作用[37,4,38-45]。2015 年,Zhang 等[46]以APTMS 为硅前体,微波法制备了蓝色荧光硅纳米粒子。多巴胺可以有效淬灭硅纳米粒子荧光,利用多巴胺自身易被氧化为多巴胺醌的性质,荧光淬灭机理是能量通过荧光共振能量转移从SiNPs 转移到氧化的多巴胺醌分子,硅纳米粒子自身荧光被淬灭,实现了对多巴胺灵敏检测,检出限为0.3 nmol/L。该方法不需对纳米粒子进行修饰,根据硅纳米粒子与多巴胺醌之间的能量共振转移,即可完成对多巴胺的检测,且分析检测方法简便,灵敏,易操作。2018 年,Roy 等[9]采用鲁棒反胶团法制备了烯丙胺功能化的硅量子点(ASQDs),将该材料作为选择性识别硫氰酸盐(吸烟者与非吸烟者的生物标志物)的荧光探针,基于ASQDs 荧光淬灭和回升,构建了选择性好、高准确度高的异硫氰酸盐检测方法,检出限为0.1 nmol/L。2019 年,Chen 等[4]利用APTES 和葡萄糖为原料,通过微波一步法制备了蓝色荧光硅纳米粒子(如图3所示)。由于内滤光效应(IFE),高锰酸盐可以淬灭硅纳米粒子的荧光,通过高锰酸盐与H2O2的氧化还原反应,硅纳米粒子的荧光得到恢复,实现了对H2O2灵敏检测,检出限为2.8 nmol/L。由于H2O2是一种重要分子,涉及各种研究,通过葡萄糖催化氧化生成H2O2,构建了一种检测葡萄糖的灵敏传感器,线性响应范围为0.16~16 μmol/L,检出限0.11 μmol/L。同年,Long等[42]以3-氨基丙基三乙氧基硅烷和柠檬酸钠为硅前体和还原剂,通过微波法合成了一种荧光强度更强的SiQDs,由于维生素B12(VB12)吸收峰与SiQDs 荧光发射峰有非常多重叠,因此通过两者之间同步重叠协同作用,VB12 对SiQDs 有很强的淬灭作用,淬灭效率在VB12浓度0.5~16.0 μmol/L之间呈线性增加,检出限为158 nmol/L。另外,该方法还实现了药物片剂和人尿液样品中VB12 的检测,回收率为97.7%~101.1%。以上均是基于硅纳米粒子的生物小分子的检测,检测方法灵敏,检出限较低,开拓了硅纳米粒子的应用范围。本课题组在生物小分子检测方面也进行了相关研究,2019 年,本课题组[47]提出了一种基于MOF 酶复合材料的all-in-one 传感器构建策略,利用多孔结构和guest-prisoner 角色以及经典MOF 发光传感特性。将响应性MOF 集成到MOF 酶复合材料中,设计了一种集催化和发光功能于一体的多功能复合材料,并将其整合到单个粒子。将葡萄糖氧化酶(GOx)包裹在一个对氧(O2)敏感、不含贵金属、发光CuI 三唑酸框架(MAF-2)中,记为GOx@MAF-2。MAF-2 对O2敏感,GOx@MAF-2 复合材料对溶解氧表现出快速和可逆的响应,不需要显色底物,级联酶反应,或电极系统,直接比率传感检测人血清中葡萄糖水平。

图3 (a)合成硅纳米粒子的原理;(b)传感检测H2O2和葡萄糖[4]Fig.3 (a)Schematic illustrations of SiND synthesis;(b)Application in the sensing of H2O2 and glucose [4]
2.3 核酸检测
核酸是所有生物分子中最重要的物质,在遗传信息存储,指导蛋白质合成及表达信息传输方面具有非常重要的作用,许多疾病的根源与核酸序列变化及表达水平异常有关[48-51]。MicroRNA(miRNA)是目前研究最为广泛的一类非编码短链RNA,参与生命活动各个层次的调节,并与恶性肿瘤等重大疾病密切相关,成为疾病诊断生物标志物。建立miRNA 快速灵敏检测方法,对进一步深入了解miRNA 与疾病发生发展的关系,为疾病早期诊断提供新技术,具有十分重要的理论意义和实用价值[52-54]。近几年,本课题组[55-57]发展了多种miRNA 检测方法,实现了恒温下对细胞内miRNA 成像分析检测。2018 年,我们提出了一种基于短探针DSN 信号放大(spDSNSA) 策略,能够在37 ℃下显著提高miRNA 分析特异性[58]。通过对不同类型DNA 探针扩增反应系统性研究,发现探针与目标miRNA 之间的退火速率对扩增过程动态有很大影响。通过缩短DNA 探针长度,spDSNSA特异性显著提高,且扩增效率没有损失。在检测let-7a 时,该方法特异性明显高于传统DSNSA 方法。硅纳米粒子作为一类新型纳米材料,在核酸检测领域也受到广泛应用。Li 等[59]通过一锅两步反相微乳液法合成了3- (2,2-双吡啶) -二氯钌(Ⅱ)六水合物掺杂的二氧化硅(FS)纳米粒子(如图4所示)。首先通过聚乙二醇(PEG)和氨基对FS 进行修饰,使其具有更好的生物相容性与生物偶联作用,将适配体AS1411 与FS 表面氨基进行偶联,然后再将分子信标(miR-21-MB) 标记在FS 探针上,用于特异性识别乳腺癌细胞MCF-7 中miR-21。通过AS1411 适配体功能化FS 纳米颗粒,利用核仁蛋白实现肿瘤细胞特异性递送,探针释放miR-21-MB 与miR-21 发生链杂交反应,实现了miR-21 成像。2018年,Zhang等[60]发现SiNPs与带负电荷且有荧光基团修饰单链DNA(ssDNA)之间有静电吸附作用,当荧光基团靠近SiNPs 时,SiNPs 可以淬灭荧光信号。当有待检测miRNA 存在时,miRNA与ssDNA 之间发生碱基互补配对作用,双链DNA结构改变使荧光基团脱离SiNPs 吸附,使荧光信号回升,因此建立了简单,快捷miRNA 检测方法,并实现对生物样品尿液、血清中miR-27a检测。

图4 FS-AS/MB的合成和使用FS-AS/MB靶向Theranostics的策略示意图[59]Fig.4 Schematic of the synthesis of FS-AS/MB and strategy of cancer-targeting theranostics using FS-AS/MB[59]
Ding 等[61]设计了一种基于SiNPs 与HCR 信号扩增的新型、无标记、无酶参与的荧光生物传感器用于miRNA 检测。在该策略中,两个DNA 发卡探针(HP1 和HP2)通过miRNA 触发HCR 反应,形 成Hemin/G 四 联 体DNAzyme。DNAzyme 能 在H2O2作用下将邻苯二胺(OPD)氧化为2,3-二氨基萘嗪(DAP)。DAP 吸收峰与SiNPs 发射峰有很好重叠,通过较强内滤作用使SiNPs 发生荧光淬灭,根据SiNPs荧光降低来确定miRNA浓度。该设计策略对miRNA 检测具有很高的选择性,为基于内滤作用SiNPs 荧光传感策略提供了新视角。
3 硅纳米粒子的成像应用
3.1 细菌成像
荧光硅纳米粒子具有良好生物相容性及较强抗光漂性,可控载药能力以及较小纳米尺寸,已经被美国食品和药物管理局(FDA)批准进行首次人体临床试验[62-64]。2018年,Meng等[65]利用石墨烯(GO),银纳米颗粒(AgNP),硅(Si)构建了三明治纳米复合材料(G@AgNPs@Si),该材料表现出信号强度大、稳定、表面增强拉曼散射效果可重现,并具有可靠定量分析能力,该芯片作为一种新型多功能平台,能够同时捕获、识别和灭活细菌。当细菌为108CFU·mL-1时,细菌捕获效率为54%,处理24 h后,抗菌率达93%。且通过芯片可以很容易区分进入血液中的大肠杆菌和金黄色葡萄球菌。2019 年,Tang 课题组[66]开发了多功能硅纳米制剂用于成像及治疗多种细菌性病原体引起的感染。硅纳米粒子经过葡萄糖聚合物功能化(例如,聚[ 4-O-(-a-d-glucopyranosyl)-d-glucopyranose]),并负载氯化物e6(Ce6)。通过ATP 结合盒(ABC)转运蛋白通路机制,迅速内在化到革兰氏阴性和革兰氏阳性细菌中。通过SiNPs 绿色荧光和Ce6 红色荧光进行细菌成像,体内可检测105个菌落形成单位。在波长660 nm 照射下,硅纳米制剂对金黄色葡萄球菌体内光动力抗菌率为98%,对铜绿假单胞菌抗菌率为96%,同时实现对细菌进行成像和治疗。
3.2 细胞成像
硅纳米粒子优越的荧光性能和良好生物相容性使其具有良好的生物应用潜力,基于硅纳米粒子的荧光性能及纳米载体功能已广泛应用于细胞成像。Wang 等[67]基于铕(Eu3+)掺杂双发射硅纳米粒子Eu@SiNPs,实现对活细胞内温度的高精确度检测(如图5所示)。Eu@SiNPs在波长455 nm有蓝色荧光,在波长620 nm 处为红色荧光。温度升高,红色荧光增强;当温度降低时,蓝色荧光增强。Eu@SiNPs 比率型的荧光强度在25~70 ℃温度范围内呈现良好线性响应,并且可以实现30 min对活细胞内温度监测。除了以硅纳米粒子为功能载体进行活细胞成像之外,2019 年,本课题组[68]通过设计新型亚稳态哑铃探针(MxDPs)装置,克服了传统探针水解限制,同时提高了转染、抗消化率、组装动力学和纳米结构均匀性。MxDPs 可在活细胞中保持稳定性长达16 h,并可通过HCR快速产生均匀致密的DNA 纳米结构。来自荧光共振能量转移级联积累的尖锐信号进一步减小了系统波动影响。基于MxDPs 的HCR 方法在细胞裂解液和缓冲液下对miR-27a 的分析表现出相同性能,检出限为3.2 pmol/L,比传统发夹探针低44 倍。MxDPHCR 法能清晰区分正常细胞和肿瘤细胞,并提供了细胞内特异性miRNA更准确定量信息。

图5(a)基于Eu@SiNPs用于检测细胞内温度的制作示意图;(b)硅纳米粒子与Eu3+形成配合物;(c)在紫外光照射下拍摄不同温度下Eu@SiNPs的光致发光光谱[67]Fig.5 (a)Schematic illustration of fabricating Eu@SiNPs-based nanothermometer for intracellular temperature detection;(b)Local coordination process between SiNPs and Eu complex;(c)Photographs under UV irradiation and corresponding photoluminescence spectra of Eu@SiNPs under different temperature[67]
2018年,Chen等[5]以3-[2-(2-氨基乙基酰胺)乙基氨基]丙基-三甲氧基硅烷(AEEA)和玫瑰红(RB)为原料,水热法制备了高荧光量子产率的绿色荧光硅纳米粒子。该纳米粒子具有优越细胞穿透能力,能够靶向到细胞溶酶体,并且不受溶酶体pH环境影响,可以对细胞溶酶体长达48 h 实时成像监测。2019 年,Roy 等[69]利用APTMS 和乙二醇为原料水热法制备了蓝色硅纳米粒子(SQD),然后通过EDC 偶合反应将叶酸修饰在硅纳米粒子表面,得到了在紫外区和近红外区均有荧光的双发射硅纳米粒子(FSQD)。FSQD 探针分别在445 nm 和845 nm 处有荧光发射峰,并且SQD 和FSQD 均有良好pH 稳定性和光稳定性。FSQD 细胞毒性低,并有良好荧光性能,不仅可以用来活细胞成像,还可以用于标记细胞内胎球蛋白A。与传统罗丹明类染料间接标记方法相比,该方法具有数据准确可靠、操作简单、稳定、不存在间接标记导致的非特异性结合。
3.3 活体成像
近年来,科研工作者们已经开展了许多基于荧光硅纳米粒子在活体成像方面的研究。2012 年,He 等[70]提出了一种新型基于FRET 的大Stokes 位移近红外荧光二氧化硅纳米颗粒(LSS-NFSiNPs)。选择三(2,2-双吡啶)-二氯-六水合物(RuBpy)和亚甲基蓝(MB)两种高水溶性染料作为模型给体受体对。在二氧化硅纳米颗粒中同步掺杂RuBpy和MB 制得LSS-NFSiNPs。通过优化二氧化硅纳米粒子中掺杂RuBpy 和MB 的摩尔比,在二氧化硅基体中发生从RuBpy 到MB 的能量转移,生成具有强荧光和大Stokes位移(200 nm)的近红外荧光二氧化硅纳米粒子。LSS-NFSiNPs可以有效提高辨别荧光信号并区分其他背景信号,实现在活体动物中实时深层荧光成像。
为了避免引入有机试剂及复杂硅纳米粒子修饰过程,2015 年,Wu 课题组[71]介绍了一种环境友好的制备荧光SiNPs方法(如图6所示)。实验采用硅藻作为绿色硅前体,不需要额外化学试剂。在温和反应条件下可以快速(10 min内)制备出较窄发射光谱宽度(例如,半最大宽度(FWHM)为30 nm)的红色硅纳米粒子,并将其应用于生物体内和体外荧光成像。进一步将红色硅纳米粒子与常规蓝色纳米粒子分别注射到秀丽线虫生殖系统和消化系统,可以观察到在秀丽线虫子宫及小肠中分别呈现出红色荧光和蓝色荧光成像。
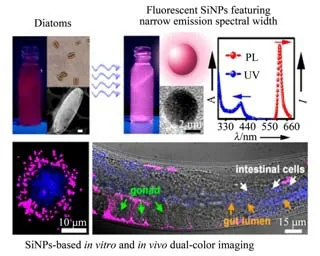
图6 SiNPs的仿生制备及同于细胞内外的多色成像示意图[71]Fig.6 Schematic illustration of biomimetic synthesis of fluorescent SiNPs and their use for in vitro and in vivo dual-color imaging[71]
4 展 望
硅纳米粒子作为一类新型纳米材料,在荧光检测及生物传感等领域中受到了广泛关注及应用。但在硅纳米粒功能化修饰及应用方面还需要考虑以下几个方面的问题:
1)制备近红外发光、量子产率高、水溶性、大尺寸的硅纳米粒子是建立有效生物传感的关键;
2)在硅纳米粒子功能化修饰过程中,应尽可能避免有机配体修饰或重金属掺杂等为纳米探针带来潜在生物毒性问题;
3)在面对多个分析物检测时,需要修饰多个荧光响应信号,对分析过程带来冗杂操作步骤,以及不可避免各个荧光信号之间的交互影响也是急需解决的问题;
4)在基于单一发射纳米粒子荧光分析检测及细胞成像中,细胞摄取探针的浓度差异,可能导致假阳性结果出现。
因此,从构建生物相容性好、高效、高灵敏、高选择性的生物传感及分析方法出发,通过合理设计反应路线,制备条件温和、修饰步骤简单、多功能化、高量子产率的硅纳米粒子是值得发展的研究方向。

