UHRF1在三阴乳腺癌细胞中的表达及增殖侵袭的影响
袁惠玲,吴丽华,陈桂林,黄珂铭
(广东省东莞市人民医院乳腺科, 广东 东莞 523000)
三阴性乳腺癌(TNBC)是一种以雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体-2(HER2)基因缺失为特征的高致死性乳腺癌亚群[1~3]。研究发现,不同基因表达谱的TNBC表现出高度不同的增殖和侵袭能力[1]。且可通过分析基因表达谱获取TNBC的生物学和潜在的治疗靶点[4]。最新研究表明,相比于非TNBC,TNBC表现出高度增殖和侵袭性增强的细胞生物学特征[5]。然而,目前对于TNBC乳腺癌的增殖性和侵袭性增强的原因尚未阐明。泛素样含PHD和环指域1(UHRF1)是一种介导DNA表观遗传修饰的重要协调分子[6]。其通过识别靶基因的N端Ub样和RING等识别结构域调节靶基因DNA甲基化参与乳腺癌等细胞增殖和细胞周期调控[6~8]。早期研究发现,UHRF1在增殖的胚胎干细胞和癌细胞中高表达,且与细胞周期G1/S相变有关[9]。另外,UHRF1的mRNA和蛋白水平会随着细胞周期而波动,而UHRF1的消耗会抑制S期进入[10]。重要的是,UHRF1通过高度甲基化启动子来抑制KLF17、MDR1和BRCA1表达,从而促进乳腺癌发生发展[10,11]。然而,UHRF1在非TNBC和TNBC乳腺癌中的表达变化及对其增殖和侵袭能力的影响尚不可知。为了揭示UHRF1在非TNBC和TNBC中的作用,现报道如下:
1 资料与方法
1.1临床资料:收集2018年4月至2020年12月非TNBC女性志愿者30例,年龄28~42岁,平均年龄(35.59±6.09)岁,经穿刺活检病理证实为TNBC的女性患者30例,年龄30~45岁,平均年龄(37.84±8.43)岁,两组女性的年龄等差别无统计学意义(P>0.05)。纳入标准:①术后经病理检查诊断为乳腺癌;②术前未进行过放疗或化疗;③免疫组化染色ER、PR和HER-2/neu阳性细胞在10%以下为TNBC有任何一项阳性者定义为非三阴性乳腺癌。排除标准:①有远端转移的患者;②其他肿瘤转移到乳腺的患者;③有严重心、肝、肾功能衰竭的患者;④有严重心血管疾病的患者;⑤有其他系统严重原发病的患者,如消化道疾病、泌尿系统疾病等。
1.2细胞培养和UHRF1敲低细胞系构建:人非转化乳腺上皮MCF-10A细胞、雌激素和孕激素受体(ER+/PR+)乳腺癌细胞系(MCF-7)和TNBC乳腺癌细胞系(MDA-MB-231和MDA-MB-436)购自于武汉普诺赛生命科技有限公司。所有细胞常规培养于含10%胎牛血清(浙江天杭生物科技股份有限公司)的DMEM高糖培养基(Thermo Fisher)中,置于37℃、5% 的CO2培养箱中培养。TNBC细胞系(MDA-MB-231和MDA-MB-436)以MOI=100的比例转导UHRF1-shRNA慢病毒(上海汉恒生物科技有限公司)48h。采用嘌呤霉素筛选获得阳性的UHRF1敲低(Knock down,UHRF1 KD)细胞系后扩增培养,对数生长期细胞接种于12孔板中24h后进行相关实验。
1.3免疫组织化学和免疫荧光检测:乳腺癌组织置于质量分数为4%多聚甲醛溶液中48h,依次采用体积分数为75%、80%、95%和100%乙醇梯度脱水60min,二甲苯透明3次,20min/次,浸入熔融石蜡62℃包埋过夜。组织蜡块4μm厚切片,置于60℃烘箱烘干1h,用Tris/EDTA(pH=8.0)修复液进行抗原修复,羊血清封闭30min,加入兔抗人UHRF1多克隆抗体(1∶200,武汉三鹰生物)4℃过夜,PBS漂洗3次,每次5min。加入生物素标记山羊抗兔IgG(1∶500,北京中杉金桥生物),室温孵育30min。PBS漂洗3次,每次5min。随后用辣根过氧化物酶标记的链霉素卵白素工作液(北京中杉金桥生物)和DAB显色液(北京中杉金桥生物)处理,苏木素复染。经过脱水、透明、封片处理后在显微镜下观察。免疫荧光采用兔抗人UHRF1多克隆抗体(1∶200,武汉三鹰生物)和鼠抗人Ki67多克隆抗体(1∶500,北京博奥森生物)4℃过夜。PBS漂洗3次,每次5min。加入FITC-山羊抗(1∶500,武汉三鹰生物)兔和CoraLite594-山羊抗鼠(1∶250,武汉三鹰生物)二抗。室温孵育30min。PBS漂洗3次,每次5min。DAPI染色1min,PBS漂洗3次,每次5min。ddH2O漂洗一次,每次5min。抗荧光萃灭剂(武汉塞维尔生物)封片,干化过夜后拍照。每张切片随机取5个视野,采用Image-Pro Plus6.0软件计量免疫组化检测中细胞的染色面积和强度。免疫荧光计算UHRF1+Ki67+/Ki67+细胞比例。
1.4qPCR检测:按照TRizol(南京诺唯赞生物科技股份有限公司)一步提取试剂盒提取细胞总RNA。使用NanoDrop2000对RNA浓度和纯度进行检测。参照cDNA合成试剂盒(南京诺唯赞生物科技股份有限公司)将500ng总RNA逆转录为cDNA。取10ng cDNA作模版,SYBGreen I (南京诺唯赞生物科技股份有限公司)为检测信号,20μL qPCR反应体系,反应程序:95℃ 3 min,95℃ 5s,60℃ 15 s,扩增35个循环,UHRF1(247bp)引物序列为5'-GGTTTCATCGCCATCCCCA -3'和5'-GTATGGCCGTCCTCCATCTG-3'。ACTB(191bp)引物序列为5'-ACAGAGCCTCGCCTTTGC-3'和5'-CCACCATCACGCCCTGG-3'。采用2-△△Ct计算扩增倍数。
1.5Western blot检测:将12孔板接种并做相应处理后的细胞用预泠的PBS润洗细胞后,吸干PBS,加入100μL含磷酸化酶抑制剂和Cocktail的RIPA总蛋白裂解液(武汉塞维尔生物科技邮箱公司),冰上裂解20 min,细胞刮收集至1.5 mL Ep管,超声破碎,12,000g 4℃离心20min,取上清液至1.5mL Ep管,以BCA法检测蛋白浓度,并40g热变性蛋白上样,于8%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳电泳,转膜后封闭,加入UHRF1一抗(1∶1000)4℃摇床孵育过夜,洗膜,加入辣根过氧化物酶偶联二抗室温下作用1h后ECL显影获取蛋白条带。以ImageJ2X分析条带灰度值,统计分析UHRF1蛋白的表达量,每组实验重复3次。
1.6CCK-8细胞活力检测:分别去取对数生长期的WT和UHRF1 KD MDA-MB-231和MDA-MB-436细胞。以5,000个细胞/孔接种于96孔培养板中,0 h、24 h和48 h后加入10μL的CCK-8溶液(Biosharp)并37℃孵育1h,采用酶标仪测定 450 nm 的吸光值(OD450)。每组设3个复孔,实验重复3次。
1.7Ki67细胞增殖检测:分别去取对数生长期的WT和UHRF1 KD MDA-MB-231和MDA-MB-436细胞。以10000个细胞/孔接种于24孔培养板中,24 h和48 h后加4%中性甲醛固定液固定15min,PBS漂洗3次,每次5 min。随后加入0.3% TritonX-100的5% BSA溶液破膜封闭20 min,加入Ki67抗体(1∶200)室温孵育1 h。PBS漂洗3次,每次5 min。随后加入DAPI室温孵育1 min后PBS漂洗3次,每次5 min。ddH2O漂洗一次,每次5 min。抗荧光萃灭剂封片,干化过夜后拍照。每张切片随机取5个视野,采用Image-Pro Plus 6.0软件计量Ki67+细胞比例。
1.8Transwell侵袭实验:用50mg/L Matrigel (BD公司)1∶8稀释液包被Transwell小室(Corning)底部膜的上室面,4℃风干。对数生长期的WT和UHRF1 KD MDA-MB-231和MDA-MB-436细胞撤血清饥饿12 h,制备细胞悬液后以10,000个细胞200μL加入Transwell小室,下室加入500μL含5% FBS的培养基。常规培养24h后加入0.1%结晶紫染色染色 15min后拍照。每孔随机取5个视野,采用Image-Pro Plus 6.0软件计量结晶紫染色比例。

2 结 果
2.1Non-TNBC和TNBC患者组织中UHRF1的表达:TNBC患者组织中UHRF1蛋白表达明显高于Non-TNBC患者,差异具有统计学意义(P<0.001),详见图1A。且TNBC患者UHRF1+Ki67+/Ki67+细胞比例明显高于Non-TNBC,差异具有统计学意义(P<0.05),详见图1B。
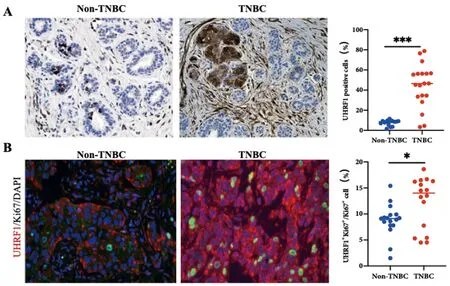
图1 TNBC患者组织UHRF1和UHRF1+Ki67+/Ki67+细胞比例明显高于Non-TNBC。UHRF1在Non-TNBC和TNBC患者组织中表达比较;B: Non-TNBC和TNBC患者组织中UHRF1+Ki67+/Ki67+细胞比例比较。(n=16~20)
2.2乳腺癌细胞系中UHRF1蛋白和mRNA含量比较:TNBC乳腺癌细胞系(MDA-MB-231和MDA-MB-436)中UHRF1 mRNA和蛋白表达明显高于人非转化乳腺上皮MCF-10A细胞和雌激素与孕激素受体(ER+ / PR+)乳腺癌细胞系(MCF-7),差异均具有统计学意义(P<0.01),详见图2。
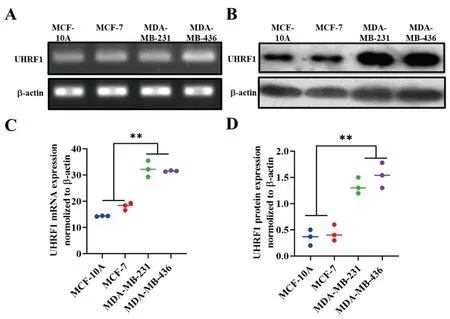
图2 人胰腺癌细胞系高表达TRPC3。A:UHRF1 mRNA在TNBC乳腺癌细胞系(MDA-MB-231和MDA-MB-436)、非转化乳腺上皮MCF-10A细胞、雌激素和孕激素受体(ER+ / PR+)乳腺癌细胞系中表达比较;B&C:UHRF1 蛋白在TNBC乳腺癌细胞系(MDA-MB-231和MDA-MB-436)、非转化乳腺上皮MCF-10A细胞、雌激素和孕激素受体(ER+ / PR+)乳腺癌细胞系中表达比较。(n=3)
2.3下调UHRF1对TNBC细胞系增殖的影响:采用UHRF1-shRNA慢病毒转导TNBC细胞系(MDA-MB-231和MDA-MB-436)构建UHRF1 KD细胞系。结果显示,UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)低表达UHRF1,差异均具有统计学意义(P<0.01),详见图3A。与0 h相比,24 h和48 h的UHRF1 WT和UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)增殖明显增加,差异均具有统计学意义(P<0.01),详见图3B,C。且相比于UHRF1 WT细胞,UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)在48 h的增殖率明显降低,差异均具有统计学意义(P<0.01),详见图3B,C。同时,UHRF1 KD的TNBC细胞系(MDA-MB-436)在48 h的Ki67+细胞比例明显减少,差异均具有统计学意义(P<0.01),详见图3D。
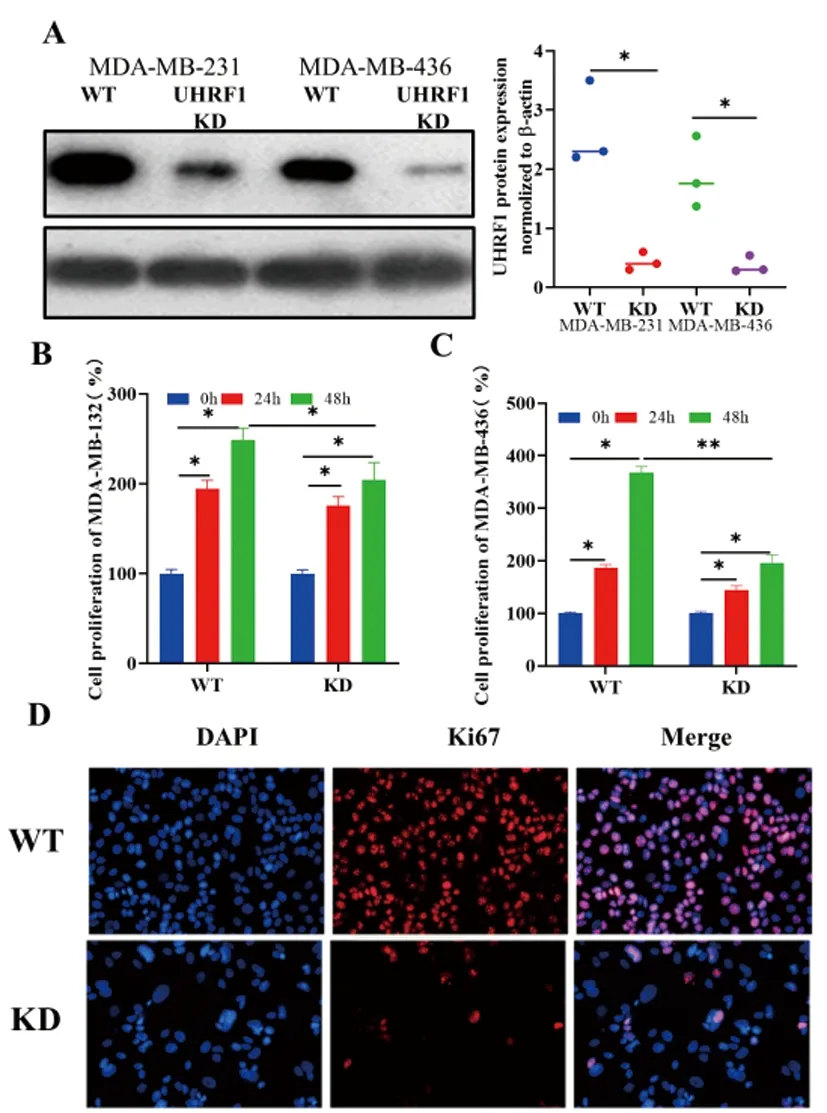
图3 下调UHRF1抑制TNBC细胞系增殖。A&B:UHRF1 WT和UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)中UHRF1蛋白表达比较;C&D:UHRF1 WT和UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)24 h和48 h增值率比较;HRF1 WT和UHRF1 KD的MDA-MB-436的48 h Ki67+细胞比较。(n=3~6)
2.4下调UHRF1对TNBC细胞系侵袭的影响:与WT相比,48 h的UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)侵袭细胞数量明显减少,差异均具有统计学意义(P<0.001),详见图4。
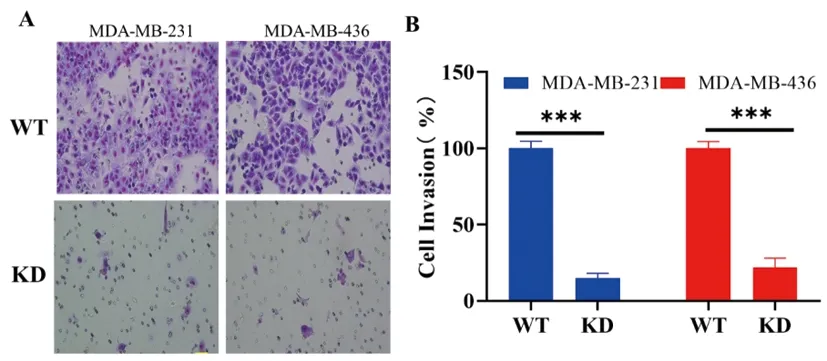
图4 下调UHRF1抑制TNBC细胞系侵袭。A&B:UHRF1 WT和UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)侵袭比例比较。(n=3~6)
2.5下调UHRF1对P53/P21信号的影响:早期研究发现,UHRF1可通过相关基因组蛋白和DNA甲基化调控细胞增殖和侵袭[9]。主要包括PPAR-γ、BRAC1、P16和FOXO4[8,10,11]。因此,本研究检测UHRF1靶蛋白的mRNA表达变化。结果表明,UHRF1 KD的TNBC细胞系 (MDA-MB-231和MDA-MB-436)的PPAR-γ、BRAC1、P53和P21 mRNA明显低于UHRF1 WT细胞,差异均具有统计学意义(P<0.05),详见图5。
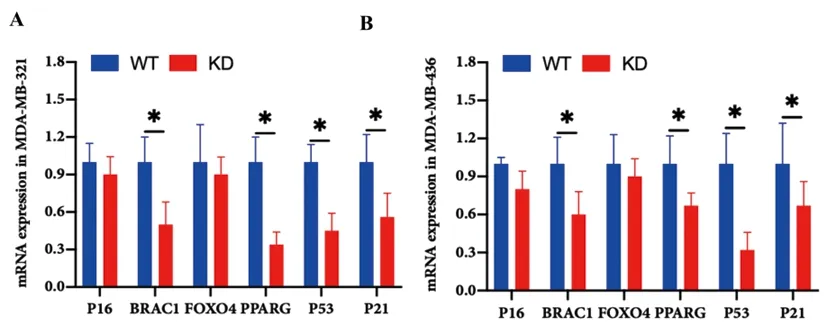
图5 下调UHRF1抑制TNBC细胞系PPAR-γ BRAC1/P53/P21信号。A&B:UHRF1 WT和UHRF1 KD的TNBC细胞系(MDA-MB-231和MDA-MB-436)P16、BRAC1、FOXO4、PPARG、P53和P21 mRNA表达比较。(n=3~6)
3 讨 论
研究发现,TNBC肿瘤细胞是一种独特的高增殖和侵袭性肿瘤细胞,且其增殖性改变与TNBC患者病情复杂、恶性度高和预后不良密切相关[12]。先前的研究表明,UHRF1在乳腺癌中升高,并且与低UHRF1水平相比,高UHRF1水平的患者预后较差。且过表达UHRF1可促进MDA-MB-231和MCF-7细胞增殖和迁移,而其下调具有相反的功能[13]。UHRF1在增殖细胞中高表达,并且不可避免地需要G1/S相变[14]。UHRF1的异常表达与多种人类恶性肿瘤的侵袭性相关,而癌细胞中UHRF1的敲低或沉默导致增殖减少和凋亡增加[12]。因而,探究UHRF1在TNBC肿瘤细胞的特殊增殖性和侵袭性中作用对解析TNBC的细胞病理机制意义重大。
本文研究结果显示, TNBC患者乳腺癌组织中UHRF1蛋白表达明显高于非TNBC患者,且在具有增殖潜能的细胞(Ki67+)中,UHRF1水平较高。这表明UHRF1在TNBC患者乳腺癌增殖的调控至关重要。同时,通过检测不同乳腺癌细胞系的UHRF1蛋白和mRNA表达发现,TNBC细胞系高表达UHRF1。这与早期MDA-MB-231和MDA-MB-438细胞UHRF1 mRNA高表达结果一致[12]。为了进一步研究高表达的UHRF1在TNBC细胞中的作用。我们建立和使用UHRF1 shRNA 慢病毒构建UHRF1 KD的TNBC细胞系。首先,我们剖析了UHRF1对TNBC细胞增殖和侵袭的影响。体外实验表明,下调UHRF1可抑制TNBC细胞系(MDA-MB-231和MDA-MB-436)增殖和侵袭。因此, UHRF1可能是逆转TNBC高侵袭转移和恶化的重要分子。据报道,过表达的UHRF1参与抑癌基因(包括p16INK4A、BRCA1、RB1、CDH13、SHP1、SOCS3和CDχ2)的表观遗传(DNA甲基化和组蛋白修饰)修饰[11,12]。UHRF1抑制癌细胞凋亡并促进肿瘤增殖。同时,UHRF1调控FOXO4和PPARG基因的甲基化修饰,继而影响前列腺癌、结直肠癌和宫颈癌细胞生长侵袭[10]。本研究证实,下调UHRF1可抑制TNBC细胞系中PPAR-γ、BRAC1、P53和P21 mRNA表达。
综上所述,UHRF1高表达与TNBC患者组织,并参与调控TNBC细胞增殖和侵袭,其作用机制与细胞PPAR-γ BRAC1/P53/P21信号密切相关。下调UHRF1可明显抑制细胞PPAR-γ BRAC1/P53/P21信号,具有抑制TNBC细胞增殖和侵袭的作用。然而,UHRF1作为细胞DNA和组蛋白甲基化的重要调控分子,其对PPAR-γ BRAC1/P53/P21信号相关基因甲基化修饰尚需进一步的直接证据。同时,下调UHRF1是否在体影响TNBC细胞增殖和侵袭,肿瘤相关免疫细胞功能尚需进一步阐明。因此其作为TNBC治疗靶点仍有待研究。

