三种术式治疗基底节区高血压性脑出血的效果对比研究
吕其铭,刘 德,唐 源,陶玉华
高血压性脑出血(HIGH)是目前发病率最高的脑血管疾病,患者脑内动静脉破损,出现脑实质自发性出血,而基底节区又是HIGH最常见的出血区域[1]。经颞叶大骨瓣手术是抢救基底节区HIGH的传统手术方式,但手术伤害性大。随着医疗水平的提高,微创血肿碎吸术、显微镜辅助小骨窗经侧裂开颅术等微创手术逐渐在临床中开展[2-3],其中微创血肿碎吸术操作简单方便、耗时短,显微镜辅助小骨窗经侧裂开颅术在传统大骨瓣开颅血肿清除术基础上进行改进,手术操作步骤更简洁,能巧妙利用脑组织与正常间隙,在非重要功能区进行手术操作,二者均能一定程度减轻手术操作损伤脑组织。现比较3种术式在基底节区HIGH中的应用效果。
1 资料与方法
1.1一般资料 选取医院2017年6月—2019年12月收治的166例基底节区HIGH患者,根据手术治疗方式的不同分为大骨瓣组(予经颞叶大骨瓣开颅血肿清除术治疗)70例、微创组(予微创血肿碎吸术治疗)46例及小骨窗组(予显微镜辅助小骨窗经侧裂开颅术治疗)50例。大骨瓣组男42例,女28例;年龄43~82(61.25±10.87)岁;高血压病史3~20(13.25±5.57)年;入院时格拉斯哥昏迷评分(GCS)6~15(11.47±3.41)分。微创组男32例,女14例;年龄46~79(62.58±11.49)岁;高血压病史4~20(12.62±6.55)年;入院时GCS评分6~15(12.22±3.54)分。小骨窗组男34例,女16例;年龄41~80(64.15±8.95)岁;高血压病史3~20(14.05±6.31)年;入院时GCS评分6~15(12.05±4.02)分。3组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2纳入及排除标准 纳入标准:有明确的高血压病史;经头颅CT示基底节区出血;出血量30~60 ml;具有不同程度的意识障碍;手术距发病时间≤24 h。排除标准:因动脉瘤、动静脉畸形破裂、脑外伤等因素导致出血者;出现脑疝、双侧瞳孔散大者;合并重要器官功能不全者。
1.3手术方法
1.3.1经颞叶大骨瓣开颅血肿清除术:患者取仰卧位并将头偏向非术侧,行气管插管静脉麻醉,然后做患侧标准大骨瓣切口,大骨瓣进颅,打开硬脑膜,采取经外侧裂-岛叶入路或经皮质入路进入血肿腔,清除暗红色血肿,采用双极电凝彻底止血,留置引流管,根据术中颅内情况决定是否去骨瓣,血肿清除完毕后逐层缝合头皮。术后根据复查结果决定是否拔除颅内引流管。
1.3.2微创血肿碎吸术:患者麻醉方法同“1.3.1”,以头部CT定位点为穿刺点,将相应长度的穿刺针尾部固定在电钻上,选择合适的进针方向,低速驱动电钻,碎吸针逐层穿过头皮、颅骨及硬脑膜后停止进针,同时卸下电钻,拧下碎吸针钻头,插入顿头针芯,缓慢推至血肿腔内,针体侧管连接引流管,抽出针芯。准备完成后从侧引流管开始抽吸血肿,抽出量为总量的30%~40%,抽吸完毕后使用等量生理盐水冲洗置换,至冲洗液清亮。
1.3.3显微镜辅助小骨窗经侧裂开颅术:患者麻醉方法同“1.3.1”,经翼点小骨窗开颅,在颞部做一4~5 cm的半弧形切口,使用颅钻钻一骨孔,再使用咬骨钳将骨孔扩大至3.0 cm×2.5 cm,十字形切开硬脑膜,显露外侧裂中后部,纤维镜下分开侧裂,达岛叶表面可见局部岛叶隆起,表面变为黄色或蓝黑色,穿刺血肿后沿穿刺道分开1~2 cm岛叶,谨慎处理血凝块与出血血管及血肿壁,使用生理盐水反复冲洗,至冲洗液清亮。血肿腔内留置引流管,头皮下妥善固定引流管,外接常压引流袋。
1.4观察指标
1.4.1血肿清除率、再出血率:依据头颅CT结果比较3组术后72 h血肿清除率、再出血率。头颅CT显示血肿最大层面计算体积,血肿清除率=(术前体积-术后体积)/术前体积×100%。
1.4.2术后并发症:观察3组术后并发症情况。
1.4.3近期预后:术后随访1个月,采用格拉斯哥预后评分(GOS)[4]评估3组近期预后。
1.4.4远期预后:术后随访6个月,采用改良Rankin量表(mRS)[5]评估3组远期预后。

2 结果
2.13组术后72 h血肿清除率及再出血率比较 3组术后72 h血肿清除率比较差异有统计学意义(P<0.01),大骨瓣组与小骨窗组血肿清除率比较差异无统计学意义(P>0.05),但均显著高于微创组(P<0.05);3组术后72 h再出血率比较差异无统计学意义(P>0.05)。见表1。

表1 基底节区高血压性脑出血3组术后72 h血肿清除率及再出血率比较
2.23组术后并发症比较 3组术后肺部感染、应激性溃疡、消化道出血及颅内感染发生率比较差异均无统计学意义(P>0.05)。见表2。
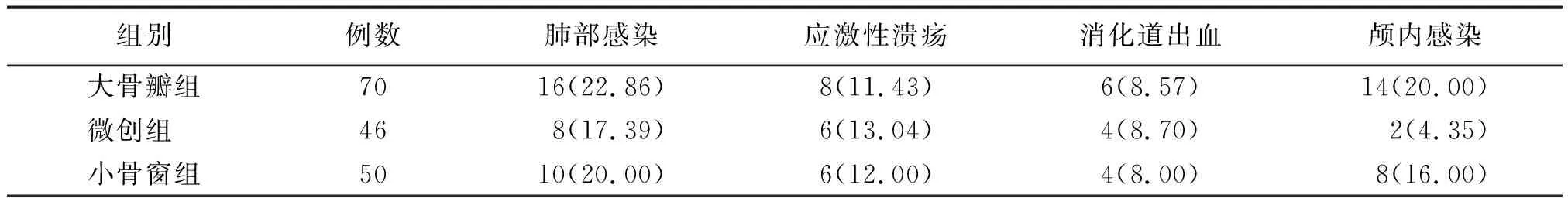
表2 基底节区高血压性脑出血3组术后并发症比较[例(%)]
2.33组近期预后比较 随访1个月,3组术后病死率比较差异无统计学意义(P>0.05);随访1个月,3组GOS评分比较差异有统计学意义(P<0.01),微创组与小骨窗组GOS评分比较差异无统计学意义(P>0.05),但均显著高于大骨瓣组(P<0.05)。见表3。

表3 基底节区高血压性脑出血3组近期预后比较
2.43组远期预后比较 随访6个月,3组术后病死率和mRS评分比较差异有统计学意义(P<0.01);大骨瓣组术后病死率和mRS评分显著高于微创组和小骨窗组,差异有统计学意义(P<0.05或P<0.01);微创组与小骨窗组术后病死率和mRS评分比较差异无统计学意义(P>0.05)。见表4。
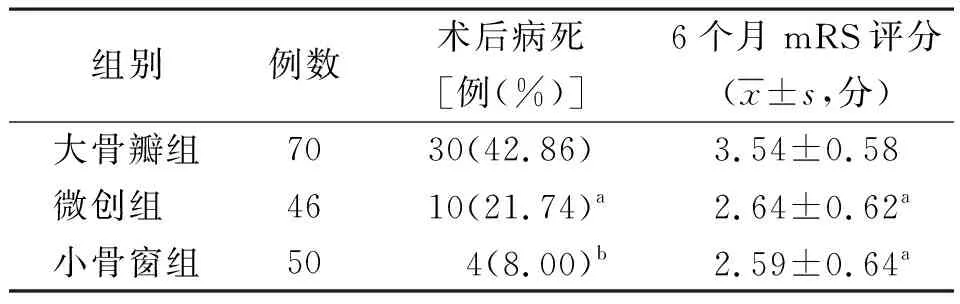
表4 基底节区高血压性脑出血3组远期预后比较
3 讨论
HIGH后形成的脑内血肿与继发性脑水肿将导致颅内高压,压迫周边脑组织,造成不同程度神经损伤,故及时降低颅内高压、清除血肿是预防本病脑疝形成、降低病死率的主要方法[6]。本研究发现,与小骨窗组及微创组相比,大骨瓣组术后1个月GOS评分最低,术后近远期病死率最高,这可能与经颞叶大骨瓣手术耗时长,术中失血量多,术中操作复杂,易损伤正常脑组织,加剧神经功能损伤,致术后脑水肿情况严重相关[7]。本研究中大骨瓣组术后6个月病死率高达42.86%,与何晓云[8]研究结果相似。微创组术后再出血率最高,高达17.39%,这与微创血肿碎吸术中盲穿、术中止血困难相关,与梁伟等[9]研究结果一致。小骨窗组术后血肿清除率高、术后并发症少、患者远期存活率高,但其术后感染率较高,与显微镜辅助小骨窗经侧裂开颅术不能实现一次性血肿清除,术中易伤及正常脑组织,诱导新的出血,且术中需持续注入纤溶药物相关[10]。本研究小骨窗组术后颅内感染率与大骨瓣组相似,与王淑丽[11]研究结果一致。
分析以上术式发现,传统经颞叶大骨瓣开颅血肿清除术视野广,能在直视下进行血肿清除操作,止血效果良好,且去骨瓣减压充分,适用于血肿较为表浅、脑内血肿量大、压迫中线明显移位或已有脑疝形成、病情较为严重者,不适用于心肺功能差、手术耐受差的中老年患者[12]。微创血肿碎吸术操作简单方便,设备简单,无须行复杂的术前准备,手术时间短,患者术后恢复快,对脑组织损伤小,术后脑水肿程度轻,各类感染发生率低,对清除位置较深、体积较小的血肿有良好效果,适用于年纪大、手术耐受较差或血肿量>30 ml的皮质及深部幕上血肿或病情稳定、意识障碍程度轻的患者[13]。而显微镜辅助小骨窗经侧裂开颅术在传统大骨瓣开颅血肿清除术基础上进行了一定改进,手术操作步骤更简洁,并利用显微镜解决微创手术不能直视的弊端,开放侧裂池后可释放部分脑脊液;此外,该术式最大的优势在于,能巧妙利用脑组织与正常间隙,在非重要功能区进行手术操作,对脑组织损伤小,还可利用显微镜准确寻找出血点及时进行止血并彻底清除血肿[14-15]。
综上,经颞叶大骨瓣开颅血肿清除术可在直视下清除血肿,实现减压目的,但其近远期预后不佳,适用于基底节区HIGH严重者;微创血肿碎吸术治疗后患者恢复快,但其不能有效减压,适用于年纪大、手术耐受较差、出血情况较轻者;显微镜辅助小骨窗经侧裂开颅术血肿清除及减压效果好,患者术后恢复快,但对操作技术要求高,且术后易出现颅内感染。建议临床应据患者具体情况选择合适术式。

