基于磁固相萃取和液相色谱-质谱联用技术的日本医蛭抗凝活性成分研究*
黄小清,汪波,肖凌,聂晶
(1.武汉大学药学院组合生物合成与新药发现教育部重点实验室,武汉 430071;2.湖北省药品监督检验研究院国家药品监督管理局中药质量控制重点实验室,武汉 430074)
日本医蛭(Hirudonipponica,H.nipponica)是医蛭科(Hirudinidae)医蛭属(Hirudo)的一种重要的传统动物药,在《神农本草经》《名医别录》等古医学著作中均有相关记载[1],也是2015版《中华人民共和国药典》(一部)收录的三大药用水蛭品种之一。传统中医认为水蛭具有逐瘀破血的功效,国外也保留着活体水蛭疗法用于治疗静脉充血的临床应用[2]。现代药理研究表明,日本医蛭相比其他两种蛭类品种具有更强的抗凝血活性[3]。水蛭素类多肽成分是实现该功效的重要药效基础[1,4],水蛭素最早提取自医蛭科欧洲医蛭(Hirudo Medicinalis)的唾液腺,也是现行唯一审批进入临床使用的最强效凝血酶抑制剂以及天然抗凝剂[1,5]。对日本医蛭转录组学的分析表明,其唾液腺组织表达水蛭素类抗凝多肽成分[6]。但在日本医蛭抗凝成分研究中,以小分子化合物类成分报道居多[7-8]。日本医蛭中生物大分子成分复杂,抗凝活性成分含量低,采用传统溶剂提取和色谱分离纯化的方法,通常需消耗数千克活体样品,并且费时费力[9-10],日本医蛭抗凝成分的蛋白序列信息缺乏,质谱鉴定困难。
磁固相萃取通过外加磁场实现成分的快速分离,毫克级别的粗提物即可完成分离纯化,具有简便、快捷、耗样量少的特点[11],此外,功能化修饰能够让磁珠具有指定的物理化学性质,因而在科学研究[11]、环境监测[12]和生物医学[13]等领域广泛应用。本研究以日本医蛭中抗凝活性大分子研究为例,合成凝血酶磁珠并应用于日本医蛭中抗凝成分的筛选,同时构建日本医蛭唾液腺蛋白序列库用于抗凝成分的质谱验证,以期为日本医蛭抗凝生物大分子分离鉴定建立一种新方法。
1 材料与方法
1.1仪器傅立叶变换红外分光光度计(Fourier transform infrared spectrometer,FT-IR,Waltham,美国),JEM-2010 FEF透射电子显微镜(transmission electron microscope,TEM),NanoPhotometer®分光光度计(IMPLEN,美国),Agilent Bioanalyzer 2100系统(Agilent Technologies,美国),自动化液相色谱-质谱联用(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析系统包括美国AB SCIEX公司TripleTOF 5600 型LC-MS/MS系统,配有电喷雾电离源以及三重四级杆飞行时间(triple quadrupole time-of-flight,TripleTOF)质量分析器,ChromXP C18色谱柱(75 μm×150 mm,3 μm,100 A,美国Eksigent公司)和Zorbax 300SB-C18捕获柱(5 mm×0.3 mm,5 μm,美国安捷伦公司)。
1.2试剂及药材原硅酸四乙酯(tetraethyl orthosilicate,TEOS,含量>99%,批号:T110596),四氧化三铁磁性纳米颗粒(Fe3O4magnetic nanoparticles,MNPs,粒径20 nm,含量>99%,批号:I109514),聚乙烯吡咯烷酮,3-缩水甘油氧基丙基三甲氧基硅烷[(3 glycidyloxypropyl)trimethoxysilane,GLYMO,含量>97%,批号:G107576)],凝血酶发色底物(S2238,HD-Phe-Pip-Arg-pNA·2HCl,批号:113711-77-6)和牛血清白蛋白(albumin from bovine serum,BSA,含量≥96%,批号:A116563)均购自上海阿拉丁试剂有限公司;硫酸铵(含量≥99.0%)、乙酸(含量≥99.8%)、乙腈(含量≥99.5%)均由上海国药集团化学试剂有限公司提供;人凝血酶(Sigma-Aldrich公司,西班牙),纤维蛋白原(中国食品药品检定研究院,批号:140626-201611),TRIzol Reagent kit(Thermo Fisher Scientific,美国,型号:15596026),RNA-seq文库构建试剂盒(New England Biolabs,美国,型号:E7530S),AMPure XP beads(核酸分选磁珠,Beckman Coulter,Inc.,批号:E7490S),核酸定量分析试剂盒(DNA HS Assay Kit,Agilent Technologies,美国,批号:50674626)。新鲜超纯水由Milli-Q仪器净化系统(Millipore,法国)制得。所用试剂均为分析级或分子级,除另有说明外,本研究所用缓冲溶液均为0.1 mol·L-1、pH值7.4的磷酸盐(phosphate-buffered saline,PBS)缓冲液。
水蛭从湖北省荆门市京山县采集并活体运回实验室,-80 ℃保存,样品经湖北省药品监督检验研究院中药检验研究中心肖凌老师鉴定为医蛭科医蛭属日本医蛭(Hirudonipponica)。
1.3凝血酶固定化磁珠制备及条件优化基于TEOS的水解反应制备二氧化硅修饰磁性纳米颗粒(SiO2-modified magnetic nanoparticle,SMNPs)[11,14],随后对方法[15]进行了适量修改合成环氧硅烷化磁性纳米颗粒(epoxy-coated magnetic nanoparticle,EMNPs)。将MNPs粉末(200 mg)超声分散在17%聚乙烯吡咯烷酮水混合液中,所得产物继续分散在异丙醇/氨/TEOS溶液(体积比18:7:1)520 mL中,连续机械搅拌15 h,即得SMNPs。取SMNPs粉末100 mg于50%乙醇50 mL中,超声30 min,加入 GLYMO 0.4 g,所得悬浮液在氮气(N2)保护下于50 ℃水浴7 h,产物真空干燥,即得EMNPs。
凝血酶通过开环反应固定于EMNPs表面,取EMNPs(10 mg)分散在含有33 U·mL-1凝血酶和1 mol·L-1硫酸铵的 PBS缓冲液1 mL中,37 ℃孵育8 h后收集磁珠,再与0.8%聚山梨酯-20/PBS液混旋1 h,即得凝血酶固定化磁珠。同时,BSA代替凝血酶进行上述固定化反应,合成BSA磁珠作为阴性对照磁珠。
分别对EMNPs与凝血酶反应比例以及PBS缓冲溶液pH值进行优化。比例优化时,分别将EMNPs2,3,6,9和12 mg与33 U·mL-1凝血酶溶液反应,所得磁珠采用酶活性检测法测定磁珠活性。凝血酶与磁珠比例为3.67 U·mg-1时,所得磁珠的单位凝血酶活性值最大。pH条件优化实验采用pH 值5,6,7,8和9的PBS缓冲液,结果显示pH值为8时的酶活性值达到最大值,见图1。
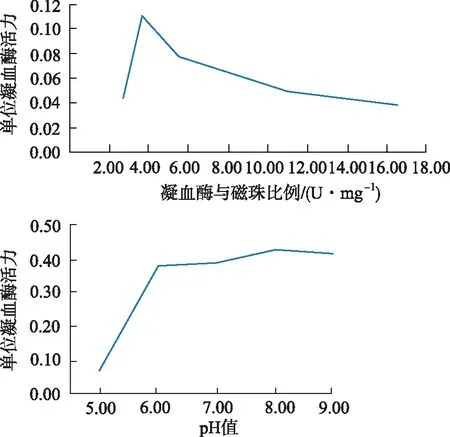
图1 凝血酶固定化过程中的条件优化

1.5水蛭唾液腺分离以及转录组文库制备取出水蛭的唾液腺组织[6],根据TRIzol Reagent试剂盒操作说明提取组织总RNA,并在NanoPhotometer和Agilent Bioanalyzer 2100系统上进行纯度和质量检查,选取RIN score >7的RNA,使用poly-T寡链磁珠制备mRNA,在评估mRNA的数量和完整性后,参考RNA文库制备试剂盒说明书构建cDNA文库,AMPure XP beads用于纯化cDNA片段,片段的大小使用DNA测定试剂盒在Agilent Bioanalyzer 2100系统上进行检测,合格cDNA片段在Illumina HiSeq 6000平台上进行双向测序,测序长度为150 bp。
1.6日本医蛭中抗凝成分筛选
1.6.1磁固相萃取及洗脱条件考察将“1.5”项下的唾液腺组织匀浆,5000×g离心10 min,上清液冻干即为L1样品。取凝血酶磁珠10 mg于 L1溶液1 mL(50 mg·mL-1,PBS缓冲液配制)中,混旋30 min,混合溶液37 ℃水浴8 h,PBS缓冲液淋洗3次,随即向磁珠中加入洗脱溶液1 mL,振荡2 min,所得洗脱上清液即为L2样品溶液。采用BSA磁珠同步上述操作,洗脱上清液即为阴性对照溶液(L3样品溶液)。
洗脱条件优化,分别用30%,50%,70%乙腈/PBS溶液或乙醇/PBS溶液作为洗脱溶液完成上述磁固相萃取过程,采用文献[17]报道的凝血酶滴定法测定洗脱液的抗凝血酶活性。
洗脱溶剂的条件优化结果表明,以30% 乙腈/PBS溶液作为洗脱溶剂时,洗脱液冻干粉具有最高的抗凝活性,为70 U·g-1。
1.6.2十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(sodiumdodecylsulfate-polyacrylamidegelelectrophoresis,SDS-PAGE)取L1样品50 mg溶于 0.1 mol·L-1PBS缓冲液(pH值7.4)1 mL,制得L1样品溶液,取优化条件下洗脱的L2、L3样品溶液,经15% SDS-PAGE凝胶100 V电泳1.5 h,考马斯亮蓝R-250染色观察。
1.6.3LC-MS/MS分析将L1、L2样品分别以预冷丙酮(4 ℃)沉淀蛋白,沉淀复溶后,依次加入二硫苏糖醇(终浓度10 mmol·L-1)、碘乙酰胺(终浓度40 mmol·L-1)完成还原以及烷基化反应,随后以胰蛋白酶与样本蛋白量1:50比例加入胰蛋白酶进行酶切,反应完成后12 000×g离心15 min,上清液脱盐浓缩即得质谱分析样品[18]。
LC-MS分析时,样品经C18捕获柱纯化后,洗脱至C18分析柱分离,流动相A:3%二甲亚砜,97%水,0.1%甲酸;流动相B:3%二甲亚砜,97%乙腈,0.1%甲酸,100 min分析梯度,流速300 nL·min-1。数据采集在Triple TOF 5600系统上进行,采用数据非依赖采集模式,MS全扫描的质荷比(m/z)范围为350~1500,离子累积时间250 ms,选取母离子信号大于120 cps的40个离子峰进行二级扫描,子离子m/z范围100~1500,离子累积时间50 ms,电荷数为+2~+5,离子重复采集的排除时间为18 s[19]。
1.7数据分析运用ProteinPilot(V4.5版)软件进行数据库检索,检索算法为Paragon,日本医蛭唾液腺蛋白序列数据库为质谱检索数据库,结果以Unused≥1.3为标准进行筛选,过滤掉蛋白反库中检索到的条目和污染蛋白,余下所有蛋白序列信息在blast2 go(https://www.blast2 go.com/blast2 go-pro/download-b2 g)上进行功能注释。
2 结果
2.1功能化磁纳米粒的表征及稳定性考察凝血酶磁珠通过3个连续步骤合成,并且所得磁珠可通过外加磁铁轻易捕获并收集,保证了磁固相萃取过程中的磁分离效果。SMNPs、EMNPs、凝血酶磁珠以及固相萃取后的凝血酶磁珠的FT-IR谱图见图2。在569.29 和1039.56 cm-1处的尖峰分别为Fe-O和Si-O键的伸缩振动峰,并且在SMNP和EMNP的3404.54 cm-1处出现了硅烷的O-H伸缩振动吸收带,在图2的4条谱线中都可观察到所述吸收峰,表明SMNP的存在。EMNPs的2921.40 和2853.17 cm-1处出现的弱峰是环氧硅烷的C-H伸缩振动造成的,上述红外吸收现象与文献[20]报道的结果相符,凝血酶中存在烷基,凝血酶磁珠在2921.40 和2853.17 cm-1两处吸收也有所增强,此外,凝血酶磁珠在1546.36 cm-1处的酰胺键特征吸收也证实凝血酶成功固定在磁珠上。

A.SiO2修饰磁性纳米颗粒;B.环氧硅烷化磁性纳米颗粒;C.凝血酶磁珠;D.萃取后的凝血酶磁珠。
运用透射电镜对EMNP、凝血酶磁珠和磁固相萃取后的凝血酶磁珠的形态和尺寸进行表征,结果见图3。形态上,3种磁珠几乎呈球形,EMNPs呈现清晰的核-壳结构,直径约为50 nm,萃取前后凝血酶磁珠直径相仿,均约为EMNPs的5倍,文献记载修饰后的磁纳米粒直径会增大[21],与实验过程以及FT-IR结果相符。

A.环氧硅烷化磁性纳米颗粒;B.凝血酶磁珠;C.萃取后的凝血酶磁珠。
良好的酶活性稳定性是固定化酶的特征和优势[20,22-24]。稳定性考察实验中,按照“1.5”项下的酶活性检测步骤,分别测定凝血酶磁珠、游离凝血酶在37 ℃、19 d间的酶活性,上述实验均平行重复3次。固定化酶和游离凝血酶酶活性稳定性见图4,10次活性检测结果中,固定化酶的酶活力值的相对标准偏差值(RSD)为4.74%,而游离酶的RSD为22.96%,表明固定化酶的酶活性稳定性更好。

图4 固定化和游离凝血酶在37 ℃、19 d内储存稳定性
2.2转录组数据分析Illumina测序后,鉴定出24 625 284个原始序列读长(raw reads),过滤含有低质量碱基数(即Q ≤ 5)超过该条序列读长(read)碱基数50%,N碱基含量超过该read碱基数10%以及含有测序接头序列或含有poly-A的测序reads,最终获得24 321 945条高质量序列读长(clean reads),使用Trinity(版本2.6.6)软件进行序列组装,将组装的转录组序列中最长的序列作为后续分析的基因序列,共产生308 343个基因序列,长度分布在201~21 552 bp,N50长度为501 bp。选取合适的核苷酸序列翻译成氨基酸序列构建水蛭唾液腺的蛋白质数据库,将现有的序列采用blastp算法比对到NCBI(https://www.ncbi.nlm.nih.gov/)的非冗余蛋白质序列库(Nr数据库)和UniProtKB/Swiss-Prot数据库中进行注释匹配,最终得到13条水蛭素变体序列。
2.3水蛭抗凝成分筛选
2.3.1SDS-PAGE以及凝血酶滴定法验证电泳结果见图5,泳道1为蛋白相对分子质量标准,L3样品的主要蛋白条带的相对分子质量为45 000,为非特异性结合到磁珠上的蛋白。与L3样品比较,L2样品含有更宽泛的蛋白相对分子质量条带,而L1样品蛋白条带多数小于15 000。多肽如水蛭素是水蛭中最强效抗凝血成分[4-5,25],因此推测L2和L1中小分子多肽为抗凝多肽。

1.蛋白质相对分子质量标准;2.阴性对照样品(L3);3.萃取后样品(L2);4.萃取前样品(L1)。
2.3.2LC-MS/MS鉴定结果样品经质谱检测比对后,共鉴定到蛋白1325种,其中L2样品中1094种,L1样品中987种,重叠蛋白数756。L1的注释率为76%,L2样本的注释率为60%。
据文献[25-26]记载,水蛭素是从吸血水蛭中分离出来的具有最强抗凝活性的天然凝血酶抑制剂,它可以直接与凝血酶的催化活性位点以及外结合域1结合。蛋白1023,1062,1230,1275和1323均为水蛭素变体(表1),在Nr或Swissprot数据库中的登录号分别为APA20860.1,ALA14574.1,Q07558.1,P81492.2和APA20860.1,这5种肽在L2样品中均能检测到,而在L1样品中均由于丰度极低而未能检测,这是由于凝血酶磁珠对凝血酶抑制剂具有特异性富集效应。

表1 匹配日本医蛭唾液腺转录组文库所得蛋白比对结果
另外也鉴定出了非凝血酶抑制剂的抗血栓生物分子如失稳酶蛋白质834和846,它可以通过解聚稳定的纤维蛋白,但不与凝血酶活性位点结合而表达血栓溶解活性[25,27],在L2以及L1样本中均能检测到相应的肽段数,这是由于磁珠的亲水性Fe3O4核心以及硅烷涂层、聚山梨酯-20的疏水烷基会增强非特异性蛋白的吸附[28-29]。
3 讨论
在本研究中,凝血酶通过三步修饰反应成功固定到磁珠,并且酶活性稳定性以及宏观磁性良好,该方法原理简单,操作简便,适用于蛋白质类以及其他含有氨基的化合物的固定化实验。维持最佳凝血酶活力的pH值约为7.4,而条件优化的最佳缓冲液pH值为8,这是由于凝血酶固定化反应过程中加入了一种强酸(H2SO4)弱碱(NH3·H2O)盐硫酸铵,它会一定程度上下调缓冲液pH值[30]。比例优化实验中,高比例EMNPs可以提供更多的环氧基团以确保与凝血酶的共价连接,但磁珠的聚集也更显著,而聚集现象会大大减少固定化酶活性位点的暴露[22],因此,本研究以单位酶活性值为优化指标,确定最佳比例。在磁固相萃取实验中,本研究以30%乙腈溶液1 mL振荡2 min,洗脱1次作为洗脱条件,测得洗脱液抗凝活性为70 U·g-1,当对磁珠再次洗脱后,所得洗脱溶液不具有抗凝活性,30%乙腈溶液1 mL洗脱一次能够满足实验需求。
水蛭原液抗凝活性为1380 U·g-1,10 mg磁珠所得洗脱液的抗凝活性为70 U·g-1,回收率约为5.1%。本实验中为了保持磁珠“垂钓”抗凝成分的作用并且降低经济成本,限制了凝血酶的固定量,因而凝血酶的固定量较少,主要起到“垂钓”抗凝成分的作用,如果需要提高富集效果,可以增加固定凝血酶的比例。考虑到日本医蛭缺乏参考基因组信息,针对大数据库进行质谱检索灵敏度低并且假阳性率高的问题[31],因而构建了日本医蛭唾液腺转录组文库并翻译为氨基酸序列数据库用于蛋白质谱鉴定,该方法专属性强,适用于特定样本的蛋白质谱研究[32-33],其中采用磁珠法进行mRNA的富集纯化,该方法具有操作简便、快速、纯化效果好的特点[34-35]。
总之,通过结合磁固相萃取,转录组文库建立以及LC-MS/MS技术,本研究建立了一种不需要复杂前处理即可从天然复杂样本中快速筛选和鉴定目标生物活性大分子的方法,可为水蛭中抗凝生物活性分子的萃取以及鉴定提供参考。

