河蟹池塘生态养殖对水环境的影响
兰艳 俞锦辰 刘怡琳 赵旭,2 储鸣 黄宏,2
(1 上海海洋大学 海洋生态与环境学院,上海 201306;2 上海海洋大学 海洋牧场工程技术研究中心,上海 201306)
中华绒螯蟹(Eriocheirsinesis)又称河蟹,是我国最重要的人工养殖蟹种之一,也是东南亚地区最受欢迎的水产品之一。20世纪90年代以来,我国的河蟹养殖业迅速发展,尤其在长江中下游地区养殖规模迅速扩大[1]。河蟹养殖业的发展为农(渔)民带来了丰厚的收入,但也带来了一些潜在的环境影响,如养殖过程中产生的有机物(残饵和粪便)、药剂(抗生素)等会对邻近水体和底层沉积物以及底栖生物群落产生影响[2-3]。目前的研究普遍认为,与鱼类养殖相比,河蟹养殖净营养输入少,氮、磷浓度较低,对环境的影响相对较小。但这些影响也是不容忽视的,因为河蟹养殖需要大量的水[4],这些养殖尾水最终会排入毗邻水域,对周边的水环境造成一定的影响。水体酸碱度和温度的改变会引起河蟹机体生理生化指标发生显著变化,进而引发一系列应激反应[5],水环境因子的改变也会导致污染物质的相互转化,因此,了解河蟹养殖各阶段水体中的主要污染物质对于科学地制定河蟹养殖各阶段管理措施尤为重要,但目前这方面的研究报道相对较少。
本试验以上海宝山区某水产养殖专业合作社河蟹养殖池塘为研究对象。该养殖合作社的河蟹养殖池塘紧邻上海市二级水源地保护区域,因此,养殖尾水排放对周边水环境的影响受到较多的关注。本试验综合河蟹的生长习性和季节气候,将养殖周期分为4个阶段,对各阶段河蟹池塘及水源的水质进行现场调查及监测,确定不同阶段的水质状况以及主要污染因子。研究结果可以提供河蟹养殖周期内水质变化基础数据,为河蟹生态养殖和尾水达标排放提供参考。
1 材料和方法
1.1 河蟹养殖
选取上海宝山区某水产养殖专业合作社的4口池塘作为试验塘,每口池塘面积在1.50~1.93 hm2不等,均为南北走向、东西并排。引水水源均为外河道水源。整个养殖周期只注水,不排水,注水次数及时间见表1。1—4月为水草(藻类)养护阶段,水草覆盖面积为池塘水面的40%左右,其中伊乐藻占1/3,苦草占2/3。

表1 河蟹养殖池塘加水次数及加水量
试验所用的河蟹苗种为养殖场自行繁育。于3月初投放蟹苗(16.53 g/只),下塘前用3%~4%的食盐水浸洗蟹苗3~5 min;4月中旬,将池塘水位加高至0.40 m,并投放螺蛳。此阶段采用“围蟹种草”模式,即用围网将河蟹与水草隔开,以防止河蟹破坏水草。6月份,将围网拆除,实行“蟹草共作”模式,每天按时清理漂于水面的水草。10月中下旬,拔除塘内全部水草,等待11月份收获河蟹,此时池塘水位保持在1.30 m。
河蟹不同生长阶段投喂的饲料种类和投喂量各不相同。8月前投喂配合颗粒饲料,初期投饲量约为河蟹总体质量的1%,随着河蟹生长,投饲量逐步增加到3%左右;8月底到11月中旬,额外增加投喂煮熟的玉米和冰鲜小杂鱼,投喂量为河蟹体质量的5%左右。养殖产量、密度和投入的饲料总量见表2。投喂时间为每天17:00左右。

表2 河蟹产量、养殖密度及投饵量
1.2 样品采集和分析
采集4口河蟹养殖池塘(T1、T2、T3和T4)以及外源引水河道(WS)的水样进行分析,分别记为池塘组和水源组。3—4月水温较低,饵料用量少,此时进行围网养殖也几乎没有其他生物扰动,养殖活动对水质影响不大,因此从5月份开始采样监测。试验把养殖周期分为3个阶段,即养殖初期(5月)、养殖中期(8月)、养殖末期(11月)。由于河蟹通常在9月份会进行最后1次蜕壳,因而增加9月份1次采样,即分别于5月、8月、9月和11月中旬采集水样进行分析,采样时间为上午9:00—11:00,使用2.50 L采水器在水面下0.50 m处采集水样,现场对水样进行固定,置于放有冰袋的保温箱避光保存。采样结束后,立即将水样带回实验室进行处理分析,测定的水质指标包括总氮(TN)、硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)、氨氮(NH4+-N)、总磷(TP)、活性磷酸盐(PO43--P)、高锰酸钾指数(CODMn)、5日生化需氧量(BOD5)、叶绿素和悬浮物等[6]。水温、pH、溶解氧(DO)采用便携式测样仪(YSI 550A)现场测定,透明度(SD)用透明度盘测定。本试验以渔业水质标准(GB 11607—1989)[7]和地表水环境质量标准(GB 3838—2002)[8]中的Ⅲ级标准为依据。
1.3 数据统计
试验采用EXCEL 2019进行数据整理,采用Origin 2017绘制图形。
2 结果和分析
2.1 水质状况及总体评价
2019年5—11月监测数据及有关水质标准见表3。养殖区水体温度变化范围为16.6~29.8 ℃,养殖期间平均水温为18.0 ℃,快速增长期平均温度高达29.5 ℃;pH在6.15~8.20,仅养殖初期超出渔业水质标准,且池塘组pH的平均值为7.08,水源组pH平均值为7.13,均呈近中性;DO为3.56~8.21 mg/L,水源组的DO随着时间的推移递增,池塘组则是前期降低,中后期逐渐升高。
水源组主要超标项目为TN,4次检测结果均超标,最大超标幅度为470.44%;TP仅8月超标,超标幅度为28.50%;池塘组主要超标项目为TN、TP和CODMn,其中TN和CODMn全程超标,最大超标幅度分别为412.00%和74.48%;TP在前3个阶段超标,最大超标幅度122.76%。从阶段时间来看,池塘组养殖初期水质最差,有7个指标不同程度超标,其中pH、CODMn、TN和TP所有池塘均超标,DO、BOD5和NH4+-N部分池塘超标;养殖中期仅有DO、CODMn和TP超标,水质最优;蜕壳期和养殖末期池塘水质介于初期和中期之间,主要是BOD5、CODMn和TN超标,蜕壳期TP也超标。
2.2 河蟹养殖池塘水质有机物污染变化情况
养殖池塘水质有机物污染变化情况见图1。由图1可见,整个试验阶段池塘组的CODMn远高于水源组,整个养殖周期内池塘组CODMn总体略有下降,变化范围为(7.57±0.10)~(10.47±0.08)mg/L,远超地表水Ⅲ级标准,超标26.23%~74.48%。其中养殖初期超标最严重,快速增长期CODMn则呈下降趋势,蜕壳期CODMn小幅升高,养殖后期又略有下降。池塘组BOD5与CODMn动态变化的趋势相反,随着养殖时间的推移,前期BOD5优于地表水Ⅲ级标准,8月份之后BOD5升高,并超出地表水Ⅲ级标准,养殖末期BOD5达到最高值7.67 mg/L。除了河蟹快速增长期,其他时期池塘水体的BOD5均远高于水源。
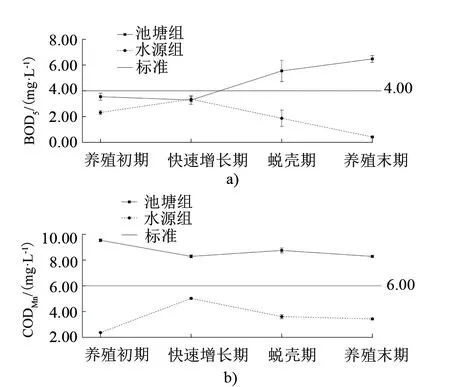
图1 水体中的CODMn和BOD5在成蟹养殖周期内的变化
2.3 河蟹养殖周期内水体氮营养盐的变化情况
养殖周期内水体氮营养盐的变化情况见表3。池塘组TN变化范围为(0.50±0.02)~(8.35±0.02)mg/L,平均为2.29 mg/L,水源组TN在(1.49±0.02)~(5.70±0.05)mg/L,平均为2.79 mg/L。除了养殖初期,其他阶段水源组TN均高于池塘组,且劣于地表水Ⅲ级标准。池塘组TN在养殖前期急剧下降,后期则略有回升。
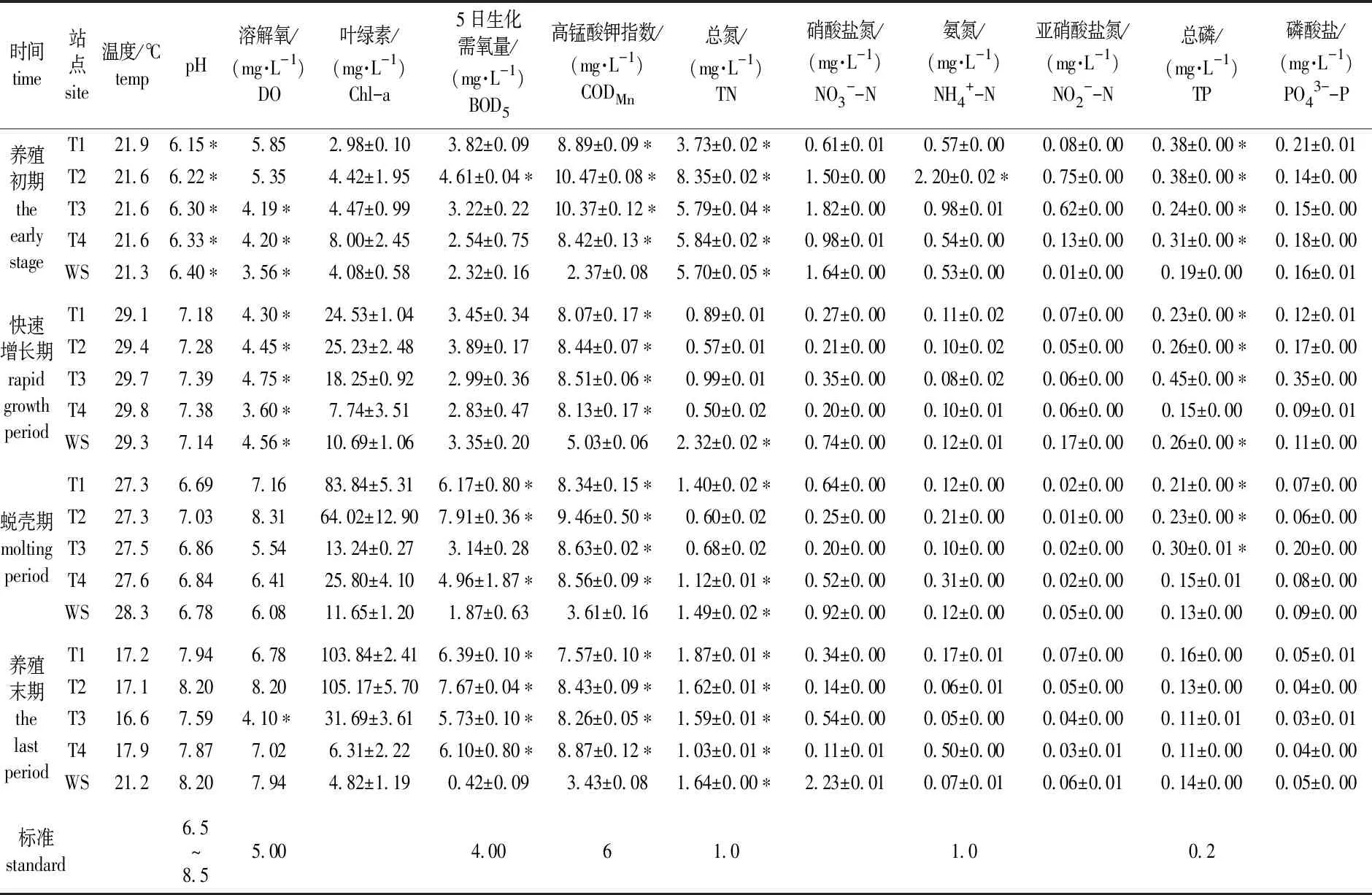
表3 水质监测数据及参考标准
无机氮在水体中的主要形态为NH4+-N、NO3--N和NO2--N,可直接被水生植物和浮游植物利用,三者的转化是水体氮循环的重要组成[9-10]。池塘组NH4+-N、NO3--N和NO2--N的变化范围分别为(0.05±0.00)~(2.20±0.02)、(0.11±0.01)~(1.82±0.00)和(0.01±0.00)~(0.75±0.00)mg/L,水源组为(0.07±0.01)~(0.53±0.00)、(0.74±0.00)~(2.23±0.01)和(0.01±0.00)~(0.17±0.00)mg/L(见图2)。
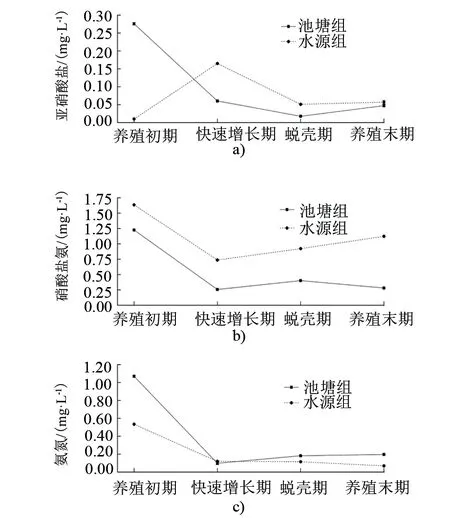
图2 水体中DIN在成蟹养殖周期内的变化
2.4 河蟹养殖周期内磷营养盐的变化情况
养殖周期内磷营养盐的变化情况见图3。池塘组TP质量浓度为(0.11±0.00)~(0.45±0.00) mg/L,平均为0.24 mg/L,养殖末期水质已优于地表水Ⅲ级标准。整个试验期间,前3个阶段池塘组TP均高于水源组,表明该养殖模式输入大量磷元素,造成P的过剩。池塘组PO43--P质量浓度在(0.03±0.01)~(0.35±0.00)mg/L,平均为0.12 mg/L,总体趋势前期略微上升,中后期则开始下降。

图3 成蟹养殖周期内水体中TP和PO43--P的变化情况
3 讨论
3.1河蟹养殖期间的水质变化
在河蟹养殖区,水草生长、养殖活动、引水水质和外界环境因素共同影响着养殖区域的水体环境。池塘组尽管输入大量外源氮、磷,但DO仍能保持较高水平,这是因为8月后增氧机的使用和水草光合作用的增强很好地保证了水体复氧效果。水源组TN在养殖期间基本高于池塘组,主要原因是该基地位于宝山区郊区,水源周边面源污染较严重。有研究表明,包括上海在内的太湖流域,其水环境质量恶化的主因之一为农田氮、磷的流失[11],农业污染物对引水水体中氮含量的变化特征影响显著。地表径流将农田中的氮、磷输送到主要干流中,导致水源组TN较高。本试验中,因养殖初期河蟹规格小,投饲量较小,N、P的输出相对较少,但此时池塘组的N、P指标却处于最高水平,这是因为5月份水温较低,水草还处于初始生长阶段,对水体中N、P的净化能力较弱。此外还可能跟上海地区淡水池塘的引水水质有关[12-13]。养殖初期到快速增长期,水草开始快速生长,且温度逐渐升高到伊乐藻适宜生长的范围(10.0~25.0 ℃),对N、P的吸收效率大大提高,因此多项水质指标大幅降低,尤其是N的相关指标,其中TN在河蟹快速增长期优于地表水Ⅲ类标准。同时,逐渐升高的pH导致NH4+转化为相对易挥发的NH3[14],这也是此时TN急剧下降的原因。此外,在8月份采样前夕,台风“利奇马”带来的持续暴雨可能也稀释了水体中的TN。但是从快速增长期开始,由于气温的影响,池塘水温逐渐升高,抑制了伊乐藻的活性,使其对NH4+-N、NO3--N和NO2--N的吸收转化能力变差,同时蜕壳期的河蟹规格较大,活动能力增强,会搅动底部沉积物,使沉淀了的颗粒态N再次悬浮到水中,也促使该阶段水体中N质量浓度的升高。此外,河蟹养殖活动中饵料的种类较多(颗粒饲料、冰鲜杂鱼和玉米),且使用肥水剂,使水体中氮、磷来源复杂化,加之不断积累的残饵、粪便和动植物尸体,均使水体中有机物含量增加,有机物分解会增加氨氮的积累[15],这可能是NH4+-N浓度出现回升的原因。
尽管生物体对于磷的需求量比氮低,但磷也是必不可少的营养元素之一。沉水植物和浮游植物能吸收利用的主要是可溶性磷酸盐,但在自然水体环境中,磷大多以不溶解化合物的形式存在,因而水体中沉水植物以及浮游植物的生长通常受到可溶性磷酸盐的限制[16]。本试验中,前期TP略微升高主要是因为投饲量的不断增加,而此阶段河蟹对饲料的转化效率仅有0.50%[17],其余均进入水体中,因此PO43--P在一定程度上有所升高;随后由于水草的吸收利用以及10月份河蟹陆续捕捞上市,投饲量和排泄物大大减少,N、P的输入也随之减少。
CODMn常被用来衡量水体有机污染程度,其值越大,表明水体有机污染越严重。低DO以及低pH均会导致CODMn升高。张运林等[18]认为,CODMn在一定程度上可以表征N、P含量,因为较高的N、P浓度促进了水体中藻类的快速繁殖,而藻类死亡后的腐烂降解会产生大量有机物,从而释放大量的内源性CODMn。本试验中,CODMn和TN、TP含量均是在养殖初期最高,超标最严重,这与上述研究结果一致。通过查阅养殖日志发现,4、5月份肥水剂使用频率较高,该阶段施肥量占整个养殖周期施肥总量的近50%,加之本次采样日期为5月13日,而采样前两天刚施过肥,导致这一时期的CODMn和TN、TP质量浓度偏高。蜕壳期CODMn小幅增加是由于河蟹生长到一定规格,投饲量增加,且河蟹的摄食行为加大了对水体的搅动,在养殖后期由于大量的河蟹被捕上市,投饲量以及河蟹数量均大大减少,因而CODMn又略有下降,并且于养殖末期出现最低值。由于残饵及河蟹粪便导致有机物积累,除了河蟹快速增长期外,其他时间段内池塘组的BOD5均远高于水源组,表明养殖活动带入了大量有机物,降低了水体自净能力,因此存在污染水体风险。
3.2 养殖管理
沉水植物作为河蟹养殖生态系统重要的组成部分,虽然无法直接吸收有机质,但可以通过其吸附作用吸附水体中的有机质。同时,它可以作为微生物载体,提供好氧和厌氧环境,形成生物膜,增加水体中的微生物量,从而加大微生物对有机物的降解速率[19-20]。有研究表明,河蟹养殖系统中水草及其附着的生物膜可以吸收60.50%~86.00%的N和37.30%~88.00%的P[17,21];文晓峰等[22]研究发现,伊乐藻对降低CODMn浓度有显著的效果,尤其是在伊乐藻种植密度为15.00 kg/m2时,CODMn的去除率可高达70.90%[23];王书扬等[24]提出,当伊乐藻的种植面积为池塘面积的60%时,水质净化效果最佳;还有研究表明,黄丝草可以提升成蟹规格,伊乐藻是净化水质、修复底质最好的沉水植物,轮叶黑藻和伊乐藻则能保证河蟹养殖产量[25]。因此,从污染控制及提高河蟹品质和产量的角度出发,可以将伊乐藻与黄丝草或者伊乐藻与轮叶黑藻搭配栽种,并将栽种面积控制在池塘水面的60%左右。

