血清TSGF及DKK-1水平对结直肠癌的诊断价值及与临床病理特征的关系
董典博,董晓燕,俞海龙
(1.聊城市人民医院 a.肛肠科;b.胃肠外科,山东 聊城252000;2.阳谷县中医院)
尽管结直肠的筛查、诊断方式不断更新,治疗方式不断改进,但由于结直肠癌早期症状不明显,有些患者一经诊断已进展到中晚期,导致5年生存率不高[1]。目前,结直肠癌的诊断指标为癌胚抗原(CEA)及糖类抗原 19-9(CA19-9)等,但其易受多种疾病因素的干扰,导致漏诊时有发生,延误治疗时机[2]。肿瘤特异性生长因子(TSGF)为肿瘤细胞生长、增殖时分泌的一类物质,对肿瘤的诊断有一定价值[3]。分泌型糖蛋白(DKK-1)为Wnt/β-catenin 信号通路的抑制蛋白,可抑制肿瘤细胞的增殖、生长和迁移[4]。本研究选取近期收治的结直肠癌患者,分析血清TSGF及DKK-1水平对结直肠癌的诊断价值及与临床病理特征的关系,报道如下。
1 资料与方法
1.1 一般资料
收集2019年1月至12月聊城市人民医院收治的结直肠癌患者85例作为观察组,其中男47例,女38例;年龄42-76岁,平均年龄(61.83±9.75)岁。纳入标准:(1)符合2017版美国国立综合癌症网络对结直肠癌的诊断标准[5],且术后病理检查确诊;(2)均为首次确诊,研究前未进行任何放化治疗;(3)临床资料完整;(4)患者自愿参与研究,并在《知情同意书》上签字。排除标准:(1)合并其他恶性肿瘤者;(2)合并心、肝、肾等重要器官功能严重不全者;(3)血液系统疾病或免疫功能缺陷者。另收集同期在医院进行体检的健康人群85例作为对照组,其中男45例,女40例,年龄40-77岁,平均年龄(61.31±9.24)岁。观察组和对照组一般资料比较差异无统计学意义(P>0.05),具可比性。本研究经医院伦理委员会的批准。
1.2 方法
1.2.1血清标本采集 收集所有对象清晨空腹静脉血40 ml,置入抗凝试管中,离心机2 000 r/min离心10 min,取上清液于-20℃的冰箱中待检。
1.2.2TSGF、DKK-1水平检测 TSGF、DKK-1分别采用比色法和酶联免疫吸附法检测,相关试剂盒均由美国R&D公司提供,AU480全自动生化分析仪由贝克曼公司提供,722 型分光光度计由上海菁华公司提供。
1.3 统计学处理

2 结果
2.1 两组血清TSGF、DKK-1水平比较
观察组血清TSGF、DKK-1水平高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组血清TSGF、DKK-1水平比较
2.2 血清TSGF及DKK-1水平与临床病理特征的关系
血清TSGF与浸润深度、淋巴结转移和肝转移有关(P<0.05),DKK-1与浸润深度和肝转移有关(P<0.05)。见表2。

表2 血清TSGF及DKK-1水平与临床病理特征的关系
2.3 血清TSGF、DKK-1的关系分析
血清TSGF与DKK-1呈正相关(r=0.661,P<0.05)。见图1。

图1 血清TSGF、DKK-1的关系
2.4 血清TSGF、DKK-1诊断结直肠癌的ROC曲线分析
ROC曲线分析显示,TSGF、DKK-1诊断结直肠癌的AUC分别为0.856、0.959,将TSGF、DKK1纳入Logistic回归分析,拟合两项联合=TSGF+(0.299/0.055)*DKK1,且两项联合诊断结直肠癌的AUC为0.967,诊断结直肠癌准确性高;Z检验比较AUC差异显示,DKK-1、两项联合的AUC显著高于TSGF(Z=3.144、3.546,P<0.05),DKK-1与两项联合的AUC比较,差异不显著(Z=0.363,P=0.717>0.05);根据最佳临界值,当TSGF高于59(U/ml)时,其敏感度为75.3%,特异度为83.5%;当DKK-1高于27.97(pg/ml)时,其敏感度为90.6%,特异度为85.8%;当两项联合数值高于227.00时,其敏感度为97.6%,特异度为81.2%。见表3、图2。

图2 TSGF、DKK-1诊断结直肠癌的ROC曲线
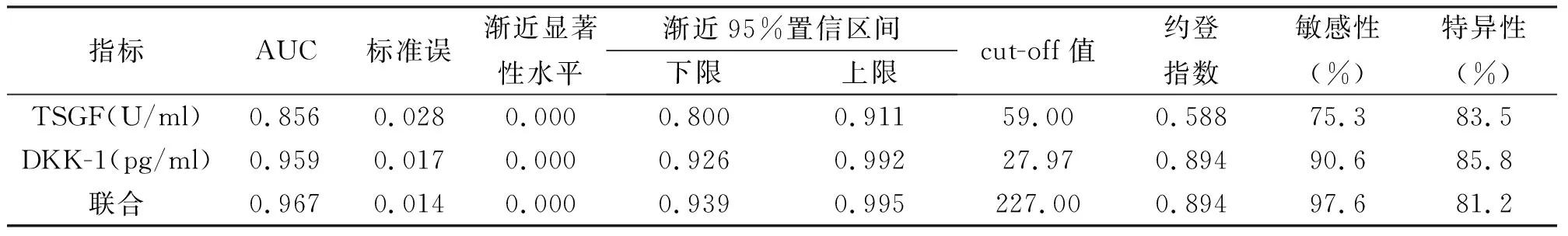
表3 血清TSGF、DKK-1诊断结直肠癌的ROC曲线分析
3 讨论
结直肠癌是一种发病率和死亡率均较高的消化道恶性肿瘤,近年来在我国的发病率逐渐上升,而早期诊断、早期外科手术治疗可显著改善结直肠癌预后,提高5年生存率[6]。
TSGF为国际公认的恶性肿瘤相关物质,在肿瘤发生早期,其他肿瘤标志物还未明显升高时,即可释放进入血液。多项报道已证实其在肺癌、肝癌、结直肠癌等多种恶性肿瘤中高表达[7,8]。本研究中,观察组血清TSGF水平显著高于对照组,且其水平与浸润深度、淋巴结转移和肝转移有关,提示TSGF在结直肠癌中呈高表达,并且参与肿瘤的发生、浸润和转移。其原因可能为:当发生恶性肿瘤时,多种与恶性肿瘤形成和生长有关的TSGF水平升高,并促进恶性肿瘤血管及周边毛细血管化,导致TSGF随血管进入血液循环,从而血清TSGF水平升高;并且恶性肿瘤血管和周边毛细血管不断生成,可逐渐突破黏膜层,并沿着淋巴管道和血管通路进行转移,从而导致侵及浆膜层、淋巴结转移和肝转移者较未及浆膜层、无淋巴结转移和肝转移者TSGF水平高。
DKK-1是由滑膜成纤维细胞释放的糖蛋白,可通过抑制Wnt/β-catenin 信号通路来抑制肿瘤基因的表达,诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖和迁移[9]。Wnt信号通路是低等到高等生物中普遍存在的一条信号通路,与细胞的增殖、分化关系密切。而DKK-1不仅可与Wnt受体复合体LRP5/6结合来抑制Wnt信号通路,而且可与Kremen存在时,与LRP的结合形成Dkkl-LRP-Kremen,发挥内吞作用,清除膜表面Wnt受体复合体LRP6,抑制经典Wnt信号通路。不同类型肿瘤中DKK-1表达水平存在差异,例如DKK-1在原发性肝癌、乳腺癌等恶性肿瘤中呈高表达[10-11],但在黑色素瘤、胃癌中呈低表达[12-13]。同一种类型的肿瘤,DKK-1表达也可能不同,例如本研究中的结直肠癌,有些报道[14]显示血清中DKK-1呈高表达,而有些报道[15]则显示DKK-1呈低表达。本研究显示,观察组血清DKK-1水平显著高于对照组,且与组织类型、浸润深度和肝转移有关,提示DKK-1在结直肠癌中呈高表达,并且参与肿瘤的进展、浸润和转移。其原因可能为:随着结直肠癌细胞增殖,为抑制这种异常增殖,机体采取方式之一便是抑制Wnt/β-catenin 信号通路,而DKK-1为重要的Wnt/β-catenin 信号通路抑制剂,从而出现高表达,发挥负反馈调节作用,进而在侵及浆膜层、肝转移中呈高表达。
本研究分析血清TSGF、DKK-1的关系发现,TSGF与DKK-1呈正相关,可能是高水平TSGF可促进肿瘤血管生成,加速肿瘤进展,DKK-1负反馈调节激活,水平随之升高。有报道[14,16]TSGF、DKK-1在结直肠癌呈异常表达,可作为辅助诊断指标。本研究采用ROC曲线分析血清TSGF、DKK-1对结直肠癌的诊断价值发现,TSGF、DKK-1诊断结直肠癌的AUC分别为0.856、0.959,两项联合诊断结直肠癌的AUC为0.967,诊断结直肠癌准确性高;并且当TSGF高于59(U/mL)时,其敏感度为75.3%,特异度为83.5%;当DKK-1高于27.97(pg/ml)时,其敏感度为90.6%,特异度为85.8%;当两项联合数值高于227.00时,其敏感度为97.6%,特异度为81.2%。因此提示血清TSGF、DKK-1可能成为结直肠癌的肿瘤细胞标志物,且两者联合可提高对结直肠癌的诊断价值。
综上所述,结直肠癌血清TSGF、DKK-1水平升高,且血清TSGF与浸润深度、淋巴结转移和肝转移有关,DKK-1与浸润深度和肝转移有关,可作为判断结直肠癌病理特征的参考指标;此外血清TSGF、DKK-1对结直肠癌的诊断价值较高,两者联合可进一步提高诊断价值。但本研究也有一定不足之处:例如纳入样本量较小,且未分析血清TSGF、DKK-1对结直肠癌病理特征、治疗效果和预后的影响,以后可增加样本量、延长随访周期进一步探究。

