β-葡聚糖对亚东鲑幼鱼生长、肠道消化酶活性及肝脏抗氧化能力的影响
王万良,周建设,陈美群,王金林,曾本和,王且鲁,扎西拉姆
(西藏自治区农牧科学院水产科学研究所,西藏 拉萨 850000)
【研究意义】β-葡聚糖是一种具有生物活性的功能性低聚多糖,其分子式为(C6H10O5)n,广泛存在于谷物和微生物中,由均一的D-吡喃葡萄糖单位通过β-1,3和 β-1,4键连接成,基于不同糖苷键的比例可分为水溶性和非水溶性2种[1]。近些年,国家加快水产养殖业改革创新和补齐发展短板,推动水产养殖业转型升级和绿色高质量发展,倡导绿色安全水产品,逐步减少抗生素使用已成为必然趋势。许多研究表明,β-葡聚糖具有保健功效,被广泛应用于食品和饲料添加剂中,能够促进动物机体生长、提高免疫能力、增强抗感染等,特别在水产经济动物养殖过程中,能够明显提高成活率,显著影响部分鱼虾的生长性能和生理功能[2-3]。亚东鲑(Salmontrutta)隶属于鲑形目(Salmoniformes)、鲑科(Salmonidae)、鲑属(Salmon),与褐鳟系同物异名,由英国人从20世纪90年代引进到亚东县,距今有150年历史,已成为一个地方性品种,因其肉质细嫩,营养丰富而深受消费者喜爱[4]。【前人研究进展】目前,国内外学者主要开展了亚东鲑资源概况、个体繁殖力、早期发育、肌肉营养评价及分子生物学等相关研究[5],有关β-葡聚糖对亚东鲑幼鱼生长、肠道消化酶活性及肝脏抗氧化能力的影响,还未见报道。【本研究切入点】基于亚东鲑引进时间相对较长,长期近亲繁殖导致种质资源退化现象十分突出,通过开展β-葡聚糖对其生长及生理功能等方面相关研究。【拟解决的关键问题】本研究为西藏地区开展亚东鲑规模化养殖和产业化发展提供理论依据和参考。
1 材料与方法
1.1 试验条件与材料
试验材料来自西藏雅鲁藏布江鱼类资源繁育基地培育的亚东鲑幼鱼,随机挑选体格健壮、规格相对整齐、游泳活泼、摄食良好,共计1050尾,体质量为0.89~1.26 g,平均体质量为(1.07±0.3) g。在圆形玻璃缸(100 cm×100 cm×60 cm)中进行,采用循环水系统设备,控制水深约为40 cm,溶氧为6.5~8.0 mg/L,水温为13~14 ℃,pH 7.51~8.10。
1.2 试验设计
试验共设计7组,参照王常安等预先配置基础饲料[6](表1),依次添加β-葡聚糖含量分别为0、0.1 %、0.2 %、0.5 %、1.0 %、1.5 %、2.0 %,每组再设2个平行,每个平行放养50尾亚东鲑幼鱼,试验总持续时间为60 d。

表1 试验幼鱼基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) (%)
1.3 日常管理
每天查看设备运转及试验用鱼活动情况至少5次,早中晚各1次,夜间2次,定时测定水温、溶氧、做好相关记录;每天清理排泄物1次,每10 d用食盐消毒1次。投喂人工配置基础饲料,粗蛋白含量为45 %,在早上10∶00投喂1次,饱食后用塑料小抄网捞掉残饵,烘干后根据初始投喂计算实际投喂量。
1.4 样品采集
养殖试验结束后,每个圆形玻璃缸中随机捞取10尾幼鱼,测量体质量、迅速解剖分离肠道和肝脏,依次编号并暂放于附有冰袋的泡沫箱中,采集结束后全部放入-80 ℃冰箱中保存。
1.5 指标测定
1.5.1 生长指标 用棉布干毛巾快速拭去试验材料体表水分,体长、体质量等形态学指标分别精确至0.01 cm、0.01 g。其中,C为存活率,N0为每组存活尾数,N为每组试验鱼总尾数;HIS为肝体指数,CF为肥满度,AWGR为平均体质量增长率,SGR为特定生长率;W、W1、W2、Wg、Wk、t分别代表试验幼鱼的体质量、t1时体质量、t2时体质量、肝质量、空壳质量、开始体长、结束体长、恢复生长天数和摄入饲料量。
相关计算公式[9]:C(%) =N0/N;HIS(%) =100×Wg/Wk;CF(%) =100×W/L23;BWGR(%) =100×(W2-W1)/W1;SGR(%) =100×(lnW2-lnW1)/(t2-t1)。
1.5.2 肠道消化酶活性 将肠道解冻后用剪刀纵向剪开,用小刀片刮下食糜及黏膜,按照质量体积比1∶9加入样本均浆介质,在冰浴条件下机械匀浆,2500 r·min-1离心10 min,取上清液测定。胰蛋白酶、脂肪酶和淀粉酶活性均采用南京建成生物工程有限公司试剂盒测定,具体操作步骤详见试剂盒说明书。
1.6 肝脏抗氧化指标
将肝脏解冻后,准确称量质量,按照质量体积比1︰9加入0.86 % NaCl溶液在冰浴条件下进行机械均浆,3000 r·min-1离心10 min,取上清液测定。控制测定过程24 h内完成。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)和谷胱甘肽(GSH)含量均采用南京建成生物工程有限公司测定,具体操作步骤详见试剂盒说明书。
1.7 数据处理
采集数据用Excel和Spass13.0软件进行相关分析。
2 结果与分析
2.1 不同含量β-葡聚糖对亚东鲑幼鱼存活及生长的影响
由表2可知,整个试验过程中,不同含量β-葡聚糖对亚东鲑幼鱼存活率差异不显著(P>0.05),均为100 %;0.5 %试验组体质量增加最高,显著高于其他各组(P<0.05),0.1 %、0.2 %和1.0 % 试验组之间差异不显著(P>0.05),0试验组(对照组)增长最低;平均质量增长率0试验组增长最慢,与2.0 %试验组差异不显著(P>0.05),显著低于其他各组(P<0.05),0.5 %试验组平均质量增长率最大,显著高于其他各组(P<0.05)。1.0 %试验组体长最大,与0.1 %、0.2 %、0.5 % 和1.5 % 试验组之间差异不显著(P>0.05),显著高于其他各组(P<0.05)。特定生长率依次呈现先增大后减小的变化趋势,0试验组最小,显著低于其他各组(P<0.05);0.5 %试验组最大,显著高于其他各组(P<0.05)。肝体指数依次递减,0试验组最大,与0.1 %、0.2 %和0.5 %试验组之间差异不显著(P>0.05),但显著高于其他各组(P<0.05)。肥满度0.1 %、0.2 %、0.5 %和1.0 %试验组之间差异不显著(P>0.05),显著高于其他各组(P<0.05),0试验组最小。
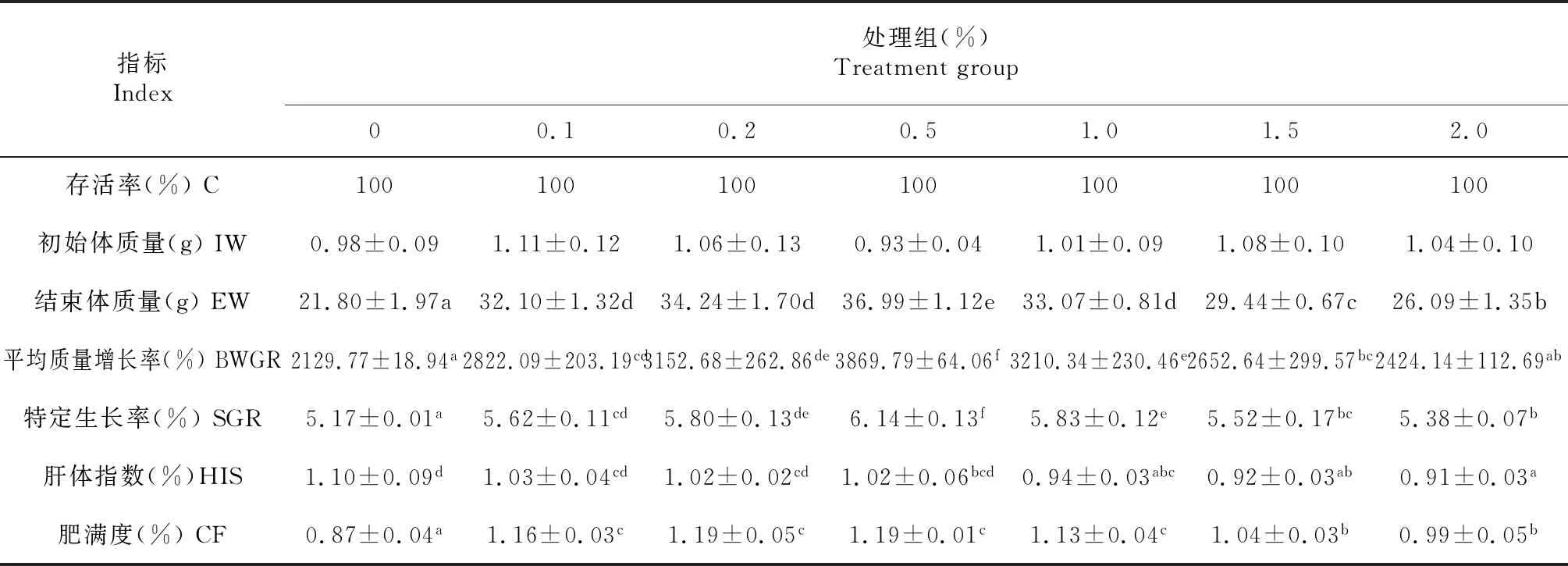
表2 β-葡聚糖对亚东鲑幼鱼存活和生长的影响Table 2 Effect of β-glucan on the survival and growth of young Salmon trutta
2.2 不同含量β-葡聚糖对亚东鲑幼鱼肠道消化酶的影响
由图1~3可知,亚东鲑幼鱼肠道胰蛋白酶活性、脂肪酶活性、淀粉酶活性均呈现先递增后降低的变化趋势。其中胰蛋白酶活性0.5 % 试验组最大,与0.2 % 试验组差异不显著,显著高于其他各组,0试验组最小,与1.5 % 和2.0 %试验组差异不显著,显著低于其他各组。脂肪酶活性0试验组最低,显著低于其他各组;0.5 % 试验组最大,与0.2 %、1.0 %试验组差异不显著,显著高于其他各组。淀粉酶活性2.0 % 试验组最小,显著低于其他各组;0试验组与1.5 %试验组之间差异不显著,显著低于0.2 %、0.5 % 和1.0 % 试验组。
2.3 不同含量β-葡聚糖对亚东鲑幼鱼肝脏抗氧化性的影响
由表3可知,饲料中添加不同含量β-葡聚糖,对GSH含量及GSH-Px和SOD均具有显著性影响,而对MDA、CAT活性差异不显著。其中MDA含量依次呈现递减变化,0试验组最大,各试验组之间差异不显著;CAT活性各试验组之间差异不显著;GSH含量0.5 %试验组最大,与0.1 % 和0.2 % 试验组差异不显著,显著高于其他各组;GSH-Px活性0.5 %试验组最高,显著高于其他各组,0试验组最低;SOD活性0试验组最低,与0.1 %、1.5 %和2.0 %试验组之间差异不显著,显著低于其他各组,1.0 %试验组最高,显著高于其他各组。

表3 β-葡聚糖对亚东鲑幼鱼肝脏抗氧化能力的影响Table 3 Effects of dietary β-glucan levels on hepatic antioxidant function of juvenile Salmon trutta
3 讨 论
3.1 饲料添加不同含量β-葡聚糖对亚东鲑幼鱼存活与生长影响
目前研究表明,在饲料中添加适量β-葡聚糖水平,能够明显提高水产动物水产动物养殖成活率,且表现出促进生长作用。本次试验结果表明,β-葡聚糖对亚东幼鱼存活率无差异,与许国焕等[7]试验β-葡聚糖对彭泽鲫(Carassiusauratus)存活率结果一致,可能原因本次试验每10 d进行1次消毒,减少病害发生,从而提高其存活率。
在配合饲料中添加0.1 %、0.15 %、0.20 %、0.25 %不同比例的β-葡聚糖,对锦鲤(Cyprinuscarpiovar)促生长作用越来越明显[8];同样β-葡聚糖对齐口裂腹鱼(Schizothoraxprenanti)[9]和罗非鱼(Oreochromsmossambcus)[3]均具有改善其生长性能。本次试验结果表明,添加不同含量的β-葡聚糖,均对亚东鲑幼鱼有促生长作用,这与上述研究结果一致,但添加量在0.5 %时,生长速度最快,以此推测β-葡聚糖对亚东鲑幼鱼生长性能的影响亦可能与添加剂量相关。但也有一些报道表明β-葡聚糖对水产动物无促生长作用,如王永宏等[10]采用连续投喂和间接投喂2种方式,β-葡聚糖均能够显著提高暗纹东方鲀幼鱼(Takifuguobscurus)成活率,但对其生长没有影响;还有一些学者报道β-葡聚糖对虹鳟(Oncorhynchusmykiss)和南美白对虾(Penaeusvannamei)的促生长作用不明显[11-12];可能原因是β-葡聚糖会引起动物机体长时间处于免疫激活状态,造成营养物质重分配进而对其生长性能造成了影响[13]。肝体指数和肥满度是反映鱼类生长过程中形体指标的参数。本试验研究结果表明,随着β-葡聚糖含量的增加,肝体指数依次减小,而肥满度呈先增大后减小的趋势,这与李永娟等试验β-葡聚糖对黄颡鱼(Pelteobagrusfulvidraco)生长性能肝体指数和肥满度变化相一致[14],可能原因是β-葡聚糖可以提高亚东鲑幼鱼消化酶活性,促进蛋白质转化效率,增加营养物质在机体沉积,从而降低肝体指数。在本试验中,随着β-葡聚糖含量增加,特定增长率呈先递增后减小的趋势,这与谭志彪使用β-葡聚糖对奥尼罗非鱼研究结果相一致[15],可能原因是亚东鲑幼鱼吸收β-葡聚糖之后可以提供能量,从而起到节约蛋白质用于促进生长。
3.2 饲料添加不同含量β-葡聚糖对亚东鲑幼鱼肠道消化酶活性影响
鱼类的消化系统主要由口咽腔、肝脏、食道和肠等部分组成,相应器官的消化腺通过分泌消化酶,将食物分解成可以被吸收利用的小分子物质,从而维持鱼体生命、生长及繁殖等所需的能量和营养[16]。肠道是鱼类消化系统中最长的区段,也是最重要的消化器官,其肠粘膜杯状细胞能够分泌粘液和消化酶,具有润滑和消化的功能[17-18]。谭志彪[15]试验结果表明,饲料中添加一定含量β-葡聚糖对奥尼罗非鱼肠道蛋白酶、脂肪酶和淀粉酶均有显著性提高,且1.0 % 添加组效果最好;在本试验中,随着β-葡聚糖添加不断增加,亚东鲑幼鱼肠道胰蛋白酶活性、脂肪酶活性、淀粉酶活性均呈现先递增后降低的变化趋势,这与上述研究结果相一致,说明饲料中添加适量β-葡聚糖可以提高亚东鲑幼鱼肠道消化酶活性,从而增强其消化能力。
3.3 饲料添加不同含量β-葡聚糖对亚东鲑幼鱼肝脏抗氧化能力的影响
肝脏在鱼类整个新陈代谢过程中扮演着极其重要角色,是最大的消化腺,主要负责鱼体消化吸收、物质代谢、解毒和防御功能[19]。一般而言,机体细胞在维持正常生命过程中均产生氧化自由基,MDA具有很强的生物毒性,如果过量将对细胞氧化造成损伤,SOD、GSH-Px和CAT是鱼体主要的酶促抗氧化防御系统,SOD可以将O2-·转变为H2O2,在GSH参与下,GSH-Px催化H2O2分解,从而清除自由基,达到保护机体的目的[20]。钱妤等[21]开展了生物素对团头鲂幼鱼肝脏抗氧化能力的试验,结果显示随着生物素含量增加,GSH含量和GSH-Px、SOD活性变化呈先递增后降低的趋势,说明添加适宜生物素能够提升团头鲂抗氧化能力。本试验结果表明,随着β-葡聚糖不断增加,亚东鲑幼鱼肝脏MDA含量变化依次降低,和CAT活性一样各试验组之间差异不显著,而GSH含量和GSH-Px、SOD活性呈先递增后降低的变化趋势,与上述研究结果相类似,说明基础饲料中添加适量β-葡聚糖能够提升亚东鲑幼鱼抗氧化能力。
——谷物β-葡聚糖的最新研究进展

