基于转录组测序番茄抗南方根结线虫相关基因的挖掘
陆秀红,黄金玲,李红芳,周 焰,刘志明
(广西农业科学院植物保护研究所/广西作物病虫害生物学重点实验室,广西 南宁 530007)
【研究意义】根结线虫(Meloidogynespp.)可寄生于多种作物根系[1],引起的番茄(Lycopersiconesculentum)根结线虫病是番茄的重要病害之一,一般使番茄减产10 %~20 %,严重的地块减产75 %以上[2]。生产上采用轮作和杀线剂等方法进行根结线虫病防治虽取得一定的防治效果,但种植抗病品种才是防治该病最经济有效和安全的方法。目前生产上使用的番茄栽培品种多为感病品种,少数抗病品种存在遗传基础狭窄及抗性单一等问题。挖掘新抗源及植物天然抗病基因,获得具有抗根结线虫病特性的转基因番茄植株是一条有效的番茄育种途径[3]。目前,番茄抗根结线虫分子育种研究已取得一定进展,但应用最广的抗病基因Mi-1存在热不稳定性和自然界中存在Mi-1抗性小种等局限,限制了其广泛应用[4]。因此,挖掘番茄与南方根结线虫(Meloidogyneincognita)侵染响应相关的关键抗性基因,对番茄抗性基因克隆及番茄抗病分子育种具有重要意义。【前人的研究进展】国外育种专家早在20世纪40年代就开始番茄抗根结线虫基因挖掘工作[5-6],迄今已发现10个抗性基因(Mi-1、Mi-2、Mi-3、Mi-4、Mi-5、Mi-6、Mi-7、Mi-8、Mi-9和Mi-HT),这些基因均来源于野生番茄材料,其中从秘鲁番茄(Solanumperuvianum)中克隆的Mi-1基因是目前番茄中唯一可利用且很有效的根结线虫抗性基因,将其导入栽培番茄获得了具有较强抗病性的转基因番茄[7]。1998年,Milligan等[8]采用同位克隆方法首次克隆Mi-1基因,该基因编码1257个氨基酸残基,属于NBS-LRR类抗性基因家族,其蛋白产物可能通过识别某些线虫产物在线虫侵染区域诱导发生过敏性反应而抑制线虫取食。Kaloshian等[9]采用重组鉴定技术成功将Mi-1基因定位于番茄6号染色体短臂上的一段小区域。Kiewnick等[10]、Brito等[11]研究认为,Mi-1基因表现对温度敏感,当土壤温度超过28 ℃时对根结线虫失去抗性;Mi-1基因能有效抵抗南方根结线虫、爪哇根结线虫(M.javanica)和花生根结线虫(M.arenaria)3种常见根结线虫,但不抗北方根结线虫(M.hapla)和象耳豆根结线虫(M.enterolobii),因此影响其广泛应用。转录组是指特定组织或细胞在某一功能状态下转录出所有RNA的总和,转录组研究是一个发掘新功能基因的重要途径[12-13]。李海燕等[14]对大豆胞囊线虫(Heteroderaglycines)侵染前后的抗病大豆品种进行转录组分析,筛选获得1045个差异表达基因,其中参与苯丙胺类代谢相关的基因在接种线虫后除1个基因下调外其余Unigenes均不同程度上调表达,而苯丙烷类代谢是植物抗病反应中重要的代谢途径之一,可形成植保素、木质素和酚类化合物等次生代谢物。Das等[15]对南方根结线虫诱导豇豆产生的取食位点进行转录组分析,发现活性氧(ROS)浓度的差异及毒素的诱导等在豇豆对南方根结线虫的抗性机制中发挥重要作用。【本研究切入点】本文第1作者前期研究发现,来源于广西的野生番茄材料F5高抗南方根结线虫[16],但目前对其抗病基因及抗性机制的研究鲜见报道。【拟解决的关键问题】检测南方根结线虫侵染和未侵染番茄抗性材料F5样本的转录组,筛选番茄抗线虫侵染相关基因,为其克隆及番茄抗病育种提供理论依据。
1 材料与方法
1.1 试验材料
番茄抗南方根结线虫材料F5为第1作者在广西柳州市郊区采集的野生番茄材料,经抗性鉴定属于高抗材料[14]。供试南方根结线虫采自广西南宁市郊区蔬菜大棚,经单卵块纯化后接种于广西农业科学院网室内番茄苗上繁殖备用。试验时在解剖镜下挑取南方根结线虫卵囊,于25 ℃恒温箱中孵化为二龄幼虫。
1.2 线虫接种与样本采集
将番茄材料播种于育苗盆中,置于温室内(平均气温25.63 ℃,平均相对湿度49.36 %,平均光照强度9930.00 lx)培养,待苗长至4片真叶时移栽于装有无根结线虫土壤的花盆(直径20 cm,高12 cm)中,每盆种植3株,重复4次,共12株。移栽后10 d接种南方根结线虫二龄幼虫,每盆接种含有1500头二龄幼虫的线虫液。对照接种等量清水。接种24 h后分别取番茄植株根尖组织3 cm约500 mg,液氮冷冻后,置于-80 ℃冰箱保存备用。
1.3 RNA提取与检测
对照组(LE-root)和试验组(LE-rootm)番茄根尖组织总RNA由北京诺禾致源科技股份有限公司提取,以Nanodrop分光光度计检测RNA纯度,采用Agilent 2100核酸分析仪对提取的总RNA进行质量检测。
1.4 文库构建及测序
对检测合格的总RNA用带有Oligo(dT)的磁珠进行mRNA富集,然后加入Fragmentation Buffer将mRNA打断成短片段,以mRNA为模板合成一链cDNA,然后加入缓冲液、dNTPs和DNA Polymerase Ⅰ合成二链cDNA,随后对双链cDNA进行纯化、末端修复、加尾并连接测序接头,最后进行片段大小选择和PCR富集获取cDNA文库。文库检测合格后进行Illumina HiSeqTM4000。
1.5 测序数据处理与分析
测序得到的原始图像数据文件经CASAVA碱基识别(Base calling)分析转化为原始测序序列(Original sequence)。对原始数据(Raw reads)进行过滤,去除带接头和N比率大于10 %及低质量的Reads,得到高质量序列(Clean reads)。将Clean reads与番茄参考基因组数据库(https://solgenomics.net/organism/Solanum_lycopersi-coides/genome)进行比对后进行分类注释和分布情况统计。
1.6 差异表达基因筛选
对测序得到的原始Reads进行评估,经TMM标准化处理后,获得对照组(LE-root)和试验组(LE-rootm)的基因表达量。根据模型进行假设检测概率计算,最后进行多重假设检验校正得到PDR值,并以|log2(Fold change)|>1和q-value<0.005为标准对差异表基因进行筛选。
1.7 差异表达基因本位数据库(GO)和Pathway显著性富集(KEGG)分析
基于GO,分别从分子功能(Molecular function)、生物过程(Biological process)和细胞组成(Cellular component)3个部分对差异表达基因进行GO注释;以KEGG数据库中的Pathway为单位,应用超几何检验,找出与整个基因组背景相比在差异表达基因中显著性富集的Pathway,采用Fisher进行精确检验,通过Bonferroni校正法进行校正,得到差异基因显著富集的GO功能类和代谢通路,从中筛选显著差异表达基因进行重点分析。
2 结果与分析
2.1 番茄根尖组织总RNA的检测结果
经检测,所提取对照组(LE-root)和试验组(LE-rootm)番茄根尖组织样本的总RNA浓度分别为896和1021 ng/μl,RNA质量完整性指标(RIN)分别为8.1和8.5,说明番茄根尖组织样本的总RNA浓度及质量均满足测序要求。
2.2 HiSeq测序数据分析结果
对照组(LE-root)和试验组(LE-rootm)的原始数据统计结果(表1)显示,Raw reads数分别为58 604 202和55 241 162条,经过滤得到Clean reads数分别为55 983 020和52 789 772条,分别占总Raw reads数的95.52 %和95.56 %,测序cDNA读取量分别为8.40和7.92 G,满足Q20分别为97.58 %和97.62 %,满足Q30分别为93.84 %和93.94 %,GC含量分别为42.28 %和42.15 %。说明HiSeq测序质量较高,能满足进行后续生物信息学分析要求。

表1 原始图像数据的质控结果统计Table 1 Quality control of raw data
2.3 Reads与参考基因组的比对结果
Reads与参考基因组比对结果(表2)显示,对照组(LE-root)和试验组(LE-rootm)的Reads与参考基因组的比对效率分别为86.39 %和85.76 %,Multiple mapped reads分别为0.85 %和0.70 %,均小于1.00 %,表明测序质量及所选基因较好,可满足后续分析需求。
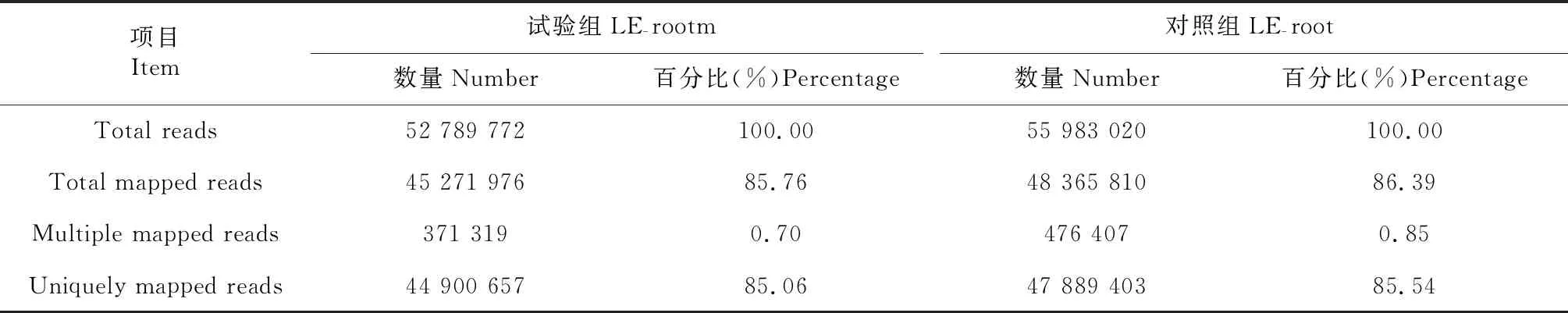
表2 Reads与参考基因组比对结果统计Table 2 Comparison of Reads and reference genomes
2.4 差异表达基因筛选结果
将对照组(LE-root)与试验组(LE-rootm)的测序数据进行比对分析,结果(图1)显示有1116个基因差异表达,其中731个基因上调表达,385个基因下调表达,上调表达基因数约为下调表达基因数的1.9倍,说明接种根结线虫后番茄中有更多的基因通过上调表达响应根结线虫侵染。
2.5 差异表达基因的GO功能注释分析结果
对差异表达基因进行GO分析,其功能归类于生物过程、细胞组分和分子功能三大类1830个条目。从图2可看出,在分子功能中,差异表达基因富集在16个GO条目,较显著的分子功能GO条目包括结合、转录因子激活、分子功能调控和酶活性催化等;生物过程富集在13个GO条目,较显著的生物过程GO条目包括刺激反应、生物调节和代谢过程等;细胞组分中所有的差异表达基因均富集在胞外区条目。从图3可看出,生物过程、分子功能和细胞组分分别富集在15、14和1个GO条目;在分子功能中,较显著的GO条目包括转运活性、过氧化物酶活性和抗氧化活性等;在生物过程中,较显著的分子功能GO条目包括刺激应答、压力应答和代谢应答等。
2.6 差异表达基因的KEGG分析结果
对差异表达基因进行KEGG分析发现,差异表达基因富集于94条KEGG代谢通路中,富集上调表达基因最多的为植物与病原互作通路,其次为类胡萝卜素生物合成和维生素B6代谢通路,富集下调表达基因最多的为苯丙氨酸代谢通路,其次为类苯基丙烷生物合成和植物激素信号转导通路。由表3可知,富集差异基因最多的是代谢途径,共富集79个差异表达基因,其次为次生代谢物的生物合成和植物与病原互作途径,分别富集45和18个差异表达基因。由表4可知,富集差异基因最多的是苯丙氨酸代谢和植物激素信号转导途径,均富集14个差异表达基因,其次为类苯基丙烷生物合成途径,共富集11个差异表达基因。

表3 番茄根尖组织样本间上调表达基因的KEGG分析结果Table 3 The KEGG annotations analysis of up-regulated genes in tomato root tip samples
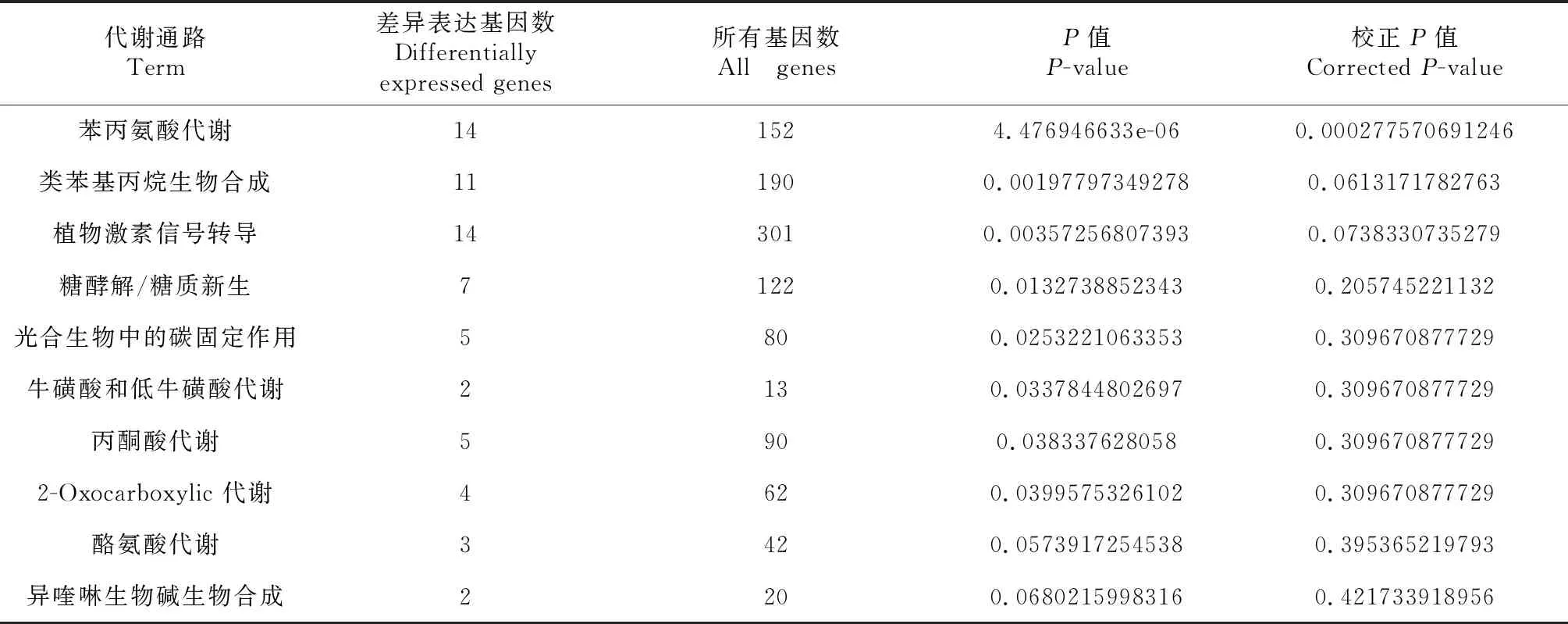
表4 番茄根尖组织样本间下调表达基因的KEGG分析结果Table 4 The KEGG annotations analysis of down-regulated genes in tomato root tip samples
2.7 差异表达的抗病相关基因
为研究番茄抗性材料对南方根结线虫的抗性响应,对接种24 h后差异表达的基因进行分析,结果发现22个植物与病原物互作相关基因差异表达。其中,18个抗病相关基因上调表达,包括12个Ca+-CaM/CML信号相关基因(11个类钙调蛋白CML、1个钙调蛋白CaM)、3个WRKY转录因子、1个环核酸门控离子通道(CNGCS)蛋白、1个热激蛋白和1个RBOH蛋白;差异表达最明显的是Solyc11g071760.1、Solyc11g071750.1和Solyc02g09 4000.1 3个钙调蛋白CML,差异倍数分别为4.73,3.50和3.34(表5);3个WRKY转录因子分别为WRKY22、WRKY26和WRKY33A,分别上调表达2.61、2.32和1.90倍;1个环核酸门控离子通道(CNGCS)蛋白为CNGC15b-lik,上调表达294倍。说明Ca+-CaM/CML信号、WRKY转录因子和环核甘酸门控离子通道是番茄抗性材料F5对南方根结线虫抗性反应的重要机制。
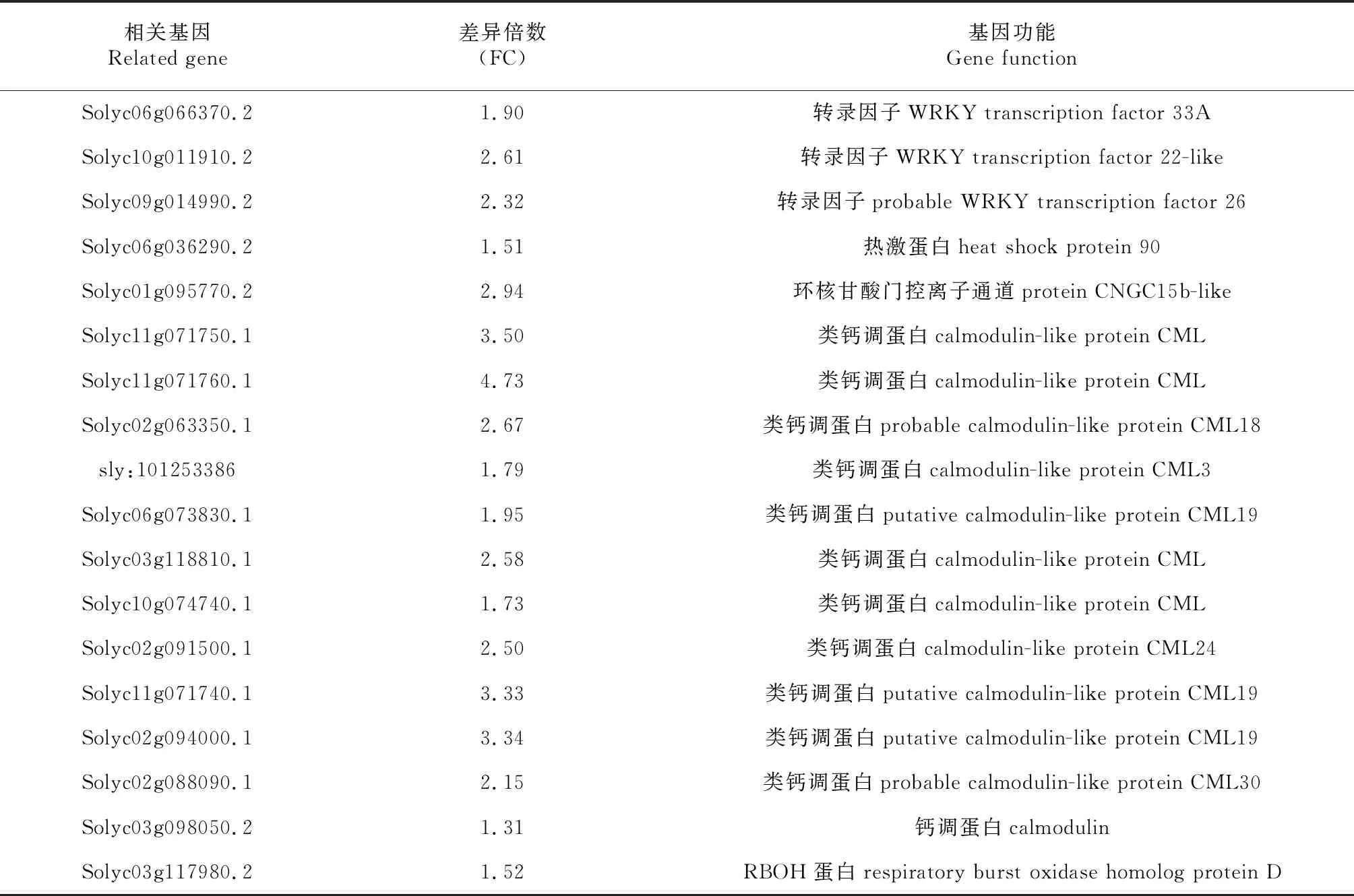
表5 上调表达的抗病相关基因Table 5 Up-regulation of disease-resistant genes
3 讨 论
番茄抗根结线虫基因的挖掘工作始于20世纪40年代,迄今已发现了10个抗性基因,其中Mi-1基因是目前唯一被应用的抗病基因,但Mi-1基因具有热不稳定性,且自然界中存在部分或全部打破Mi-1基因抗性的线虫群体。因此,从番茄材料中寻找新的抗病相关基因,将有利于加快抗病育种进程,促进抗病品种在生产上应用。本研究采用高通量测序技术对南方根结线虫侵染和未侵染番茄抗性材料F5样本的转录组进行检测,鉴定并挖掘与线虫响应相关的基因,共分离获得1116个差异表达基因,其功能归类于生物过程、细胞组分和分子功能三大类1830个条目,显著富集于94条KEGG代谢通路;对差异表达基因进行GO和KEGG分析发现,植物与病原互作相关的22个基因差异表达,其中18个抗性相关基因上调表达,上调表达明显的抗性基因包括11个类钙调蛋白、1个钙调蛋白、3个WRKY转录因子和1个环核甘酸门控离子通道蛋白。
Tuteja和Mahajan[17]、White和Broadley[18]研究认为,钙调蛋白和类钙调蛋白是Ca+-CaM/CML信号系统的重要组分,其与Ca2+结合后所形成的复合体能快速激活一系列蛋白,从而调控植物对不良环境和其他生物干扰的反应。CAMTA(CaM-binding Transcription activator)是CaM调控的转录激活因子家族之一,Rahman等[19]研究发现,CAMTA3参与调控油菜对菌核病(Sclerotiniasclerotiorum)的免疫和抗性过程需要结合CaM。本研究中,接种南方根结线虫后24 h,18个上调表达的抗病相关基因中有12个Ca+-CaM/CML信号通路相关基因,其中有1个钙调蛋白和11个类钙调蛋白,上调表达最高达4.73倍,表明番茄抗性材料F5在响应南方根结线虫侵染过程中,Ca+-CaM/CML信号通路可能参与调控番茄对线虫的抗性反应,与Rahman等[19]的研究结果一致,但这些CaM/CML在番茄响应线虫侵染反应中的功能及调控网络还需进一步探究。
WRKY转录因子在植物的抗病防卫反应中发挥重要调控作用,可通过与抗病相关蛋白基因启动子区W-box相结合激活下游抗病基因表达,从而开启植物的抗病防卫系统[20-21]。大量研究表明,WRKY转录因子在植物抗病调控中的作用大多依赖于茉莉酸(JA)和水杨酸(SA)[20-22]。Bhattarai等[23]利用基因芯片分析发现,在Mi基因介导的番茄抗根结线虫反应中WRKY转录因子SlWRKY72a/SlWRKY72b上调表达,沉默SlWRKY72a/SlWRKY72b可降低番茄对根结线虫的抗性。Chinnapandi等[24-25]研究发现,SlWRKY45可能通过激活依赖于SA的信号传导路径调控抗线虫反应,SlWRKY3通过激活脂质和激素介导的防御信号通路,对爪哇根结线虫(M.javanica)起正向调控作用。本研究结果与上述研究结果相似,接种南方根结线虫后24 h,有3个WRKY转录因子(WRKY22、WRKY26和WRKY33A)上调表达,上调倍数分别为2.61、2.32和1.90倍,说明这3个WRKY转录因子在番茄抗性材料F5响应南方根结线虫侵染过程中发挥了一定作用,但其抗线虫调控机制有待进一步探究。
植物的环核甘酸门控离子通道能直接被激活,也可以通过与环核甘酸(cAPM/cGMP)可逆性结合被激活,参与调控植物细胞的离子运转、病原体防御应答和生长发育等[26-27]。Balague等[28]研究显示,拟南芥AtCNGC4可通过参与病程相关蛋白(PR)基因的组成表达,增强对强毒性病原体的广谱抗性。本研究发现,接种南方根结线虫后24 h,1个环核甘酸门控离子通道蛋白基因上调表达,上调表达倍数为2.94倍,说明该基因可能参与调控番茄抗性材料F5对南方根结线虫的防御应答,但其是否与AtCNGC4一样可通过与其他抗性相关基因间组成调控网络增强F5对线虫的抗性还需进一步探讨。
4 结 论
Ca+-CaM/CML信号、WRKY转录因子、环核甘酸门控离子通道是番茄抗性材料F5对南方根结线虫抗性反应的重要机制,可作为深入探索根结线虫与番茄互作及挖掘番茄关键抗性相关基因的参考依据。

