长链非编码RNA uc.412在肾脏纤维化中的表达及作用
文先丽,李善文,赵雅洁,黄婵,朱仙艺,甘卫华,张爱青
(南京医科大学第二附属医院儿科,南京 210003)
慢性肾脏病在世界范围内的发病率较高,且病情隐匿,易合并多种并发症。慢性肾脏病的病因复杂多样,但肾脏纤维化是慢性肾脏病晚期的共同特征和关键改变,也是慢性肾脏病发展至终末期肾病的共同病理改变[1-2]。肾脏纤维化的主要病理改变包括肾固有细胞转分化为肌成纤维细胞导致的肾小球硬化、细胞外基质大量沉积于间质导致的肾间质内纤维化以及肾内血管硬化,纤维化改变最终导致肾脏组织损伤和功能衰竭[3]。系膜细胞作为肾固有细胞的一种,在肾脏纤维化中发生表型转化,伴有增殖及细胞外基质增多改变,还可通过分泌效应扩大细胞因子损伤肾小球,引起肾小球硬化进而导致肾脏纤维化[4-6]。长链非编码RNA(long non-coding RNA,LncRNA)在生物细胞中广泛存在,参与多种生物学过程,如影响基因转录、调控基因表达、参与细胞间通讯和重组、改变细胞运动能力等[7]。本课题组在前期研究中通过高通量测序及生物信息学分析发现,LncRNA uc.412的表达水平可能与肾脏纤维化相关,通过对UCSC数据库进行分析发现LncRNA uc.412序列在人类、大鼠和小鼠基因组的同源区之间高度保守[8]。本研究拟通过建立经典单侧输尿管结扎(unilateral ureteral obstruction,UUO)的小鼠肾脏纤维化模型和体外系膜细胞损伤模型,检测LncRNA uc.412与肾脏纤维化相关基因的表达,进一步探究LncRNA uc.412在肾脏纤维化中的作用,为后续LncRNA的作用机制研究提供理论依据。
1 材料与方法
1.1实验材料
1.1.1实验动物和细胞 12只SPF级雄性C57BL/6小鼠购自常州卡文斯实验动物有限公司[生产许可证:SCXK(苏)2016-0010;使用许可证:SYXK(苏)2016-0014)],周龄6~8周,体重16.9~22.8 g,小鼠在东南大学SPF级动物实验室饲养。动物实验符合医学动物伦理要求。大鼠肾小球系膜细胞购自美国Type Culture Collection(ATCC)公司。
1.1.2主要试剂和材料 血清肌酐、尿素氮检测试剂盒购自南京建成生物工程研究所,Trizol购自美国ThermoFisher Scientific公司(批号:LOT:262306),聚合酶链反应(polymerase chain reaction,PCR)引物购自上海锐真生物科技有限公司,PCR试剂购自日本TAKARA公司(批号:AJ60587A),动物蛋白裂解液购自上海碧云天生物技术有限公司,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、β-肌动蛋白(β-Actin)以及Ⅰ型胶原蛋白(collagen 1,COL1)蛋白抗体购自英国Abcam公司,LncRNA uc.412的siRNA购自上海吉马制药技术有限公司,SIS3购自美国MedChemExpress(MCE)公司(批号:HY-13013)。
1.2实验方法
1.2.1UUO模型建模方法 小鼠先于动物实验中心内适应性喂养7 d,然后随机分为对照组和UUO组,各6只。手术方法:将1%戊巴比妥钠溶液以20 mg/kg的浓度对小鼠进行腹膜内麻醉。UUO组小鼠左侧输尿管结扎于左肾的肾门附近;对照组小鼠仅行左输尿管钝性分离,但不行结扎术,随后关闭腹腔。术后两组小鼠均正常喂养。在手术后第14天以颈椎脱臼法处死小鼠。收集小鼠的血液1.5 mL,以离心半径13.5 cm,3 000 r/min离心5 min,收集上层血清并于-80 ℃保存。分离小鼠左肾组织,贴壁储存于1.5 mL EP管中并于-80 ℃保存,用于后续研究。
1.2.2血清肌酐和尿素氮水平检测 采用蒸馏水以1∶200的比例稀释血样后,取1.6 mL置于离心管中作为测量管,并设空白管(加1.6 mL蒸馏水)1管和标准管1管。每管分别加入0.5 mL苦味酸溶液和0.5 mL氢氧化钠溶液;充分混合后置于37 ℃中水浴10 min,冷却后调零,于510 nm处测量每个管的吸光度,计算血肌酐值。取0.02 mL血清置于离心管中,并设空白管和标准管。每管加入1 mL邻苯二甲酸二乙酯脂溶液和1 mL氯化铁-磷酸溶液,混合后水浴15 min,冷却后调零,并测量520 nm处的吸光度,计算血尿素氮值。
1.2.3Masson染色检测肾脏组织标本纤维化程度 将包埋小鼠肾脏组织的石蜡切片常规脱蜡至水,依次用Regaud苏木精染料染核,使胞核呈蓝褐色,丽春红酸性品红染色,使胞质、肌纤维和红细胞呈红色,苯胺蓝溶液复染,使胶原纤维呈蓝色,可区分胶原纤维和肌纤维,光学显微镜下观察组织纤维化程度。
1.2.4大鼠系膜细胞培养 大鼠系膜细胞快速复苏后用含10%胎牛血清的杜尔贝科改良培养基(Dulbecco′s modified eagle medium,DMEM)培养液于37 ℃、5% CO2培养箱中培养,隔天换液,0.25%胰酶消化传代。待细胞生长至对数生长期时,更换无血清培养基DMEM对细胞进行同步化处理12 h。用转化生长因子-β1(transforming growth factor-β1,TGF-β1)(10 μg/L)和siRNA(75 nmol/L)干预分组:对照组、TGF-β1组、siRNA组、TGF-β1+siRNA组;用TGF-β1(10 μg/L)和SIS3(1 μmol/L)干预分组:对照组、TGF-β1组、SIS3组、TGF-β1+SIS3组。
1.2.5siRNA转染大鼠系膜细胞 LncRNA uc.412的siRNA由上海吉马生物科技有限公司设计合成,LncRNA uc.412 siRNA(5′-GCCGGCCAUACAGUUG-AUUTT-3′),反义链序列为(5′-AAUCAACUGUAUGGCCGGCTT-3′)。将系膜细胞接种至12孔板培养孔中,使转染时细胞密度达50%~70%,参考上海吉马生物科技有限公司的siRNA说明书操作:用无菌水稀释siRNA至20 μmol/L;参考美国Invitrogen公司LipofectamineTM2000转染说明书操作:用无血清培养基稀释siRNA分别至浓度25 nmol/L、50 nmol/L、75 nmol/L,取4 μL LipofectamineTM2000稀释于100 μL培养基中,室温孵育5 min,将上述溶液混合后室温静置20 min。以10 μg/L TGF-β1干预细胞,按照不同分组处理细胞:对照组(Lipo2000)、TGF-β1组(TGF-β1+Lipo2000)、TGF-β1+25 nmol/L siRNA组(TGF-β1+Lipo2000+25 nmol/L siRNA)、TGF-β1+50 nmol/L siRNA(TGF-β1+Lipo2000+50 nmol/L siRNA)组、TGF-β1+75 nmol/L siRNA组(TGF-β1+Lipo2000+75 nmol/L siRNA)。
1.2.6RNA的提取及实时荧光定量PCR(quantitative real-time polymerase chain reaction,qPCR)法检测mRNA和LncRNA表达量 每50~100毫克肾脏组织加入1 mL Trizol(六孔板内细胞每孔加1 mL),将混合物静置5 min,然后加入0.2 mL氯仿,剧烈摇动15 s后冰浴10 min。在4 ℃,离心半径10 cm,12 000 r/min离心15 min,集上清至新离心管并测量其体积。加入等量异丙醇,轻柔混合,常温静置10 min,4 ℃,离心半径10 cm,12 000 r/min离心10 min,弃上清。加1 mL 75%乙醇溶液涡旋震荡以清洗沉淀。4 ℃,离心半径10 cm,7 500 r/min离心5 min,弃上清,重复1次。短时间内干燥,加20 μL DEPC水溶解RNA,并在260 nm处测量吸光度以定量RNA浓度。据日本TAKARA公司要求严格制备cDNA。完成后以cDNA为样本配置总量为10 μL的PCR反应体系,用LightCycler 96的PCR仪(ROCHE集团)检测结果。实验重复3次,根据内参表达量检测计算目标基因的相对表达,相对表达量通过2-ΔΔCT法算,使用的引物序列见表1。

表1 PCR引物序列
1.2.7总蛋白的提取及蛋白质免疫印迹(Western blot)法检测目的蛋白表达量 使用Western blot法检测目的蛋白的表达,取样本(小鼠肾组织30 mg或细胞皿内细胞)加入适量的组织蛋白裂解液后研磨,冰上裂解10 min,4 ℃,离心半径10 cm,12 000 r/min离心10 min,收集上清至新离心管,蛋白定量BCA法试剂盒测定总蛋白浓度,标化浓度后将其置于100 ℃金属加热器中煮沸5 min还原,然后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,转膜成功后将膜完全浸入5%牛血清白蛋白中,室温下封闭1 h,4 ℃,一抗溶液中孵育14~16 h,TBS+Tween洗涤缓冲液漂洗3次,加入二抗抗体中,室温下孵育1 h,TBS+Tween洗涤缓冲液漂洗3次,计算曝光处理后蛋白表达水平,检测目的蛋白的相对表达量,实验重复3次。
2 结 果
2.1两组小鼠血生化指标和肾脏纤维化改变的比较 UUO组小鼠血肌酐和血尿素氮水平显著高于对照组(P<0.05),见表2。Masson染色结果显示:对照组肾脏的形态结构基本正常;UUO组结扎侧肾脏表现为肾小管严重萎缩,UUO组肾脏组织胶原纤维染色区域(蓝色)面积较对照组明显增大。见图1。
表2 两组小鼠血生化指标比较
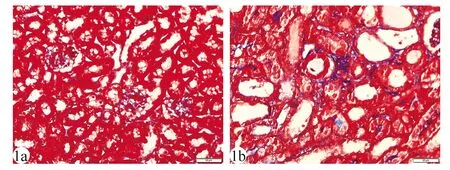
UUO:单侧输尿管结扎;1a:对照组;1b:UUO组
2.2两组小鼠肾组织LncRNA uc.412、α-SMA、TGF-β1、COL1基因水平比较 UUO组LncRNA uc.412、α-SMA、TGF-β1、COL1 mRNA的表达高于对照相(P<0.05),见表3。
表3 两组小鼠肾组织LncRNA uc.412、α-SMA、TGF-β1、COL1基因水平比较
2.3两组小鼠肾组织COL1蛋白表达的比较 UUO组小鼠肾组织的COL1蛋白表达量高于对照组(2.629±0.045比0.969±0.003)(t=51.520,P<0.001)。见图2。

UUO:单侧输尿管结扎;β-Actin:β-肌动蛋白;COL1:Ⅰ型胶原蛋白
2.4siRNA对TGF-β1诱导大鼠系膜细胞α-SMA蛋白表达的影响 各组LncRNA uc.412基因表达比较差异有统计学意义(P<0.01),TGF-β1组LncRNA uc.412的表达量高于对照组,其他组与对照组比较差异无统计学意义(P>0.05);TGF-β1+25 nmol/L siRNA组、TGF-β1+50 nmol/L siRNA组、TGF-β1+75 nmol/L siRNA组LncRNA uc.412的表达量低于TGF-β1组(P<0.05),TGF-β1+25 nmol/L siRNA组、TGF-β1+50 nmol/L siRNA组、TGF-β1+75 nmol/L siRNA组间两两比较差异无统计学意义(P>0.05),其中TGF-β1+75 nmol/L siRNA组LncRNA uc.412的表达量减少最明显,选择该浓度siRNA进行后续实验,见表4。

表4 siRNA干预大鼠肾脏系膜细胞后LncRNA uc.412基因的表达 (n=3)
各组α-SMA蛋白表达比较差异有统计学意义(P<0.01),TGF-β1组高于对照组,其他组与对照组比较差异无统计学意义(P>0.05);TGF-β1+siRNA组低于TGF-β1组(P<0.05),siRNA组与TGF-β1比较差异无统计学意义(P>0.05);TGF-β1+siRNA组与siRNA组比较差异无统计学意义(P>0.05)。见表5、图3。

表5 siRNA干预大鼠肾脏系膜细胞后α-SMA蛋白的表达 (n=3)

TGF-β1:转化生长因子-β1;GAPDH:甘油醛-3-磷酸脱氢酶;COL1:Ⅰ型胶原蛋白;α-SMA:α-平滑肌肌动蛋白
2.5SIS3对大鼠肾脏系膜细胞LncRNA uc.412表达的影响 各组LncRNA uc.412表达比较差异有统计学意义(P<0.01),TGF-β1组高于对照组,SIS3组、TGF-β1+SIS3组与对照组比较差异无统计学意义(P>0.05);TGF-β1+SIS3组低于TGF-β1组,SIS3组与TGF-β1组比较差异无统计学意义(P>0.05);TGF-β1+SIS3组与SIS3组比较差异无统计学意义(P>0.05)。见表6。

表6 SIS3干预大鼠肾脏系膜细胞后LncRNA uc.412基因的表达 (n=3)
3 讨 论
近年来研究发现,LncRNA通常具有复杂的二级和三级结构以及多样的亚细胞定位。LncRNA参与RNA加工[9]、基因转录调控[10]、染色质修饰[11]、细胞凋亡、端粒维持等功能,并在生物学过程中发挥重要作用。有研究显示,LncRNA与肾脏纤维化及慢性肾脏病的发生发展密切相关。Han等[12]发现在局灶节段性肾小球硬化中LncRNA LOC105375913表达水平显著升高,可通过与miR-27b结合持续地过表达Snail而发挥促纤维化功能。Wang等[13]发现LncRNA生长抑制特异性转录本5可通过竞争性结合miR-96-5p导致肾纤维化过程。Xue等[14]发现LncRNA母系表达基因3通过miR-185/DNA甲基转移酶1/母系表达基因3通路的调节作用,抑制TGF-β1诱导的肾纤维化过程。
本研究选取UUO这一经典纤维化模型,通过Masson染色、生化指标检测得出UUO组小鼠肌酐、尿素氮水平高于对照组,UUO组肾脏组织胶原纤维染色区域面积较对照组明显增大,从而验证模型成功,后用该模型肾脏标本进行qPCR检测UUO组LncRNA uc.412以及COL1、α-SMA、TGF-β1的表达水平,结果显示LncRNA uc.412在UUO模型中表达水平显著升高,与纤维化指标COL1表达量改变一致,与纤维化重要影响因子TGF-β1表达量改变一致,提示LncRNA uc.412可能参与UUO模型肾脏纤维化的发生。为了探究UUO模型中LncRNA的表达变化与TGF-β1变化的相关性,本研究进一步行体外实验,在大鼠系膜细胞中用TGF-β1和LncRNA uc.412的siRNA干预细胞,结果显示TGF-β1可使系膜细胞内纤维化相关蛋白α-SMA的表达量上调,而这种改变可被LncRNA uc.412的siRNA所抑制,提示TGF-β1可通过上调LncRNA uc.412的表达而诱导系膜细胞纤维化改变。
TGF-β1是在纤维化中已得到公认的关键细胞因子之一[15],在纤维化的发生发展及治疗中起重要作用[16]。在TGF-β1/Smad信号通路中,TGF-β1活化后可直接结合TGF-β受体Ⅱ,激活的TGF-β受体Ⅱ进一步募集TGF-β受体 Ⅰ,进而导致Smad2和Smad3的磷酸化,然后已活化的Smad2/3与Smad4结合,使整个复合物转移到细胞核中以此来增加纤维粘连蛋白、α-SMA、胶原蛋白基因的转录[17]。SIS3具有强效、高选择性抑制Smad3的功能。SIS3可抑制TGF-β1诱导的磷酸化Smad3、Smad3与Smad4相互作用以及Smad3与细胞核DNA结合,且不影响Smad2磷酸化。同时SIS3可减弱TGF-β1转录活性,抑制TGF-β1诱导成肌纤维细胞转化为成纤维细胞[18]。Li等[19]通过实验证明,Smad3磷酸化抑制剂SIS3可通过减少内皮-间充质转化减轻糖尿病肾病的纤维化水平,而在LncRNA领域也有研究证明LncRNA-TSI[20]、LncRNA Erbb4-IR(np_5318)[21]等可通过调控TGF-β1/Smad通路来影响肾纤维化的过程。本研究在大鼠系膜细胞中进行TGF-β1和Smad3特异性抑制剂SIS3干预处理,结果显示TGF-β1可刺激LncRNA uc.412的表达上调,而这种改变可被SIS3所抑制,提示TGF-β可能是通过TGF-β1/Smad3信号通路上调LncRNA uc.412的表达。结合动物实验及TGF-β1/Smad信号通路相关细胞实验研究结果推测,在UUO模型中表达增高的TGF-β可能通过TGF-β1/Smad3信号通路增加肾脏LncRNA uc.412的表达,促进肾脏纤维化的发生。
综上所述,LncRNA uc.412可能与慢性肾脏病肾脏纤维化的发生发展密切相关,且可能与TGF-β/Smad3信号通路有关,而LncRNA uc.412发挥作用的具体方式及其下游的作用因子有待进一步研究。

