温补肾阳方通过ROS/p38 MAPK通路对骨髓增生异常综合征细胞株自噬及凋亡的影响
赵志芳,赵志英,杨艳敏,席亚男,刘 泉
(1 邢台医学高等专科学校第一附属医院血液科,邢台 054001;2 北京王府中西医结合医院脑病科;3 邢台市人民医院人事科;4 苏州高新区人民医院中医科;*通讯作者,E-mail:214834294@qq.com)
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一种老年人群常见的恶性血液系统疾病,其发病率有逐年升高的趋势[1]。目前,去甲基化药物和造血干细胞移植等是MDS治疗的主要手段,但治疗效果并不十分理想[2]。张新凡等[3]认为,脾肾亏虚是MDS发病的关键所在,给予温阳补肾方治疗后有良好的效果,但温阳补肾方用于临床治疗MDS的理论依据还不够充分。大量研究显示,细胞凋亡和自噬异常是MDS发病的重要机制[4-6],然而,温阳补肾方对MDS细胞凋亡和自噬的影响并不清楚。因此,本研究以不同浓度的温阳补肾方含药血清作用于人MDS细胞株SKM-1观察SKM-1细胞凋亡和自噬的变化,旨在初步探讨温阳补肾方对SKM-1细胞的作用机制。
1 材料与方法
1.1 主要材料
清洁级SD大鼠购于北京科宇动物养殖中心,(190-210)g,合格证号:SCXK(京)-2018-0010。人MDS细胞株SKM-1、活性氧(reactive oxygen species,ROS)检测试剂盒2,7-二氯二氢荧光素二乙酸酯(2,7-Dichlorodi-hydrofluorescein diacetate,DCFH-DA)购于上海联迈生物工程有限公司,货号:LHY1465、LM-467D;RPMI-1640培养基、胎牛血清和含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)的比色检测试剂盒购于上海索莱宝生物科技有限公司,货号:31800-022、S9020、K106-100;噻唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]细胞增殖检测试剂盒、膜联蛋白Ⅴ-异硫氰酸荧光素(Annexin Ⅴ-FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒和通用总蛋白质提取试剂盒购于上海生工生物工程股份有限公司,货号:E606334、E606336、C006225;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Beclin1、P62、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)、磷酸化(p)-P38 MAPK抗体购于美国Abcam,货号:ab8245、ab62557、ab207305、ab62721、ab170099、ab178867。
1.2 温阳补肾方含药血清的制备
温阳补肾方由黄芪(30 g)、党参(20 g)、熟地(20 g)、山药(15 g)、白术(15 g)、山茱萸(15 g)、淫羊藿(15 g)、菟丝子(15 g)、茯苓(15 g)、锁阳(15 g)、当归(10 g)组成,水煮成每毫升含生药1 g。根据人和动物服用剂量换算,给予5 g/kg温阳补肾方药液灌胃的SD大鼠为低剂量组,给予10 g/kg温阳补肾方药液灌胃的SD大鼠为中剂量组,给予20 g/kg温阳补肾方药液灌胃的SD大鼠为高剂量组,给予等剂量生理盐水灌胃的SD大鼠作为生理盐水组,其中每组10只大鼠,每天早、晚各灌胃1次,持续7 d。在末次灌胃后2 h内腹腔注射10%水合氯醛麻醉取动脉血,2 000 r/min离心15 min分离获得血清;经56 ℃灭活处理30 min并以0.22 μm微孔滤膜除菌后,保存于-20 ℃下备用。
1.3 实验分组与处理
SKM-1细胞采用含10%胎牛血清的RPMI-1640培养基在5%CO2、37 ℃恒温培养箱内常规培养。实验分为:空白对照组(不做任何处理)、生理盐水组(给予生理盐水组大鼠血清处理)、药物低、中、高剂量组(分别给予相应剂量大鼠血清处理)。每个处理组设置3个复孔。
1.4 MTT法检测SKM-1细胞增殖活力
以每孔2×104个细胞铺96孔板后,置于5%CO2、37 ℃恒温培养箱内培养;细胞贴壁后,按照1.3中的分组处理SKM-1细胞,另外将不含细胞的培养基作为调零组;处理24,48,72 h后,根据MTT细胞增殖检测试剂盒说明检测各处理组SKM-1细胞的光密度(optical density,OD)值,并以(实验组OD-调零组OD)/(空白对照组OD-调零组OD)×100%值表示各组SKM-1细胞增殖活力。该实验重复3次。
1.5 流式细胞术检测SKM-1细胞凋亡
以每孔1×105个细胞铺24孔板后,置于5%CO2、37 ℃恒温培养箱内培养;细胞贴壁后,根据1.3中的分组处理各组SKM-1细胞48 h后收集各组细胞,参照Annexin Ⅴ-FITC/PI试剂盒说明书检测各组SKM-1细胞凋亡率。该实验重复3次。
1.6 比色法检测SKM-1细胞Caspase-3活性
按照1.3中的分组处理各组SKM-1细胞48 h后收集各组细胞,参照Caspase-3的比色检测试剂盒说明书检测各组SKM-1细胞Caspase-3活性。该实验重复3次。
1.7 DCFH-DA荧光探针法检测SKM-1细胞内ROS水平
以每孔2×105个细胞铺6孔板后,置于5%CO2、37 ℃恒温培养箱内培养;SKM-1细胞贴壁后,根据1.3进行分组处理;处理48 h后,参照ROS检测试剂盒说明书检测,荧光显微镜观察、酶标仪检测各处理组SKM-1细胞的荧光强度,该实验重复3次。
1.8 免疫印迹法(Western blot)检测SKM-1细胞中Beclin1、P62、LC3-Ⅰ、LC3-Ⅱ、P38 MAPK和p-P38 MAPK蛋白表达水平
收集处理48 h的各组SKM-1细胞,根据通用总蛋白提取试剂盒说明书提取各组SKM-1细胞总蛋白后,采用考马斯亮蓝法检测总蛋白浓度;对变性蛋白行电泳分离后,转至聚偏氟乙烯膜上;经封闭处理2 h后,加入Beclin1(1 ∶800)、P62(1 ∶200)、LC3-Ⅰ(1 ∶500)、LC3-Ⅱ(1 ∶500)、P38 MAPK(1 ∶1 000)、p-P38 MAPK(1 ∶1 000)和GAPDH(1 ∶1 000)抗体室温孵育2 h;再以二抗(1 ∶2 000)孵育1.5 h后,暗室内显影剂显影曝光;采用凝胶成像分析系统分析SKM-1细胞中Beclin1、P62、LC3-Ⅰ、LC3-Ⅱ、P38 MAPK和p-P38 MAPK蛋白表达水平,其中GAPDH作为内参进行校正。该实验重复3次。
1.9 数据分析
2 结果
2.1 温阳补肾方对SKM-1细胞增殖的影响
在相同时间处理下生理盐水组和空白对照组之间SKM-1细胞增殖活力差异无统计学意义(P>0.05),但低剂量组、中剂量组和高剂量组SKM-1细胞增殖活力较生理盐水组明显降低(P<0.05),且呈一定的药物浓度依赖性(P<0.05,见表1)。

表1 不同时间处理下各组SKM-1细胞的增殖活力
2.2 温阳补肾方对SKM-1细胞凋亡的影响
与空白对照组比较,生理盐水组SKM-1细胞凋亡率以及Caspase-3活性差异均无统计学意义(P>0.05);与生理盐水组比较,低剂量组、中剂量组和高剂量组SKM-1细胞凋亡率以及Caspase-3活性逐渐升高且差异有统计学意义(P<0.05,见表2和图1)。
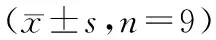
表2 各组间SKM-1细胞凋亡率和Caspase-3活性的比较
2.3 温阳补肾方对SKM-1细胞内ROS水平的影响
与空白对照组比较,生理盐水组SKM-1细胞内ROS水平差异无统计学意义(P>0.05);与生理盐水组比较,低剂量组、中剂量组和高剂量组SKM-1细胞内ROS水平逐渐升高,差异有统计学意义(P<0.05,见表3和图2)。

图1 流式细胞术检测SKM-1细胞凋亡结果Figure 1 Flow cytometry analysis of SKM-1 cell apoptosis
2.4 温阳补肾方对SKM-1细胞自噬和P38 MAPK通路的影响
与空白对照组比较,生理盐水组SKM-1细胞中Beclin1、P62蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ、p-P38 MAPK/P38 MAPK值差异均无统计学意义(P>0.05);与生理盐水组比较,低剂量组、中剂量组和高剂量组SKM-1细胞中Beclin1蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ、p-P38 MAPK/P38 MAPK值呈浓度依赖性升高,而P62蛋白表达水平呈浓度依赖性降低,差异有统计学意义(P<0.05,见图3和表4)。

表3 各组SKM-1细胞内ROS水平的比较

图2 DCFH-DA荧光探针法检测SKM-1细胞内ROS水平 (×100)Figure 2 ROS level in SKM-1 cells by DCFH-DA fluorescent probe (×100)

图3 Western blot检测SKM-1细胞中Beclin1、P62、LC3-Ⅰ、LC3-Ⅱ和P38 MAPK蛋白表达Figure 3 Protein expression of Beclin1, P62, LC3-Ⅰ, LC3-Ⅱ and P38 MAPK in SKM-1 cells by Western blot
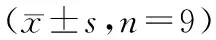
表4 各组SKM-1细胞中P62、Beclin1蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ、p-P38 MAPK/P38 MAPK值的比较
3 讨论
MDS是一种异质性髓系克隆性疾病,起源于造血干细胞,具有造血功能减低和向急性髓系白血病转化风险高的特点[7];虽然去甲基化药物、传统化疗药和造血干细胞移植等使患者生存率有所提高,但因耐药性和个体差异等因素导致部分患者的治疗效果并不十分理想[8]。MDS在2008年被WHO血液肿瘤分类系统列为髓系肿瘤之一[9],细胞增殖与凋亡失衡以及自噬活性降低是导致MDS恶性发展的重要因素[10,11]。Caspase-3是一种半胱氨酸蛋白酶,在细胞凋亡过程中扮演着执行者的角色[12];P62是一种多功能蛋白,在自噬-溶酶体系统蛋白降解过程中发挥着重要作用[13];Beclin1是一种重要的自噬相关基因,可通过与相关蛋白结合形成复合体促进自噬发生[14];LC3也是一种自噬相关基因,可通过酶解变成LC3-Ⅰ,而LC3-Ⅰ可转化为定位于自噬体膜的LC3-Ⅱ,其中LC3-Ⅱ/LC3-Ⅰ值常用来评价自噬水平[15,16]。
中医将MDS称为“髓毒劳”,认为“心生血,肾生髓”、“心阳不足,肾阳亏虚”。《医宗金鉴》中言“黄芪补表气”,故温阳补肾方以黄芪、党参、熟地为主药,山药、山茱萸辅之,加以白术、茯苓补气健脾,淫羊藿、菟丝子、锁阳温肾填精,另外佐用当归补养营血。全方健脾补肾、益髓填精、益气生血。现代医学研究表明,黄芪的主要化学成分黄芪多糖可诱导肿瘤细胞发生凋亡,可能是通过调控细胞凋亡相关蛋白表达、影响细胞生长周期发挥效用的[17]。党参多糖能够有效抑制人肝癌HepG2细胞的生长和运动能力,促进HepG2细胞凋亡[18]。梁颖等[19]使用熟地黄多糖对荷瘤小鼠进行治疗,发现熟地黄多糖可上调肿瘤组织中Caspase-3的表达,促进肿瘤细胞凋亡。本研究以应用最为广泛的MDS细胞株SKM-1为研究对象,给予温阳补肾方含药血清作用后发现,SKM-1细胞增殖活力及P62蛋白表达水平呈浓度依赖性降低,而细胞凋亡率、Caspase-3活性、Beclin1蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ值呈浓度依赖性升高。结果表明,温阳补肾方可抑制SKM-1细胞增殖,上调Caspase-3促进细胞凋亡,并且通过下调P62蛋白表达、上调Beclin1蛋白表达以及促进LC3-Ⅰ向LC3-Ⅱ转化,从而加速细胞自噬。
ROS是细胞内氧代谢的副产物,其过量可损坏蛋白质、脂质和DNA等,诱导细胞凋亡和自噬发生;p38 MAPK是丝氨酸/苏氨酸丝裂原活化蛋白激酶家族成员,可被ROS活化,在细胞增殖、凋亡和自噬等过程中发挥着重要作用[20-23]。有研究指出,阿糖胞苷可通过上调ROS水平诱导人MDS细胞株MUTZ-8的生长并诱导其凋亡[24]。本研究进一步检测发现,温阳补肾方可呈浓度依赖性升高SKM-1细胞内ROS水平;另外,本研究还发现,温阳补肾方可呈浓度依赖性上调P38 MAPK磷酸化水平。结果表明,温阳补肾方可促进SKM-1细胞中ROS/P38 MAPK通路活化。提示,温阳补肾方诱导SKM-1细胞凋亡与自噬的分子机制可能与其激活ROS/P38 MAPK通路有关。
总之,本研究发现了温阳补肾方具有抑制SKM-1细胞增殖和促进凋亡与自噬的作用,初步揭示了其作用机制可能与激活ROS/p38 MAPK通路有关。该结果为后期进一步深入探讨ROS/p38 MAPK通路和自噬在温阳补肾方改善MDS方面的研究奠定了一定基础。

