厚朴酚通过PD-1/PD-L1通路介导非小细胞肺癌增殖和凋亡的机制研究
史红阳,王 煜,张永红,邓文静,李 维
(西安交通大学第二附属医院呼吸与危重症医学科,西安 710004;*通讯作者,E-mail:shihy2003@126.com)
非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌的85%-90%,是与癌症相关死亡的主要原因[1]。近几十年来,NSCLC的诊断和治疗策略有了很大的进步,但NSCLC的预后仍然较差,5年总体生存率仍低于15%[2]。程序性死亡受体1(programmed death-1,PD1)是CD28家族成员之一,是一种参与维持外周耐受性的抑制受体,PD-1通过招募蛋白酪氨酸磷酸酶SHP-1和SHP-2,阻断CD3/CD28诱导的PI3K活化和TCR下游的其他信号事件,最终抑制T细胞增殖、细胞因子的产生和分化[3,4]。PD-1免疫检查点是免疫系统重要的稳态机制,有助于预防慢性感染患者的自身免疫和炎症失控,然而,PD-1/PD-L1信号通路也被多种恶性肿瘤所控制,是肿瘤细胞逃避免疫系统监控的最重要机制之一[5]。厚朴是我国传统中药,基本上全身皆可入药,在我国分布广泛。厚朴中含挥发性油、生物碱及微量盐酸等,其中和厚朴酚与厚朴酚作为其主要成分被广泛研究,主要具有抗菌、抗病毒以及抗肿瘤的功能[6]。本研究探讨厚朴酚通过PD-1/PD-L1信号通路介导非小细胞肺癌增殖和凋亡的机制研究,为厚朴酚抗癌作用的临床运用提供前期工作基础和理论支持。
1 材料和方法
1.1 细胞株和组织样本
人肺癌细胞系A549和人支气管上皮样细胞HBE(阴性对照)购自武汉普诺赛生命科技有限公司。收集本院2017年8月至2018年5月经临床和病理确诊的NSCLC组织标本30例,收治患者在癌组织切除手术前无其他全身器质性病变并未接受化疗等治疗,同时收集距离肺癌组织7 cm以上的肺黏膜组织为癌旁对照组,收集的癌组织和癌旁组织经液氮处理后冻存在-80 ℃冰箱尽快用于后续试验。研究取得本院伦理委员会的论证许可(NO.2018-3-5-012),而且患者签署知情同意书。
1.2 实验试剂
DMEM细胞培养基和胎牛血清购自美国Gibco公司,PBS缓冲液和胰酶购自武汉普诺赛生命科技有限公司,RNeasy Mini kit试剂盒、PrimeScriptTMRT Master Mix逆转录试剂盒、SYBR Premix EX Taq实时荧光定量试剂盒购自日本TaKaRa公司,PD-1、PD-L1、18S rRNA引物由上海生工合成,Cell Lysis Buffer、PD-1 Rabbit mAb、PD-L1 Rabbit mAb购自美国CST公司,CCK8试剂盒购自日本同仁化学,Annexin Ⅴ-FITC/PI凋亡检测试剂盒购自北京索莱宝公司。
1.3 细胞培养
把人非小细胞肺癌细胞A549冻存管和人支气管上皮样细胞HBE于37 ℃水浴锅解冻,吸取细胞悬浮液移入事先准备好的15 ml离心管中,加入5 ml含有10%胎牛血清的DMEM培养基混匀,在200g下离心4 min,吸掉上清,加入1 ml培养基反复吹打均匀后转移至加入10 ml预热培养基的培养瓶于37 ℃、5% CO2培养过夜,弃上清液,用PBS洗涤细胞2次,每2 d换1次培养基,细胞汇合至80%以上后倒掉培养液,加入1 ml胰酶消化液(0.25%胰酶+0.02% EDTA)消化液,吸掉消化液,显微镜下发现胞质回缩后加入5 ml预热的培养基,用玻璃吸管吹打均匀,吸取一半细胞悬浮液转移至新的培养瓶,加入8 ml培养基后于37 ℃、5% CO2培养箱中培养。
1.4 实验分组与处理
收集对数生长期的A549细胞接种于96孔板,调整细胞浓度至1×104/孔,将细胞分为3组:对照组(0 μmol/L厚朴酚),低剂量(40 μmol/L)厚朴酚组,高剂量(80 μmol/L)厚朴酚组。在37 ℃、5% CO2培养箱中培养用于后续实验,人支气管上皮样细胞HBE为阴性对照组。
1.5 免疫组化
使用Max Vision法进行免疫组化。将组织切片后,进行常规脱蜡、水化以及抗原修复处理,于37 ℃中进行一抗孵育2 h后,再孵育二抗30 min,使用DAB对组织进行显色5-10 min,再用苏木素复染(2 min),使用PBS缓冲液作为阴性对照。
1.6 PD-L1和PD-1基因real-time RT-PCR分析
取-80 ℃冰箱组织标本,加入液氮研磨,采用RNeasy Mini kit试剂盒从肺癌组织中提取总RNA,然后用PrimeScript RT Master mix进行逆转录,严格按照SYBR Premix Ex Taq Ⅱ说明书对生成的cDNA进行荧光实时PCR分析。PD-L1基因正反引物分别为5′-CATGACACA CCACCACCAGAGA-3′和5′-GGCATATAGAGGGCTCCACAA-3′,PD-1基因正反引物分别为5′-CCCCAAGGAAAAATCGAGGAG-3′和5′-GGGCGAGGGGCTGGGATATCT-3′,18S rRNA正反引物分别为5′-ACTACACACACCACCCA-3′和5′-ACACACACACACCCCCCA-3′。以18S rRNA为内参,根据Ct值计算相对表达量。
1.7 Western blot检测肿瘤细胞中PD-1、PD-L1蛋白表达丰度
取-80 ℃冰箱组织标本,室温解冻后PBS冲洗去除结缔组织,加入Cell Lysis Buffer,匀浆研磨后收集细胞蛋白样品,定量后取等量蛋白样品进行SDS-PAGE电泳分离、转膜,采用5%脱脂奶粉封闭1 h后分别加入(1 ∶500)稀释的PD-1 Rabbit mAb、PD-L1 Rabbit mAb,4 ℃孵育过夜。洗涤后加入HRP标记的羊抗兔二抗,室温孵育1 h后洗涤添加显色液,拍照后进行灰度值统计分析。
1.8 MTT法检测细胞增殖
取37 ℃、5% CO2培养箱培养的96孔板,每孔加入20 μl MTT溶液(5 mg/L)混匀继续培养4 h后终止培养,小心吸弃孔内上清夜,加入DMSO溶液150 μl/孔,震荡混匀,使晶状物充分溶解。选择波长570 nm,在30 min内于全自动酶标仪测定各孔吸光度值(A),分别检测0,24,48,72 h时细胞的吸光值。以所测A值为纵坐标,时间为横坐标绘制细胞增殖曲线。
1.9 流式细胞仪检测细胞凋亡
采用Annexin Ⅴ-FITC/PI凋亡检测试剂盒检测肺癌细胞A549细胞凋亡情况。取培养48 h后的3组细胞,离心洗涤后按照试剂盒说明书重悬细胞,加入5 μl Annexin Ⅴ-FITC震荡混匀,室温避光条件孵育20 min,然后再加5 μl PI染液,孵育5 min,立即上机检测。激发波长Ex=488 nm,发射波长Em=530 nm,细胞凋亡率为早期凋亡(Q4)和晚期凋亡(Q2)细胞所占的比例数总和。
1.10 统计分析方法

2 结果
2.1 PD-1、PD-L1 mRNA在肺癌组织中的表达
通过real-time RT-PCR法检测了30例肺癌组织和癌旁组织中PD-1、PD-L1 mRNA的表达情况。结果显示,肺癌组织中PD-1 mRNA、PD-L1 mRNA的表达均高于癌旁组织,差异均具有统计学意义(PD-1 mRNA:t=62.381,P=0.005;PD-L1 mRNA:t=47.971,P=0.008,见图1)。

与癌旁组织比较,* * P <0.01图1 PD-1、PD-L1 mRNA在肺癌组织的表达丰度Figure 1 Expression of PD-1 mRNA and PD-L1 mRNA in lung cancer tissues
2.2 PD-1、PD-L1蛋白在肺癌组织中的表达
Western blot检测肿瘤细胞中PD-1、PD-L1蛋白表达丰度,结果显示,PD-1、PD-L1蛋白在肺癌组织的表达均高于癌旁组织,差异均具有统计学意义(PD-1蛋白:t=65.642,P=0.005;PD-L1蛋白:t=61.253,P=0.006,见图2)。
2.3 厚朴酚下调肺癌细胞A549 PD-L1的表达
低剂量厚朴酚组和高剂量厚朴酚组蛋白的表达水平要低于对照组,差异具有统计学意义(低剂量组vs对照组:t=93.215,P=0.003;高剂量组vs对照组:t=58.32,P=0.008);低剂量厚朴酚组和高剂量厚朴酚组间PD-L1的表达,差异无统计学意义(P>0.05,见图3)。

与癌旁组织比较,* * P <0.01图2 肺癌组织中PD-1、PD-L1蛋白的表达Figure 2 Expression of PD-1 and PD-L1 proteins in lung cancer tissues
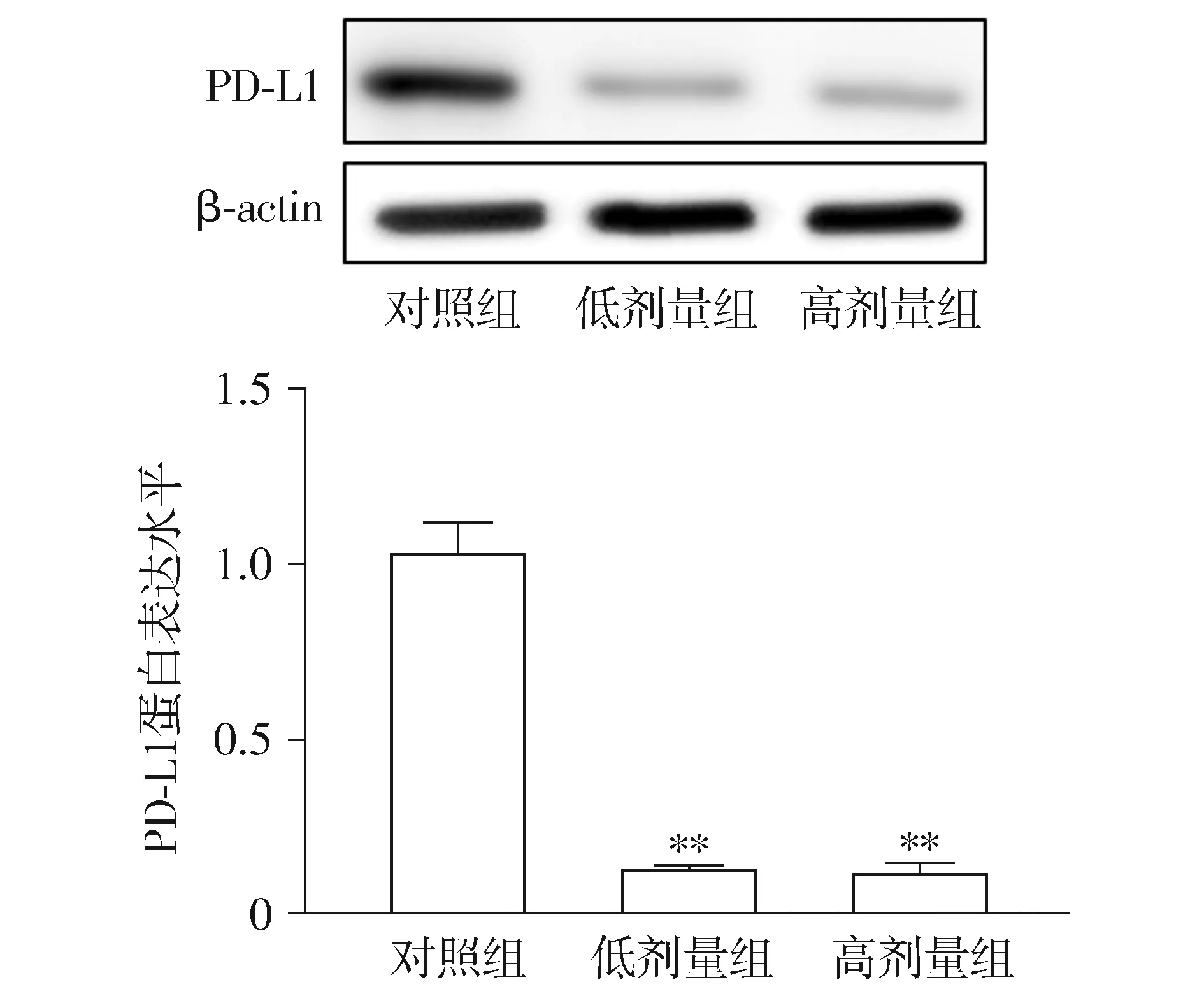
与对照组比较,* * P <0.01图3 不同处理后PD-L1在肺癌细胞A549中的表达Figure 3 Comparison of the expression of PD-L1 protein in A549 cells among different groups
2.4 厚朴酚抑制肺癌细胞A549细胞活力
与对照组相比,48 h和72 h时低剂量厚朴酚组和高剂量厚朴酚组肺癌细胞A549的吸光值显著降低,差异具有统计学意义(P<0.05,见表1)。
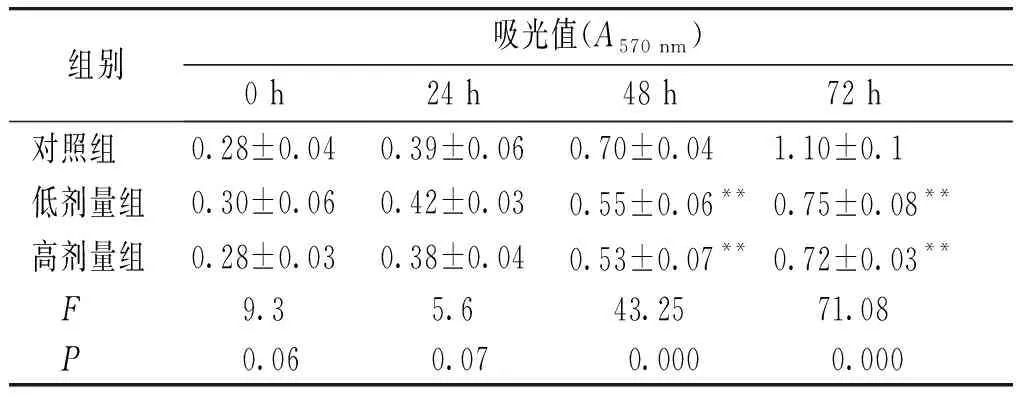
表1 不同剂量厚朴酚对肺癌细胞A549细胞增殖的影响
2.5 厚朴酚诱导肺癌细胞A549细胞凋亡
流式细胞仪检测肿瘤细胞凋亡的结果显示,对照组、低剂厚朴酚组及高剂量厚朴酚组肺癌细胞A549凋亡率分别为(1.21±0.15)%,(22.34±0.16)%和(19.13±0.12)%。与对照组比较,低剂量厚朴酚组和高剂量厚朴酚组的凋亡率升高,差异具有统计学意义(低剂量组vs对照组:t=77.182,P=0.005;高剂量组vs对照组:t=96.047,P=0.003,见图4)。

图4 厚朴酚对不同组肺癌细胞A549细胞凋亡的影响Figure 4 Effect of magnolol on apoptosis of lung cancer cells A549
3 讨论
厚朴酚是我国传统中药厚朴的主要活性成分之一,主要药理作用就是抗肿瘤,其抗肿瘤机制主要包括诱导肿瘤细胞的凋亡、抑制肿瘤细胞增殖和转移、逆转肿瘤细胞抗药性等。越来越多的证据表明,PD-L1在许多类型的人类癌症中得到表达,包括非小细胞肺癌[7-10]。PD-1/PD-L1免疫检查点抑制剂对多种恶性肿瘤均有疗效,被认为是NSCLC的标准治疗模式[11]。本文的研究结果提示厚朴酚具有抑制肺癌细胞A549增殖、促进其凋亡的作用,其机制可能是厚朴酚下调PD-L1的表达参与调控PD-1/PD-L1信号通路。
通过免疫组化的方法揭示PD-L1蛋白的阳性细胞主要定位在癌细胞和癌间质细胞的胞质和胞膜,而PD-1蛋白则主要定位在淋巴细胞胞质和胞膜[12],本研究采用RT-PCR以及Western blot检测了PD-L1和PD-1在肺癌组织和癌旁组织中的表达丰度,而在肺癌细胞A549中我们只检测了PD-L1的表达水平,PD-L1和PD-1在肺癌组织的表达与上述通过免疫组化的方法得到的结果是一致的。研究报道PD-L1在急性髓系白血病[13]、多发性骨髓瘤[14]、淋巴瘤[15]、间变性大细胞淋巴瘤和霍奇金淋巴瘤[16]中的表达是通过MEK-ERK或STAT3信号通路诱导的,在实体肿瘤中PD-L1的表达也被发现由于磷酸酶和紧张素同源物的功能障碍而激活PI3K-AKT通路而增加[17,18],本研究接下来将要论证PD-L1的上游调控通路以作为厚朴酚抗肿瘤机制的详细分子基础。王英泽等[19]发现一种由黄芪、金银花、野菊花、鬼针草、半枝莲以及甘草组成的中药复方可以下调脾脏淋巴细胞PD-1的表达,而对PD-L1的表达无明显影响。本研究发现厚朴酚可以下调肺癌细胞A549 PD-L1的表达,而厚朴酚对PD-1表达的影响未知,后续本研究将构建小鼠肺癌模型以探讨厚朴酚对PD-1表达的影响。PD-1或PD-L1的表达下调可以促进体内T细胞的活性从而促进T细胞介导的抗肿瘤免疫,减少肿瘤细胞的逃逸反应[20],我们采用低、高剂量的厚朴酚作用肺癌细胞发现厚朴酚下调PD-L1的表达,同时也检测了厚朴酚对肺癌细胞增殖和凋亡的影响,结果发现厚朴酚抑制肺癌细胞A549增殖并促进凋亡,提示厚朴酚抗肿瘤的作用可能是通过下调PD-L1的表达参与PD-1/PD-L1通路来实现的。细胞凋亡是由caspase蛋白水解酶参与的一系列级联反应的结果,厚朴酚可能通过下调PD-1/PD-L1发出凋亡诱导信号激活caspase级联反应,其具体机制仍需进一步的实验论证。
综上,厚朴酚可以下调肺癌细胞A549 PD-L1的表达,通过调控PD-1/PD-L1信号通络抑制肺癌细胞增殖并促进凋亡,本研究为我国传统中药厚朴酚用于治疗NSCLC提供了实验基础和理论支持,但其调控PD-1/PD-L1表达的具体机制以及下游调控细胞增殖和凋亡的具体机制仍需展开进一步的研究。

