宫颈锥切术后病理升级为宫颈浸润癌的危险因素分析
蔺茹 邵亚雯 傅文婷 李晓玉 郝圆圆 白岩 刘青
甘肃省妇幼保健院,甘肃 兰州730050
宫颈癌是女性第四大最常见癌症,全球每年新发病例约527 600例,死亡病例约265 700例[1]。与欧美国家相比,中国宫颈癌发病率相对较高,中国每年新发病例13.15万,宫颈癌死亡人数每年约5.3万,约占全部女性恶性肿瘤死亡人数的18.4%[2],而2019年美国新发病例仅1.3万人,占女性新发癌症的1.5%[3]。宫颈癌存在明确的癌前病变,积极治疗可有效减少宫颈癌的发生,组织学确诊的高级别鳞状上皮内病变(HSIL)
根据中国优生科学协会阴道镜和宫颈病理学分会(CSCCP)的推荐指南[4],建议积极处理,宫颈环形电切术(LEEP)作为其中一项非常有效的治疗方法[5],已在临床广泛开展。由于术前阴道镜下宫颈活检存在评估不到位、活检结果不准确等问题,HSIL患者将面临LEEP术后病检升级为宫颈癌的可能,导致术前准备不够、二次手术风险增加。因此,本研究分析了HSIL患者宫颈LEEP术后病理升级的相关高危因素,旨在帮助临床医生术前更好地评估病情,为HSIL患者制定适宜的治疗方式,提高医疗质量。
1 资料与方法
1.1 研究人群回顾性选取2019年1~6月在我院宫颈病变诊疗中心因宫颈病变行LEEP手术的患者共计797例,最终纳入本研究者608例,年龄21~76岁,平均(41.79±9.17)岁,绝经100例,未绝经508例,宫颈上皮内瘤变2(CIN2)患者277例,CIN3患者331例。根据术后病理结果是否升级为宫颈癌,将入选病例分为病例组54例和对照组554例。本研究经我院伦理委员会批准。纳入标准:①所有患者术前均经阴道镜下活检确诊为HSIL(包括CIN2及CIN3);②LEEP术前、术后宫颈组织学结果均符合2014版WHO病理的诊断标准;③所有患者均为首次行LEEP术;④临床资料完整。排除标准:既往宫颈手术史患者、妇科恶性肿瘤病史患者、LEEP术后病检CIN合并原位腺癌(AIS)、临床资料不完善者。
1.2 数据收集
1.2.1 一般情况。收集所有患者LEEP术前、术后宫颈组织学结果,并同时记录患者一般及手术情况,包括患者年龄、绝经与否、孕产次、液基薄层细胞学技术(TCT)、高危型人乳头瘤病毒(HR-HPV)、阴道镜情况(包括转化区类型、病变累及象限)、手术情况(切除标本长度、宽度)等。
1.2.2 TCT检查。细胞学分级参考2014年版TBS分类系统,包括正常范围的宫颈上皮细胞(NILM)、不典型鳞状上皮细胞(ASC-US)、不排除高级别鳞状上皮内病变的不典型鳞状上皮细胞(ASC-H)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)、宫颈癌(SCC)、非典型腺细胞(包括AGC-NOS以及AGC-FN)。
1.2.3 HPV-DNA检测。利用PCR+导流杂交法进行检测,可检测出14种HR-HPV分型(16、18、31、33、35、39、45、51、52、56、58、59、66、68型)和7种低危型HPV。
1.2.4 阴道镜检查及活检。所有患者术前均行阴道镜评估及活检,阴道镜检查指征遵照2017版CSCCP[4]要求,阴道镜检查的评估标准参照2011年版IFCPC阴道镜术语[6],阴道镜诊断分为正常、LSIL、HSIL、宫颈可疑癌;转化区类型分为Ⅰ、Ⅱ和Ⅲ型;病变累及象限分为1-2象限、3-4象限、累及颈管;在病变最严重的部位活检和(或)宫颈管搔刮术(ECC)。
1.2.5 组织病理学检查。送检的宫颈标本组织学诊断采用2014年第四版WHO分类,结果包括:良性病变(包括慢性宫颈炎、宫颈息肉、HPV感染相关性良性病变等)、LSIL(CIN1)、HSIL(包括CIN2及CIN3)、鳞癌、原位腺癌、腺癌和腺鳞癌等。
1.2.6 LEEP手术。手术均由固定的两名副高以上职称医师完成。宫颈表面用Lugol碘标记,切除范围达碘不着色区外缘3~5mm处;结合阴道镜图像,必要时宫颈管及周边组织补切,电凝切缘;术后切除标本均用刻度尺测量并记录,长度[7]指标本最远端(外界)至最近端(内界),厚度[7]指从切除样本的基底边缘至切除样本的表面(见图1)。若术后宫颈LEEP标本切缘可见HSIL以上病变或切缘与病变距离<1mm,定义为宫颈LEEP术后切缘呈阳性。

图1 切除组织大小的测量
1.3 统计学处理资料的整理采用Excel建立数据库后录入资料并进行逻辑核对,采用SAS 9.4对资料进行统计分析。计数资料的比较采用χ2检验,分别用单因素和多因素Logistic回归模型分析各种因素与病理升级组的关联强度OR,P<0.05为差异有统计学意义。
2 结果
2.1 宫颈HSIL患者LEEP手术后病理升级情况病例组中有4例阴道镜下活检为CIN2的患者病理升级为宫颈癌,其余均为CIN3升级为宫颈癌,其中,术后病检1例为浸润性腺癌,1例为腺鳞癌,1例为鳞癌合并原位腺癌,其余均为宫颈鳞癌。切除标本平均长度(1.629±0.397)cm,平均厚度(0.960±0.216)cm。
2.2 术后病理升级为宫颈浸润癌的单因素分析各研究因素赋值见表1。单因素Logistic回归分析发现,年龄>40岁、术前TCT为ASC-H或HSIL或SCC、HPV为16/18+、阴道镜诊断≥HSIL、病灶累及宫颈表面3~4个象限或累及颈管、转化区为Ⅲ型、术前病检累及腺体、标本长度>2.0cm、术后切缘阳性是术后病理升级为宫颈浸润癌的危险因素。见表2。

表1 各研究因素赋值说明

表2 术后病理升级危险因素的单因素Logistic回归分析[例(%)]
2.3 术后病理升级为宫颈癌浸润的多因素Logistic回归分析多因素Logistic回归分析发现,年龄>40岁、术前TCT为ASC-H或HSIL或SCC、HPV为16/18+、病灶累及宫颈表面3~4个象限、术前病检累及腺体、标本长度>2.0cm、术后切缘阳性为本研究中病理升级的独立危险因素。见表3。
3 讨论
3.1 阴道镜活检与LEEP术后病理升级为宫颈癌的关系Stuebs FA等[8]的研究表明,HSIL的阴道镜下检出率为88%。阴道镜诊断[9]宫颈癌的准确度为82.1%,敏感度为93.8%,特异度为71.4%,提示阴道镜下宫颈活检诊断尚存在一定不准确性。本研究中608例HSIL患者中,LEEP术后有54例(8.88%)升级为宫颈癌,考虑因LEEP相较于阴道镜活检而言[10],病变局部的取材广度、深度具有较大优势,因此对于阴道镜下宫颈活检提示为HSIL的患者,首选LEEP等切除性治疗,避免或慎重采用物理治疗,以免出现早期宫颈癌的漏诊,延误患者诊疗。
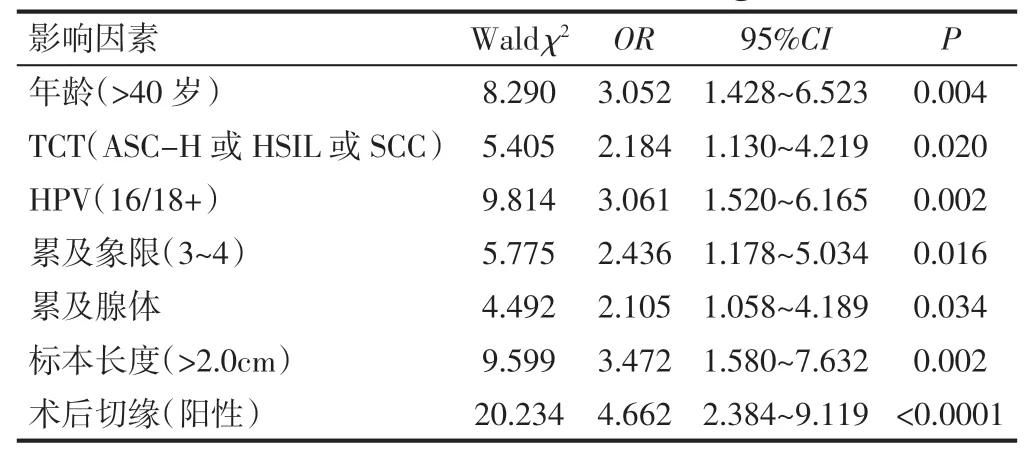
表3 术后病理升级危险因素的多因素Logistic回归分析
3.2 LEEP术后病理升级为宫颈浸润癌的危险因素分析
3.2.1 年龄。本研究显示,年龄超过40岁是宫颈LEEP术后升级为癌的独立危险因素。有研究认为[11],年龄超过40岁的女性,其阴道镜下宫颈癌好发部位(转化区)向颈管内移,而颈管为阴道镜检查的盲区,导致阴道镜难以发现可疑部位甚至漏诊宫颈癌,尤其是增加了早期浸润癌的漏诊率。因此,不建议年龄超过40岁的HSIL患者采用保守治疗,建议积极行LEEP等切除性手术治疗。
3.2.2 TCT、HR-HPV感染。目前研究认为宫颈细胞学级别越高,宫颈浸润癌的发生率也随之升高[12],本研究显示,患者术前TCT结果为ASC-H或HSIL或SCC是锥切术后病理升级的独立危险因素,与既往研究相符。HR-HPV持续感染是宫颈癌前病变和宫颈癌的主要致病因素[13],尤其是16型和18型,大约占据了宫颈癌的70%。有研究显示[14,15],HR-HPV感染与LEEP术后病理升级无关,但也有研究[16]表明术前HPVDNA同病理升级有密切关联,不同于以往研究,本研究从HPV型别角度去分析其与病理升级的关系,并且显示HPV16/18+是宫颈LEEP术后升级为癌的独立危险因素,钟继生等[17]的研究认为,说明HPV16、HPV18感染与宫颈癌变存在相关性。也从侧面反映了HPV16、HPV18感染是诱发宫颈癌的因素。
3.2.3 阴道镜下累及象限、术前病检累及腺体、切缘阳性。本研究显示,病灶累及宫颈表面3-4象限、术前病检累及腺体、切缘阳性为本研究中病理升级的独立危险因素,提示患者术前病情较重,病变范围大,阴道镜下活检漏诊的可能明显增高,导致LEEP术后病理升级为癌概率增高,该结论与袁赟[15]等研究结果一致。
3.2.4 LEEP标本长度。本研究显示,LEEP标本的长度大于2.0cm为本研究中病理升级的独立危险因素(OR=3.472),这可能与切除深度达2.0cm以上时,多为宫颈3型切除,切除的组织大且长[7],包括阴道镜观察不到但有诊断意义的宫颈管上皮,从而发现更多的隐匿性癌症病灶。由此推测,当切除深度<2.0cm时,漏诊隐匿性癌灶的风险增大,故对切除深度<2.0cm的患者,术后需联合宫颈细胞学、HPV基因分型和阴道镜密切随访。综上所述,临床医生对合并龄>40岁、术前TCT为ASC-H或HSIL或SCC、HPV为16/18+、病灶累及宫颈表面3~4个象限、术前病检累及腺体、标本长度>2.0cm、术后切缘阳性等高危因素的HSIL患者时,在术前沟通、手术方案的选择上要更加慎重,手术医生在进行LEEP手术前,面对合并以上高危因素的HSIL患者时,应根据情况适当扩大切除范围,以免漏诊宫颈癌的患者。本研究仅为单中心的回顾性研究,存在样本量相对不足、研究性质相对局限的问题,有待后续进行多中心、前瞻性研究进一步探讨。

