细菌群体感应元件构建和工程应用
周爱林,刘奕,巴方,钟超,3,4
(1 上海科技大学物质科学与技术学院,上海 201210; 2 上海科技大学生命科学与技术学院,上海 201210; 3 中国科学院深圳先进技术研究院,深圳合成生物学创新研究院,中国科学院定量工程生物学重点实验室,广东 深圳 518055;4 中国科学院深圳先进技术研究院,深圳合成生物学创新研究院,材料合成生物学中心,广东 深圳 518055)
1 群体感应的现象发现及概念提出
1965 年,Tomasz 等[1]发现一种特殊的小分子能够诱导改变细菌的群体性行为,这一现象表明细菌个体或种群之间可能会通过某些特殊的分子实现内部的信号交流。十多年后,随着对费氏弧菌(Vibrio fischeri)自发产生荧光现象的深入研究,研究人员解析出该菌群内部信号物质的分子化学结构[2],并鉴定出其相应的调控基因及下游代谢产物[3],这些研究进一步佐证了细菌种群可利用小分子对群体行为进行调控的猜想。1994 年,群体感应(quorum sensing, QS)的概念被Fuqua等[4]首次提出,时至今日,群体感应作为一种重要的基因调控机制,已被包括合成生物学在内的生命科学领域广泛研究并运用。现在普遍认为群体感应是细菌通过自体诱导物(autoinducer)的产生、感应和反馈而产生的群体间化学信号交流的过程,它使细菌能够根据种群密度变化和附近细菌种类组成,同步化群体行为[5]。群体感应在革兰氏阴性菌和革兰氏阳性菌中有着不同的作用机理。在革兰氏阴性菌中,最常见的自体诱导物为AHLs分子,其包含一个核心的N-酰基高丝氨酸内酯环和一个被修饰的C4~C18的酰基链。自体诱导物需进入细菌,与胞内的感受器作用,进而诱导群体行为变化[6]。而革兰氏阳性菌有两类主要的群体感应自体诱导物:一类是长链或被修饰的肽段,其感受器为细菌的膜受体;另一类为未被修饰的短肽段[7-8],可与细胞质内的感受器相互作用。感受器位置的差异,可能意味着相应群体感应机制具备不同的应用场景。
群体感应效应能够控制同一菌种内的多种群体性行为,如毒力因子的分泌[9-11]、生物被膜的形成[12-13]、DNA 的转化[14]以及抗生素[15]或抗性的产生[16-17]等。此外,不同菌种的群体感应现象也逐步被发现,研究内容涉及自体诱导物的种类、结构、作用机理[6]和工作距离[18]等。图1 简单列举了群体感应自发现以来的一些事件和研究。
2 群体感应系统
在构建基因回路以实现不同应用时,天然群体感应系统可能由于各种局限性而不能满足研究人员的需求,因此对群体感应基因模块的理性设计就显得至关重要。通过对相关细菌基因元件的模拟、优化和模块化,研究人员可以构建丰富的群体感应基因元件库,并根据实际应用构建不同强度、不同调控机制的群体感应系统,以实现多样的功能与应用。
2.1 群体感应系统的开发

图1 群体感应的提出及研究进程[1-4,15,19-23]Fig.1 Research progress of quorum sensing[1-4,15,19-23]
群体感应的实质是某种持续性分泌的自体诱导物积累达到阈值后启动细菌特定基因的转录表达。群体感应现象一般需要满足两个要素:一是自体诱导物的浓度与细菌种群密度成正相关;二是一定浓度的自体诱导物达到某一阈值后激活细菌的某些特殊基因并实现群体行为改变。基于此,群体感应系统的设计也分为两步:一是筛选合适的小分子作为自体诱导物;二是通过工程改造使该信号分子调控胞内的基因转录表达。例如,Liu等[24]设计了一种类群体感应系统,工程改造的大肠杆菌能够以自然代谢产物H2S 作为自体诱导物,实现种内群体交流。在该工作中,H2S 作为大肠杆菌的天然代谢产物,浓度与种群数量成正比关系;同时,重组醌氧化还原酶被引入细菌,可催化H2S形成与CstR转录阻遏因子相互作用HSnH分子,进而启动下游CstR调控的基因环路。而在真核生物中,群体感应元件的设计原则依然适用。Chen 等[25]利用酵母表达来源于拟南芥的一种植物激素细胞分裂素(IP)作为自体诱导物,使其激活酵母内源的磷酸化信号通路,调控胞内基因表达,从而构建出第一套真核生物的群体感应体系;此外,还有团队以酵母交配使用的信息素作为自体诱导物,设计出受此信息素调控的基因回路,调控基因表达,实现了酵母细胞中群体感应元件的构造[26]。这些研究表明,可以利用不同物种的基因元件,对原有代谢通路进行改造修饰,如图2所示,最终实现与天然群体感应一样的功能,而群体感应元件库的丰富将为相应的科学应用提供广阔的技术平台。
2.2 群体感应系统的优化
既有的群体感应系统可能无法满足不同实验中的需求,故而需要对群体感应系统进行优化。如图2所示,群体感应系统的优化可从蛋白和基因两个角度着手。
一方面,蛋白水平的优化主要通过定向进化或者计算模拟设计实现。以一种应用较为广泛的群体感应元件esaI-esaR 为例,EsaR 能够针对不同启动子同时起到激活和抑制基因表达的效果[27-28]。然而该元件对于自体诱导物的敏感性非常低,根据定向进化设计原理,研究者首先通过易错PCR建立目的蛋白的随机突变库,再设置特定条件进行筛选,重复多次后,成功提高了EsaR 对于自体诱导物的灵敏度,且筛选、表征了一系列不同响应水平的EsaR 群体感应元件以满足不同感应强度场景的需要[29]。

图2 群体感应系统的开发与优化Fig.2 Development and optimization of quorum sensing systems
另一方面,基因水平的优化方法多样,可以通过改造启动子、改变元件拷贝数目、调节核糖体结合位点的强弱等方式实现[30]。仍以esaI-esaR为例,Shong 等[31]对EsaR 结合的PesaR启动子进行了改造,通过在启动子上添加多个EsaR 结合位点,实现了启动子对EsaR 的灵敏度的调节,使得改造后的几种启动子能够对同一个信号强度产生不同的表达强度。之后的研究在启动子后添加操纵子,如乳糖操纵子(lacO),使其群体感应强度能被更灵活地调控[32]。除了对群体感应强度进行优化与调控外,还可以通过基因水平的回路设计与改造,精确调控群体感应系统的启停。Williams 等[26]将群体感应中自体诱导物的启动子替换为外源分子调控的诱导型启动子,通过外加特定的诱导物开启群体感应,可以实现对群体感应单次开启的调控。Miano等[23]通过构建基于诱导物的酶促反应链,可以搭建调控严谨且能多次开关的群体感应(iQS)系统。这个系统中,自体诱导物是一种酶,能够将人为添加的诱导物转化成最终能够激活群体感应的小分子。因此在添加一定量的诱导物后可基于加入量来启动不同强度的群体感应响应,又由于酶促反应对诱导物的不断消耗,使得诱导在持续一定时间后停止,实现基因回路的多次可控启停。
以上一系列的研究提出了多种群体感应系统模块的构建思路,为其在合成生物学中的广泛使用奠定了基础。而在利用这些模块构建复杂基因回路时,可以通过数学建模的方式对元件的效果做出一定预测。在这个过程中,如何提高预测的准确性是一大难点[33],需要各个元件全面详细地表征数据,还需要对系统内部噪声和异质性进行处理[19]。值得注意的是,尽管单个元件的功能已经被研究和表征得十分详尽,当多个元件组合在一起的时候,其功能会产生一些意料之外的影响,而这些影响往往与细胞内的热力学因素和进化因素有关[34]。这种影响一方面可能为基因回路的构建带来困扰,但另一方面也可能创造出更多的应用可能性。
3 群体感应基因元件的工程应用
群体感应基因元件作为细菌间的一种信息交流工具,能够很好地调控细菌的群体行为。针对其信息交流的特点,Tabor 等以及Tamsir 等[33,35]利用群体感应中涉及的信号分子构建了多细胞逻辑门,使得信号能在不同细胞间传递,完成较为复杂的逻辑运算。此外更多的研究倾向于利用其调控群体行为的特点,将其应用于工业生产、医学治疗、生物检测等方面。
3.1 种群内群体感应行为调控
3.1.1 动态代谢调控
群体感应能够使细胞在达到一定种群数量后改变群体的基因表达,这个特点与发酵工程对动态代谢产物调控的需求相契合。在传统发酵工程领域,工程师通常会对细菌内部的代谢途径进行一系列的删改,目的是最大化目标代谢产物的生产效率。然而,在这一过程中,改造的代谢途径可能会对细菌自身生长产生代谢压力甚至是细胞毒性[36-38],因此需要合理的代谢优化以保证细胞在“生长”与“生产”两相之间进行适时的转变。在实际操作中,通常采用在特定时间点添加诱导剂的方式,确保细菌种群达到一定数量后产生目标产物,保证产量。但是,使用诱导剂存在一些缺陷,比如诱导剂成本较高[39],并不适合大规模的工业生产使用[24];化学诱导剂有不可逆性,一经添加便会一直存在于介质中,只能起到单次控制的效果[40];此外,因为需要实时监测细胞生长状况,并在合适的时机添加诱导剂,导致步骤较为烦琐等。这些缺陷给传统合成生物学的工业化造成了较大的障碍。
在此基础上,Gupta 等[41]构建了动态调控系统,但这种方法需要针对所构建的不同代谢过程分别寻找受相应代谢小分子调控的启动子,而找到的启动子却又常常不具备合适的表达强度,加大了工作量与难度。针对这种情况,有学者开始使用群体感应元件构建动态调控系统,即通过群体感应改变细胞内的基因表达,从而保证生长与生产两种模式的转变。Kim 等[42]指出,与化学诱导的系统相比,群体感应调节的系统能够更好地让体系中的细胞做出统一的反应与改变。通过群体感应实现自动的两相发酵,即让细菌生长到一定程度自动进入生产模式,其木糖酸的产量能与化学诱导法达到同一水平[24];通过luxI-luxR 群体感应系统构建的生产甜没药烯(bisabolene)的动态代谢调节,使产量比之前的诱导体系增加了44%[43]。而相比luxI-luxR 等系统而言,esaI-esaR系统能够针对不同启动子同时起到激活或抑制基因表达的作用,更好地实现代谢重分流的效果[44-45]。在单一群体感应系统的直接应用之外,Jiang 等[46]在一个细胞中尝试构建了las 和tra 两个完全正交的群体感应系统,使其中一个系统位于另一个系统的下游。通过这种设计,两个群体感应系统控制的不同基因能够按照一定时间顺序依次表达。这项研究对于一些更为复杂的代谢分流过程有着很大的应用价值。表1比较了化学诱导与群体感应在代谢调控中的应用。
同时,由于生产发酵过程需求的复杂性,群体感应的动态调节体系可以与其他调控体系结合,构成逻辑门,从而对生产过程取得更精准的调控。比如,细胞所处在的生长状态如对数期、平台期等也会对细胞的生产效率产生很大的影响[47],而细胞生长状况与细胞种群数量并没有绝对的关联。基于此,He 等[48]将群体感应与压力感受系统结合,形成逻辑“与”门(AND)。群体感应系统用来保证细胞的种群密度,压力感受系统能够很好地反映细胞所处的生长状态,这两者保证细胞的种群密度达到一定标准且细胞生长状态处于平台期时,自动进入生产状态。
单纯的群体感应系统实现的自动代谢调节虽然能很好地实现对“动态”的需求,但在手动可控性上仍然有欠缺[36]。Williams 等[26]成功将自动调控和手动调控紧密结合,实现可控的自动调控体系。该简单组合方法使用了一种能够响应介质中芳香族氨基酸的ARO9 启动子表达自体诱导物,使得群体感应功能能够根据芳香族氨基酸的种类和浓度发生改变。这项研究虽然是在真核酵母中进行的,但可以在原核生物设计中借鉴思路。此类额外的设计可能会导致工业成本相对增加,但优点是不需要通过烦琐的元件改造,就能直接对群体感应强度起到调控作用,从而使群体感应的动态调控体系在工业生产中取得更灵活的应用。
3.1.2 群体周期性行为控制
群体感应的另一大特点是对细胞群体的同步作用,这使得群体感应可以与单个细胞中作用的回路结合,将回路所控制的单个细胞的行为扩展到整个群体当中,产生相应的群体行为。其中,最为突出的是群体感应对群体同步周期性行为的实现。
相比稳定不变的系统来说,周期性振荡系统蕴含着更多的信息,因此可以在信息的接受、传递上发挥更多的功能。同时,相比于通过信号强度传递信息,通过振荡频率传递的信息也更为稳定可靠。例如,通过信号强度如荧光强度传递信息,不同测量仪器会给出不同测量结果,为使结果标准化,需要对不同仪器进行校准,非常烦琐;但若测量振荡频率则不会出现类似的问题[30]。另外,周期性的行为还能保证系统不过载,适应多种需求。为了让细胞呈现出周期性行为,原则上会设计负反馈回路[49-50],达到一盛一衰的振荡效果。而现已有多种回路可以实现振荡行为,如三元抑制回路,通过三个小分子循环式相互抑制,在原理上形成一个负反馈回路[51];二元振荡回路,让激活剂在促进自身抑制剂表达形成负反馈的同时,促进自身进一步表达,实现正反馈与负反馈的耦合,促进振荡的信号进一步加强,使振荡回路不易受外界噪声干扰[52-54];还有五元抑制回路等[55]。图3 列出了这些基因回路。

表1 化学诱导与群体感应在代谢调控中应用的对比[23-24,26,39-40]Tab.1 Comparison between chemical inducers and quorum sensing on their application in metabolic regulation[23-24,26,39-40]
但是,以上振荡基因回路只能在单个细胞中发挥功能,当上升到群体层面时,不可避免地会因为不同细胞之间的异质性,逐渐趋于混乱[51];而在现实生活中,细菌通常是成群出现的。这使得单个细胞周期性行为的应用受到很大的限制。在振荡回路的基础上引入群体感应元件,可以使振荡行为在整个细胞群体呈现出一致的周期性。如图4所示,这些尝试总体上分为三种思路。
思路一将二元振荡回路与一个群体感应元件直接结合,使得振荡回路中的激活剂在激活自身和抑制剂表达的同时,激活群体感应分子的表达,而群体感应分子会进一步激活激活剂自身的表达。从原理上讲,该方法是在原有正负反馈联合的基础上,增加了一个正反馈。Mcmillen 等[19]通过数学建模,证明其的确能够起到群体内的共同振荡效果[图4(a)]。不过,仅仅靠建模证明其有效性还是远远不够的,其具体表现还需要通过进一步实验验证。
思路二直接利用群体感应元件设计二元振荡回路,用自体诱导物作为激活剂,使其在达到阈值后同时促进自身分子和其抑制剂的产生。根据这个思路,有学者使用luxI-luxR 的群体感应系统,以luxI 基因产生的自体诱导物AHL 作为激活剂,以能够催化AHL 降解的AiiA 作为抑制剂,构建出能够周期性产生荧光的细菌群体[图4(b),图4(d)],研究同时指出,通过调整群体感应元件的强度,能够产生不同的振荡频率[20-21]。这也很好地验证了群体振荡传递信息的可行性,如用作新型生物感受器。尽管该系统能够实现群体行为同步化,这个群体仍被限制在很小的空间范围内。超过一定的空间距离,群体感应分子无法及时到达,会造成信号延迟甚至同步失败。为解决此问题,Prindle 等[30]将信号强却仅适用短程传输的群体感应系统与信号弱却适用远程传输的氧化还原信号系统结合,利用过氧化氢气体快速的传播能力,实现了更大范围群体的同步周期性行为[图4(b),图4(e)],并提高了周期的时间精度。基于新的系统,该团队开发了一种砷元素感受器,能够较为精准地反映环境中砷的浓度,并由上百个小菌落组成的阵列通过不同的振荡频率表现出来。
思路三以思路二为基础,使用裂解自杀基因代替抑制剂,最终实现种群数量的周期性变化。这种回路被称为SLC(synchronized lysis circuit)回路[21],其特点是当细胞数量达到阈值后,激活裂解自杀基因的表达,细胞数量迅速减少,此后少量残留的细胞重新增殖,进入下一个循环。这个回路能够很好地防止细胞过度增长,并且能够周期性地释放细胞中的内含物[图4(c),4(f)]。近几年,活菌治疗的概念在不断普及,而这种治疗方法有两个重点:一是需要能通过释放药物等方式起到治疗效果;二是尽可能减少细菌在人体中可能造成的副作用[58],包括防止细菌过度增殖造成体内感染[59]等。通过在细菌中结合SLC 回路和小分子药物如溶血素、CD47 的纳米拮抗剂、CCL21 等的合成,科学家们在小鼠体内实现了周期性给药,并很好地抑制了肿瘤[21,57]。
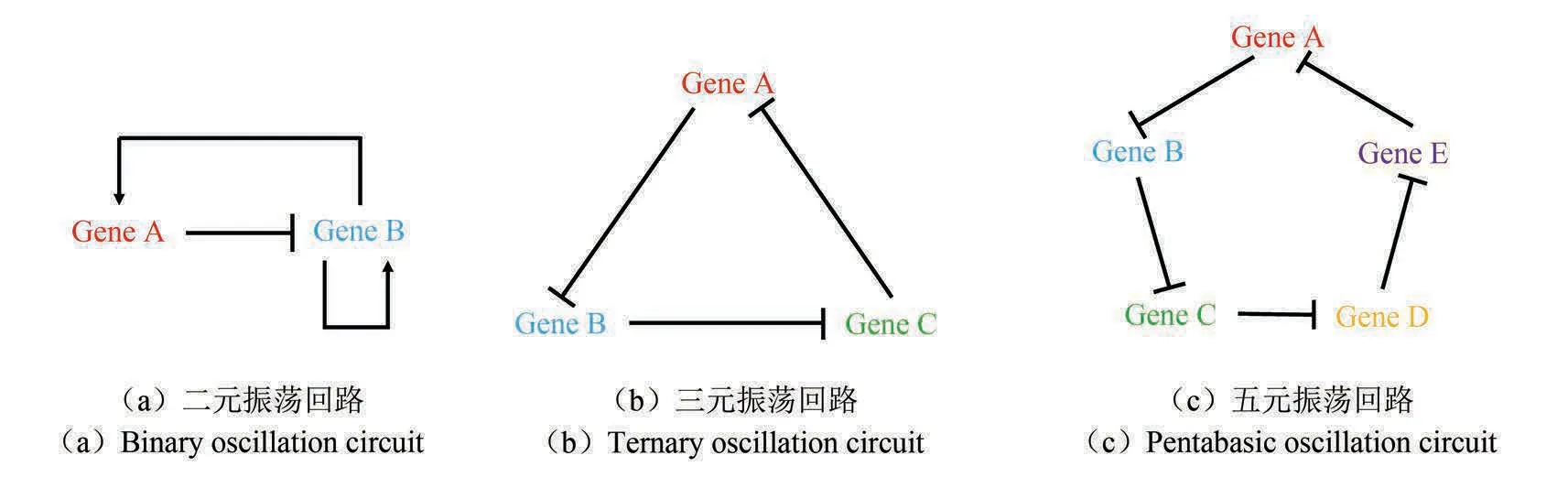
图3 三种典型的基因回路用于调节细胞振荡行为Fig.3 Three typical gene circuits used for regulating intracellular oscillation behaviors

图4 三种典型思路用于构建多细胞振荡体系[30,56-57][(a),(b),(c)分别对应三种振荡回路与群体感应结合的思路;(d)利用群体感应形成规律图案[基于思路二构建的系统,通过群体感应,自体诱导物AHL 的浓度周期性到达阈值,而菌落边缘的细菌有更强的基因表达能力(表达荧光蛋白),两者构成AND 逻辑门,使菌落呈现出规律的图案];(e)实现更大范围群体周期性行为的同步;(f)利用群体感应实现的震荡系统治疗癌症]Fig.4 Three strategies for construcling multicellular oscillation systems[30,56-57][(a), (b) and (c) refers to each of the three strategies for combining oscillation circuit with quorum sensing.(d)Forming regular pattern using QS.By using method B,autoinducer concentration periodically reaches the threshold.Since only bacteria at the edge of the colony have higher gene ex‐pression (like the expression of fluorescent protein),an AND logic gate is constructed to make the colony show rhythmic pattern.(e)Realiza‐tion of the collective oscillation in a bigger range.(f)Employment of QS oscillation system in cancer treatment]
3.2 种群间群体感应行为调控
在自然界中,细菌并不以单一种群独立存在。不论是在大气、海洋、土壤中,还是在生物体内,微生物都以多个物种共生的方式生存在一起,彼此之间形成复杂的种群关系。为了更好地利用微生物,不仅需要调控同种菌种之间的行为,更要对不同微生物菌群之间的关系进行有效的控制,从而在共生菌群之间实现化学反应和基因调控等方面的分工合作[60],最终实现合成生物学在人体健康、环境、能源、农业等方面更广泛的应用[61]。在这一方面,种群之间存在的群体感应元件被认为是构造异种菌体系最有前景的基因元件之一[62]。
为了实现菌群间复杂的信号交流,通常需要结合多套群体感应体系,构建逻辑基因回路,使异种菌间产生稳定的种群关系。比如,Chen 等[63]报告通过整合两套群体感应体系,构建了由激活型菌与抑制型菌组成的混合细菌群,使两个不同基因组成的细菌群体在基因表达上产生相互依赖的同步振荡[图5(a)]。
由于每种菌中都使用了多套群体感应系统,不同群体感应系统之间的正交性非常值得关注。不同的群体感应系统在体系中可能发挥了不同的促进或抑制作用,如果不同系统的群体感应分子产生交互的影响,很有可能导致系统的结构性崩溃。只有保持足够的正交性,才能保证种群关系的稳定性,防止某一菌群脱离系统[64]。为了获得更多有足够正交性的细菌间信号交流系统,Du等[65]从头设计了十种类似群体感应的信号交流系统,规避了天然群体感应由于信号分子结构类似而产生的相互干扰。但也有学者认为,不完全正交性可以为所构建系统的复杂性提供更多可能[66]。
在构建由异种菌组成的系统时,一个不可避免的问题是如何防止体系中任意一种菌的过度生长,从而保证每一种菌都能够长期稳定存在于系统中[67]。有学者通过模拟自然生态系统中的物种间关系,构建不同菌之间的生长关系。最经典的是早期对捕食与竞争的种间关系的模拟,研究者很好地抓住了这种关系的特点,即“捕食菌”促进“被捕食菌”死亡,而“被捕食菌”抑制“捕食菌”的死亡,利用群体感应构建了相应体系,从而使两个菌群在数量上呈现此起彼伏的关系,使得两种菌能够长期在系统中共存[图5(b)][68]。这种利用生态学种间关系的设计原理为之后的研究提供了很好的思路。例如,2018年,Kong等[69]利用乳酸乳球菌(Lactococcus lactis)的群体感应分子和抑菌分子,即乳酸链球菌肽(nisin)和乳球菌素A(LcnA)的合成通路,对已有信号通路重新设计,在两种菌之间成功构建出多种种间关系,开发出可长期存在的异种微生物群体[图5(c)]。该文章还通过数学建模的方式证明有希望通过群体感应系统调控三种菌之间的相互促进或抑制关系,从而维持三种菌的数量分布。与上述思路不同,Scott等[66]尝试分别在每种菌中独立使用了SLC 回路,异种菌彼此有独立的群体感应系统,几乎完全正交,互不干扰。通过调整异种菌各自的SLC回路参数,最终实现两种菌的共培养。尽管建模数据显示可以实现不同模式的种群数量振荡,实验数据却没有很好地展示,可见完全独立无交流的异种菌系统在实验中完全实现仍是一大挑战,但如果后续研究能进一步实现上述所谓的完全正交体系,则能大大简化异种菌系统构建工作。
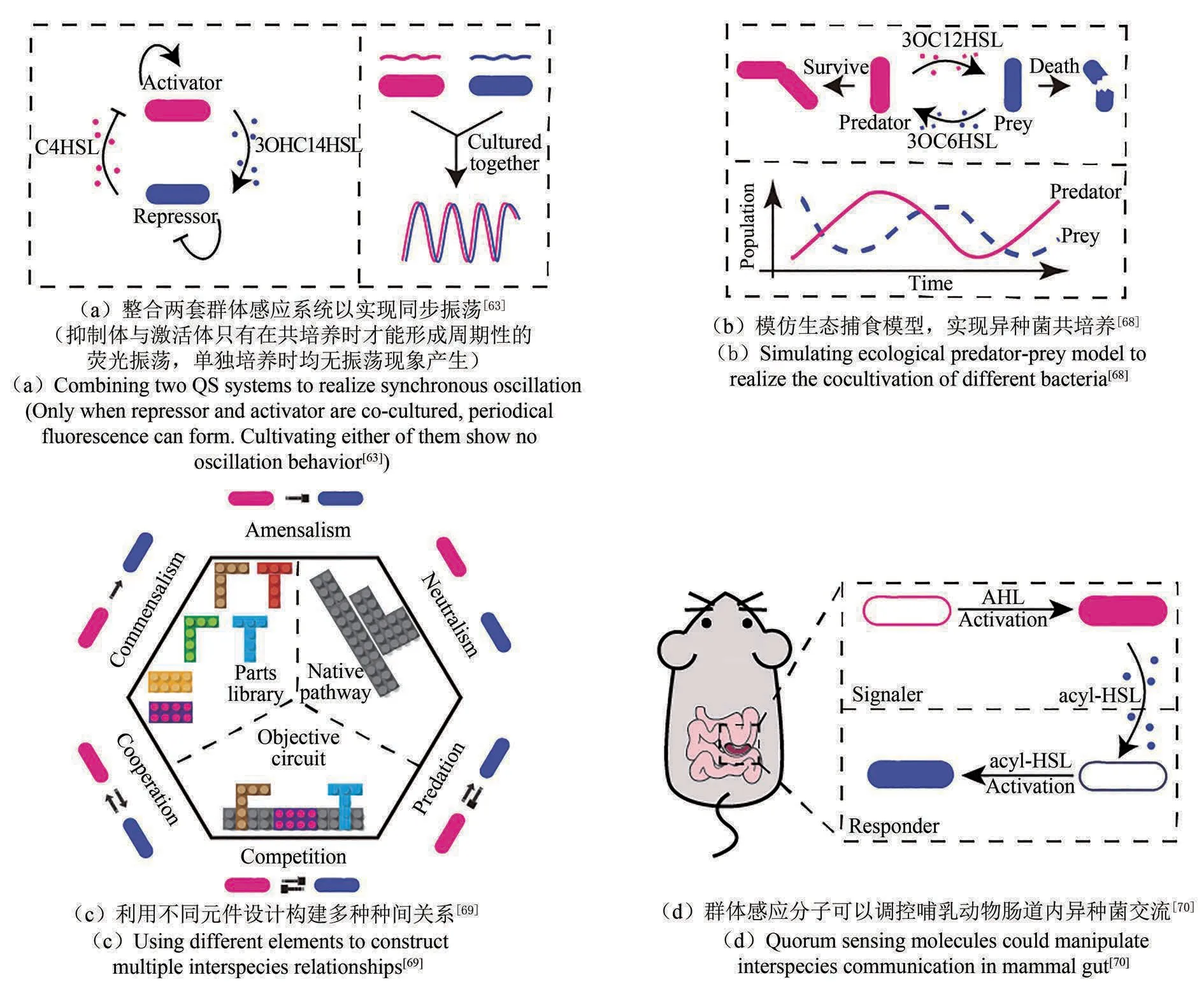
图5 微生物复杂种间关系的构建案例[63,68-70]Fig.5 Cases of the construction of complex bacterial interspecific relationship[63,68-70]
在实验室中实现的异种菌间关系调控能否在真实环境中发挥预估的功能决定了菌群的实际应用效果。最近Kim 等[70]成功在哺乳动物肠道内引入群体感应体系实现鼠伤寒沙门氏杆菌和大肠杆菌的信息交流,证明了调控哺乳动物肠道内异种菌交流的可能性[图5(d)]。
随着调控越来越复杂,需要控制的细菌范围也相应扩大,然而,像上一部分所提到的结合气体分子构造的群体感应体系[30],在复杂真实的环境中并不适用。为了解决这一问题,有学者将研究重点放在了群体感应内在的信号反馈结构上,并证明利用合适的正反馈回路能够及时地放大群体感应信号,从而保证在更大范围内群体感应交流的顺利进行[60]。
4 展 望
伴随着对群体感应的理解逐渐深入,人们对于群体感应的应用不再局限于自然的体系。研究人员正从合成生物学的角度,理性地构造、优化、组合不同的群体感应基因元件。同时,研究人员将这些元件进行模块化整合,并运用到动态代谢调节、周期性振荡的呈现、异种菌种间关系的构建等。这些元件在医学治疗、工业生产和生物感受器方面发挥了较为重要的作用。此外,群体感应凭借其介导细菌间信号交流的优秀能力,也成为构建细胞逻辑门中的重要元件[35],为复杂生物计算提供了很好的平台。而在材料科学方面,群体感应也有很多可能的应用,如通过将群体感应的拮抗剂结合在材料表面发挥抑菌作用,或利用群体感应指导生物材料的生产等[22,71-72]。
随着对群体感应的研究不断深入,人们对于群体感应的应用越来越灵活,为了实现更智能、更复杂的功能,基因回路的设计趋于复杂化;然而当构建的回路应用到生物体内时常常会因周边环境的改变而变得无效,这也是整个合成生物学基因回路设计当中经常面临的问题[73]。更值得关注的是,即使在实验室中验证可行的回路,在工业中仍有较高的失败率[74],较短的反应时间、可逆的响应以及基因在微生物中的稳定性对于基因回路能否在工业中成功应用起到决定性作用[43]。群体感应在前两点上占有较大的优势,但在稳定性方面面临很多挑战。现有应用的群体感应系统为了满足功能上的需求,通常会给宿主微生物造成一定的生存压力,在此情况下,如何保证微生物长期保有稳定的群体感应基因回路显得至关重要。为了防止群体感应回路基因的丢失,学者常常会采取多质粒相互稳定或整合基因组的方式。有学者指出,通过对载体微生物的修饰和对基因序列的优化,可以有效达到降低基因突变率的效果[75],此方法可以应用于群体感应基因的优化。
以上方法值得进一步探索和发展,另外,在建立复杂回路的过程中,已经有学者开始从工程结构入手研究群体感应,帮助理解复杂群体感应系统[76]。正如Meng等[77]在一篇评论中所提到的,合成生物学发展的第一个十年主题在于合成,而其发展的第二个十年主题在于理性设计。随着机器学习等计算机领域的技术发展,未来有可能更多地借助计算机对复杂基因回路进行理性设计和优化,或通过计算机辅助的蛋白质设计、定向进化等方法,获得更高效的群体感应基因元件。数学、物理、计算机等多学科的结合,将为复杂回路和多细胞群体体系的构建提供巨大便利。而通过研究和构造这样的多细胞体系,也能够帮助我们理解自然中一些规则图案的形成模式,同时也为组织工程、生物活体功能材料构造和生物传感器等方面的研究提供新思路[78-79]。

