合成生物学助力废弃塑料资源生物解聚与升级再造
钱秀娟,刘嘉唯,薛瑞,刘豪杰,闻小红,杨璐,徐安明,许斌,信丰学,2,周杰,2,董维亮,2,姜岷,2
(1 南京工业大学生物与制药工程学院,江苏 南京 211816;2 南京工业大学材料化学工程国家重点实验室,江苏 南京 211816)
塑料是重要的基础材料,为人类生产和生活带来了极大的便利。2019 年,全球塑料产量达3.68 亿吨,相比2018 年增加900 万吨[1]。随着塑料应用领域的拓宽和使用量的急剧增加,废弃塑料不合理处置导致的“白色污染”问题已越来越被社会所关注。截至2018 年,全球累计产量已超过90 亿吨[2]。而其中70%的塑料垃圾被填埋或者遗弃,11%被焚烧处理,只有19%的废塑料被回收利用[3]。如图1 所示,根据再生塑料资讯(CPRA)报道,2019 年中国产生废塑料6300 万吨,其中填埋量为2016 万吨,占比32%;焚烧量1953 万吨,占比31%;遗弃量为441 万吨,占比7%;回收量为1890 万吨,废塑料总体回收率为30%[4]。此外,全球每年有约800 万吨的塑料进入海洋,导致海洋动物吞食大量塑料微粒而死亡,这些塑料微粒甚至会通过海产品、海盐等途径富集到人体,最终威胁人类健康[5-6]。
开发废弃塑料资源回收利用技术是解决“白色污染”问题的重要途径。当前回收塑料的处理方法主要有填埋、焚烧、再生利用和塑料油化[7-8]。填埋法是处理废塑料的最常用方法,我国每年有约1400 万吨的废旧塑料被填埋处理。然而废塑料在自然环境下很难被降解,塑料中的增塑剂和添加剂渗出导致严重的土壤和水体污染;焚烧法可以回收大量的热量,且焚烧后的废旧塑料体积会减少90%以上。然而,焚烧产物除了CO2和水外,还会产生多环芳烃化合物、酸性化合物等有害物质,造成严重的大气污染;再生利用法采用机械回收处理塑料废弃物,使其还原为类似的塑料产品进行循环使用。但是简单再生获得的塑料制品性能不高,且机械回收处理塑料废弃物需要耗费大量能源和人力资源,回收工艺复杂;塑料油化通过加热使塑料中的C—C 键发生断裂,同时伴随着C—H 键断裂,产生的自由基继续通过各种组合反应生成不同小分子烃类物质,为各种化工产品提供基础原料。但是,热解处理对塑料废弃物的清洁度、品质均匀性和化学试剂有较高要求,而实际回收过程中各种类型的塑料通常混合在一起,各批次的废塑料原料类型很难统一,这就对热解工艺、催化剂的实用性、活性和稳定性提出了很高的要求。综上而言,应用这些物理和化学方法对塑料的回收或是效率普遍偏低,或是回收过程是一种降级循环回收的路线(downcycling),经济性差,并且存在严重的环境二次污染问题。
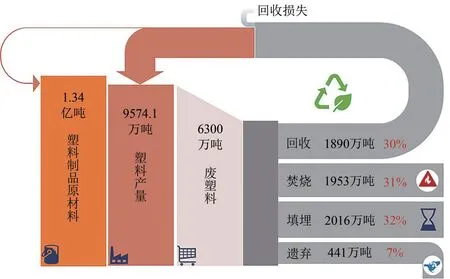
图1 2019年中国废塑料处理情况[4]Fig.1 Fates for China's waste plastics in 2019[4]
回收手段的局限性成为限制塑料回收的主要因素。近年来,探索塑料废弃物生物降解回收技术成为国内外研究的热点[9-10]。利用合成生物学思想构建具有生物解聚功能的微生物或酶元件将塑料解聚为单体,反应条件温和,不产生二次污染,进一步利用合成生物学的技术策略搭建塑料解聚物到高附加值产品的生物转化线路,可实现废弃塑料资源的“升级再造”。因此,基于合成生物学技术组建的“生物解聚→生物降解→高值化生物转化”一体化生物回收过程,有望成为塑料废弃物回收处置的重要手段。本文综述了国内外关于塑料解聚微生物筛选、解聚酶挖掘与设计、塑料单体降解途径解析以及塑料降解物高值化生物炼制等方面的最新研究进展,以期为建立更加高效的“降塑再造”技术平台提供新的思路。
1 塑料生物解聚研究进展
根据分子组成及其结构的不同,塑料主要分为以下几种:聚烯烃[聚乙烯(PE)、聚丙烯(PP)]、聚氯乙烯(PVC)、聚苯乙烯(PS)、聚对苯二甲酸乙二酯(PET)、聚氨酯(PU)、聚乳酸(PLA)和聚羟基脂肪酸酯(PHA)等;根据解聚机制的不同,又可分为水解型塑料和非水解型塑料。
1.1 水解型塑料解聚微生物的筛选及解聚酶挖掘
水解型塑料主要指单体通过酯键聚合而成的高分子塑料,以PET、PU 类为代表,该类聚合物的降解主要是通过断裂其内部的酯键来完成,其生物降解过程相对简单,目前已筛选获得来自于不同菌属的多种微生物对该类塑料具有降解效果,其降解途径也比较明确(表1)。
PET塑料是由对苯二甲酸和乙二醇通过酯键连接而成的高分子化合物,通常以无定形和半结晶的形式存在,主要用于饮料瓶等包装材料[24]。微生物通过分泌一些胞外解聚酶,水解PET 塑料中的酯键实现对聚合塑料的解聚,获得的小分子解聚物可被微生物进一步矿化为水和CO2[25]。结晶度是影响PET 生物解聚的重要因素之一,结晶度越高,解聚难度越大。因此,研究人员通常采用无定形或低结晶度薄膜为模式底物,进行PET降解微生物的筛选和解聚特性的研究。目前报道的PET降解微生物主要包括腐皮镰孢菌(F. solani)[11-12]、特异腐质霉(H.insolens)[13]等,真菌和嗜热子囊菌(T. fusca)[14-17]、绿色糖单孢菌(S. viridis)[18]等放线菌(表1),但这些微生物大多只在PET 表面进行降解改性,对实际PET 塑料废弃物降解能力十分有限。2016 年,Yoshida 等[19]分离出了一株细菌I.sakaiensis 201-F6,在30 ℃的条件下反应6周后,完全降解低结晶度PET薄膜,是目前已报道对PET降解效果最好的一株细菌。
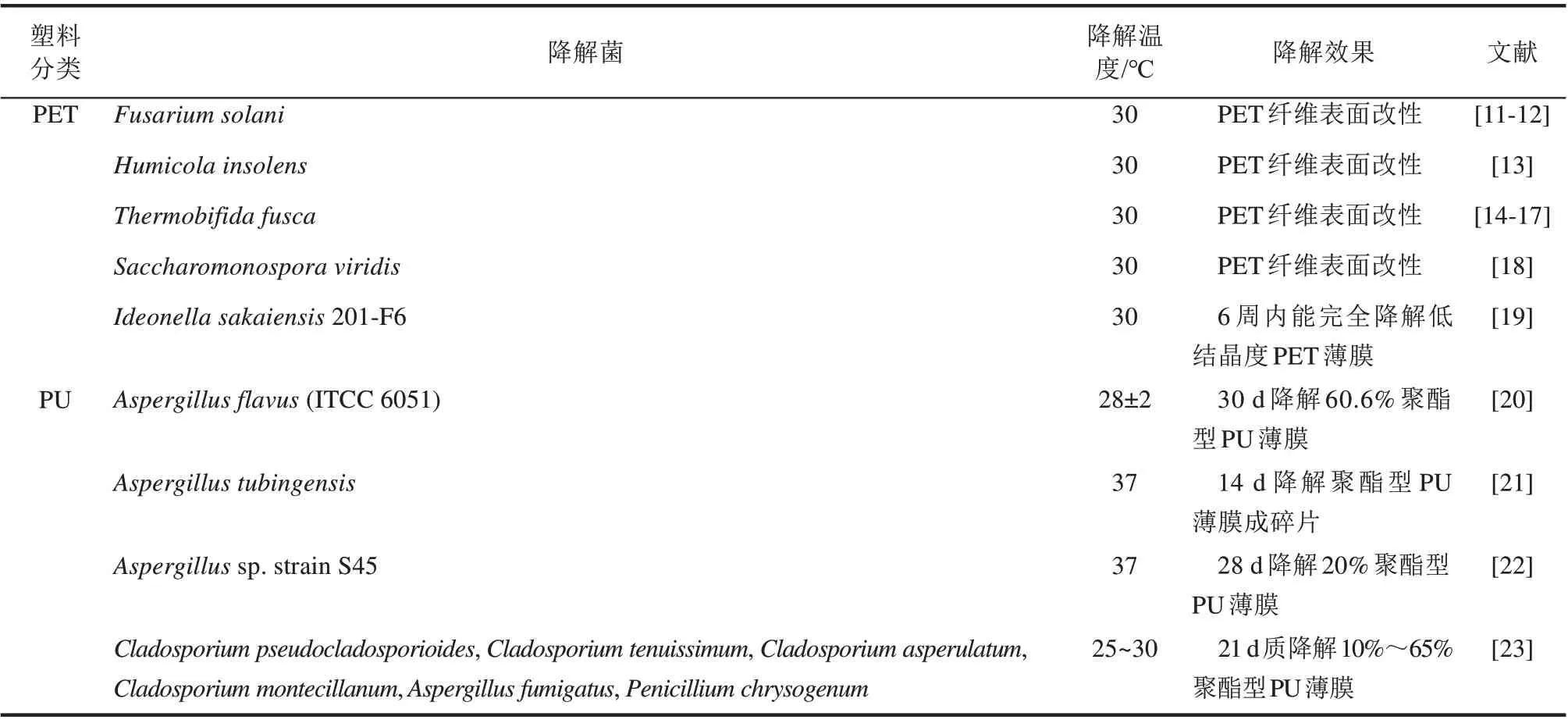
表1 水解型塑料降解微生物研究进展Tab.1 Microorganisms responsible for depolymerizing plastics through hydrolysis
因PET 塑料具有较高的玻璃转化温度,直接利用酶在高温(60~70 ℃)条件下对PET 进行解聚成为近年来研究的热点。目前已挖掘的具有PET解聚活性的酶元件种类较多,包括脂肪酶、酯酶和角质酶等,其中角质酶是目前研究较多的一种PET 高效解聚酶[26](表2)。T. fusca DSM43793 来源的角质酶TfH在55 ℃催化条件下,3周内可使结晶度为10%的PET 膜质量损失50%[27];来自特异腐质霉H.insolens的角质酶HiC在70 ℃条件下96 h内几乎可以完全降解低结晶度PET 薄膜,是迄今报道酶活性最高且热稳定性最好的真菌来源聚酯水解酶[28];来源于植物堆肥的角质酶LCC在70 ℃条件下,经24 h 催化可降解25%无定形PET 薄膜,该酶与TfH 聚酯水解酶具有一定的同源性[29]。此外,来源于嗜热链霉菌(Thermomyces insolens)、南极假丝酵母(Candida antarctica)、曲霉属(Aspergillus sp.) 的脂肪酶和来源于枝孢菌(Cladosporium 和Cladosporioides)、格拉子囊菌热白 丝 菌(Melancarpus albomyces)、 柠 檬 青 霉(Penicillium citrinum)的酯酶也对PET 有一定解聚效果,但仅是增加了PET 表面的亲水性并引起其表面形态变化。
PU 塑料是由异氰酸酯、多元醇和扩链剂3 种组分缩合而成的含有氨基甲酸酯键重复单元结构的聚合物。PU 是一种半结晶的热固性塑料,其中异氰酸酯构成其结晶部分,称为PU 的硬段,决定了PU 塑料的硬度和拉伸强度;多元醇和扩链剂构成其非结晶部分,称为PU 的软段,决定了PU 的弹性及延伸特性。PU 的生物降解过程主要通过断裂其软段的酯键来完成解聚,因此,目前报道的具有PU 降解能力的微生物大多是针对聚酯型PU的降解,聚醚型PU 的降解微生物报道较少[38]。镰刀菌属(Fusarium sp.)、弯孢菌属(Curvularia sp.)、枝 霉 属(Cladosporium sp.)、青 霉 菌 属(Penicillium sp.)、芽孢杆菌属(Bacillus sp.)、假单胞菌属(Pseudomonas sp.)等多种微生物均被证实具有降解PU 塑料能力,见表1。Álvarezbarragán 等[23]分离出6 种Cladosporium sp.菌株,在两周内可降解75%~85%的水性PU(Impranil DLN),对聚酯型PU 有着较高的降解水平;Aspergillus sp.是目前报道具有聚酯型PU 降解能力的一类真菌,从垃圾堆土壤中分离出来的黄曲霉(Aspergillus flavus)可利用聚酯型PU 薄膜作为唯一碳源,在30 d 内降解60.6%的聚酯型PU[20];从固体废弃物倾倒点分离的Aspergillus sp.strain S45,在28 d 内可降解20%的聚酯型PU 薄膜[22];Khan等[21]从垃圾场中分离出油曲霉(Aspergillus tubingensis),在含2%葡萄糖的无机盐液体培养基培养21 d 后,可将聚酯型PU 薄膜降解成碎片。然而,关于利用这些微生物降解真实聚酯型PU 废弃塑料研究还很少[39]。
生物酶可以通过水解PU 的酯键或脲键来实现对PU 塑料的解聚,常见的酶种类有酯酶、脲酶和蛋白酶等[40]。酯酶是目前降解PU 塑料效果最优的酶,例如丛毛单胞菌Comamonas acidovorans TB-35 来源的酯酶PudA[32-33],假单胞菌属来源的酯酶PueA、PueB 和PulA[35-36]。这些已经克隆的酯酶虽然可以有效解聚水性聚氨酯DLN,但对于真实的PU废弃物几乎没有效果。木瓜蛋白酶在37 ℃下处理PU 薄膜1~6 个月后,GPC 和FTIR 分析表明氨基甲酸酯键发生了一定程度的断裂[41];α-胰凝乳蛋白酶降解PU时,25 ℃反应10 d后,其平均分子量也能降低30%以上[42]。目前,关于脲酶降解PU的报道相对较少,Phua 等[41]发现脲酶(EC 3.5.1.5)对PU 处理后,通过GPC、红外等分析发现其产生了降解,且主要归因于PU 中脲键的水解。 此 外, Schmidt 等[37]发 现 角 质 酶LCC、TfCut2、Tcur1278和Tcur0390在降解PET塑料的同时,也表现出一定的聚酯型PU降解能力,在70 ℃条件下,经过100 h 的降解,PU 塑料降解率达到0.3%~3.2%。
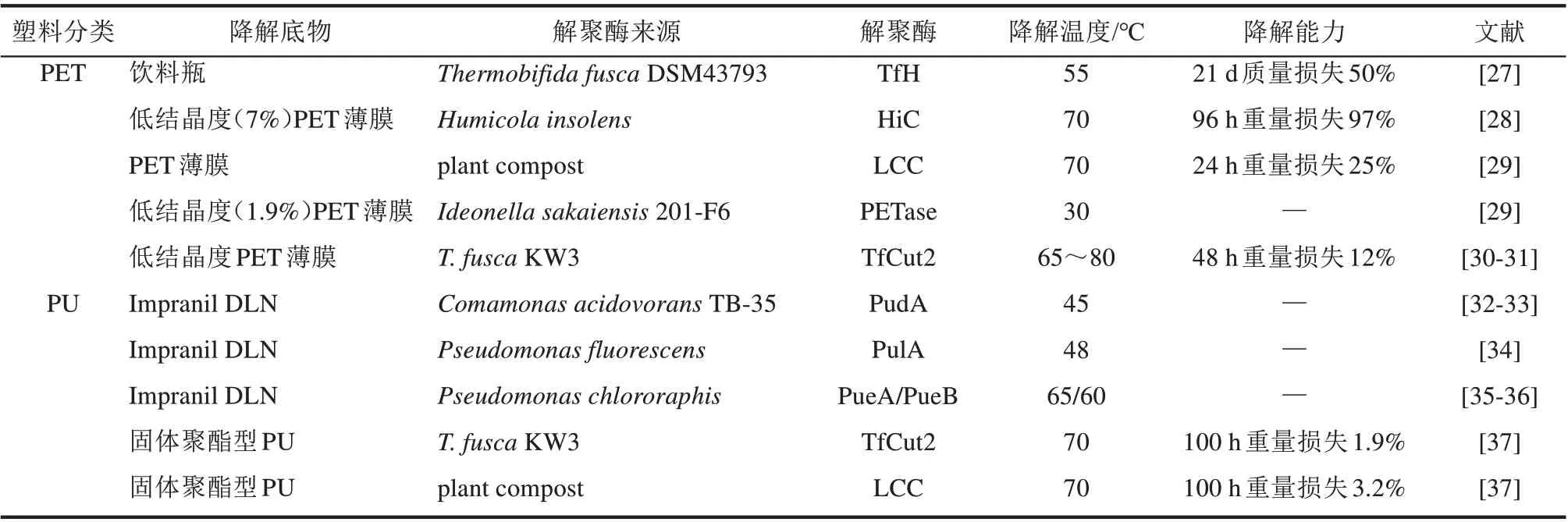
表2 水解型塑料解聚酶挖掘Tab.2 Depolymerases responsible for plastics depolymerization through hydrolysis
1.2 非水解型塑料降解微生物的筛选及解聚酶挖掘
非水解型塑料是指由烯烃类单体聚合而成的高分子塑料,以PE、PS 类塑料为代表,其主链化学组成为烷基碳,C—C 键惰性强、反应能垒高,导致其难以断裂,这也是该类塑料很难被微生物降解的重要原因[43]。
研究人员已经分离出了一些可以降解PE 类塑料的微生物,见表3。韩秋霞等[44]从农田土壤中分离到一株可以改性PE 膜为唯一碳源的Aspergillus niger M6,30 d 对PE 膜 质 量 损 失 达20%;Balasubramanian 等[45]从印度马纳尔湾的塑料废物堆放场中分离出15 株高密度PE 塑料降解细菌,其中Arthrobacter sp. GMB5 和Pseudomonas sp.GMB7可以在30 d内分别降解12%和15%的PE薄膜;Tribedi 等[49]从土壤中富集分离得到一株降解低密度PE 的假单胞菌Pseudomonas sp. AKS2,可在45 d 使PE 的质量损失达4%~6%。同样在农田废弃地膜中富集分离出了红球菌Rhodococcus sp. C208 可实现以每周0.86%的速率降解PE 塑料薄膜[50]。
关于PS 塑料降解的微生物报道相对较少,Eisaku 等[51]首次从土壤中分离出来了5 株可以降解PS 的微生物,包括黄单胞菌属(Xanthomonas sp.)、鞘氨醇杆菌属(Sphingobacterium sp.)和芽孢杆菌属(Bacillus sp.)等;此外,季荣等[48]将Penicillium variabile CCF3219 应用于臭氧氧化预处理后的14C 标记的PS 薄膜,在16 周内将其几乎完全矿化成CO2和水。近年来,利用昆虫肠道微生物菌群降解聚烯烃类塑料发展迅速。杨军等[46,52]发现印度谷螟幼虫(Plodia interpunctella Hübner)可以啃食PE 薄膜,从其肠道内分离出2 株能够降解PE 的 细 菌:Enterobacter asburiae YT1 和Bacillus sp.YP1。同时,该团队还发现黄粉虫(the larvae of Tenebrio molitor Linnaeus)对PS 薄膜有一定的降解能力,并进一步从其肠道中分离出1 株PS 降解菌Exiguobacterium sp.YT2,该菌株可以在60 d内降解7.4%PS[47]。在未来研究中,昆虫肠道微生物菌群将为聚烯烃类塑料高效降解微生物的挖掘提供重要的筛选来源。
参与PE、PS 等非水解型塑料生物降解过程的酶种类很多,如漆酶、锰过氧化物酶(MnP)、木质素过氧化物酶(LiP)和烷烃羟化酶(AH)等均被证实对预处理后的非水解型塑料有一定降解效果[53]。 在Cu2+存 在 的 条 件 下, PE 塑 料 经Rhodococcus ruber C208 来源的漆酶处理后,PE 塑料中羰基量显著增加,聚合物的重均分子量(Mw)和平均分子量(Mn)分别降低了20%和15%,且氧化和断裂的部位都发生在PE 膜的非结晶区[54];Trametes versicolor 来源的漆酶在1-羟基苯并三唑的介导下加速了对PE 膜的降解速率[55]。烷基羟化酶家族的烷烃羟化酶可通过碳氢化合物的氧化末端或亚末端实现对其降解[56];在大肠杆菌BL21中外源表达Pseudomonas sp. E4 来源的AH 编码基因alkB,37 ℃培养80 d,可将20%的低分子量PE 转化为CO2[57]。进一步整合P.aeruginosa E7的AH 催化系统(包括烷烃单加氧酶、红色素和红色素还原酶),工程菌BL21 降解PE 的效率提升到30%[58]。目前,关于PS 解聚酶的报道只有来自木质素脱色细菌Azotobacter beijerinckii HM121 的非血红素氢醌过氧化物酶,其可在两相系统(二氯甲烷-水)中降解不溶性PS,当过氧化氢和四甲基氢醌存在时,PS可在5 min内被降解为水溶性小分子产物[59](表4)。

表3 非水解型塑料降解微生物分离研究进展Tab.3 Microorganisms responsible for plastics depolymerization through non-hydrolysis pathways
2 塑料解聚酶的设计与改造
目前,塑料解聚酶元库存在催化效率低、稳定性差、表达量低等问题,限制了塑料解聚酶的规模化生产与应用。利用理性设计、定向改造等蛋白质工程技术方法,有望提高塑料解聚酶的活性、稳定性和特异性。
2.1 提高酶的热稳定性
玻璃转化温度是影响塑料生物降解的重要因素之一,在玻璃转化温度下,PET塑料的非晶态部分具有更高的柔性,从而更易被酶接触并发生解聚。PET 的玻璃转化温度在65 ℃左右,因此要求解聚酶具有较强的耐热性能[61]。二价金属离子(Ca2+和Mg2+)能够将聚酯水解酶TfCut2 的熔点温度提高10.8~14.1 ℃,从而提高其热稳定性,改造酶在65 ℃、48 h 处理条件下对半结晶PET 的水解效率提高到12.9%[17]。通过在TfCut2 中引入二硫键,使其熔点温度提高了25 ℃,半失活温度提高了17 ℃,该酶突变体在70 ℃、48 h 处理条件下,可解聚25% PET 薄膜,其催化效率较原始酶提高了一倍[16]。此外,法国图卢兹大学的Marty 团队[62]通过引入二硫键取代LCC 金属离子结合位点附近的氨基酸残基,将LCC 的熔点温度提高了9.8 ℃,从而提高了其对PET 塑料的降解效率。因此,增强酶的热稳定性能够有效提高酶对塑料底物的催化效率。
2.2 增大酶的底物结合口袋
通过改造酶的催化中心以促进酶与底物的结合是提升酶催化效率最常用的策略之一[63]。若能扩大底物结合口袋,使得塑料大分子更容易进入酶的催化中心,将提高塑料降解酶的催化活性。Araújo 等[11]对FsC 角质酶的活性中心附近的氨基酸进行突变,利用丙氨酸替代方法扩大了底物结合口袋,突变体Leu182Ala 和Leu81Ala 对PET 纤维的水解活性分别提高了4 倍和5 倍;近期,法国图卢兹大学的Marty 团队[62]通过调控LCC 的底物结合口袋与PET 底物的吻合度确定影响酶催化效率的关键氨基酸残基,通过排列组合改变催化凹槽内的所有氨基酸残基,其中F243I和F243W表面的“凹槽”与PET 最容易嵌合,突变体可显著提高酶催化效率。在此基础上,进一步引入二硫键取代金属离子结合位点附近的氨基酸残基以提高酶的热稳定性,最终获得的酶突变体可在10 h 内解聚90%以上的瓶级PET,这是迄今为止报道的最高效的PET解聚酶。
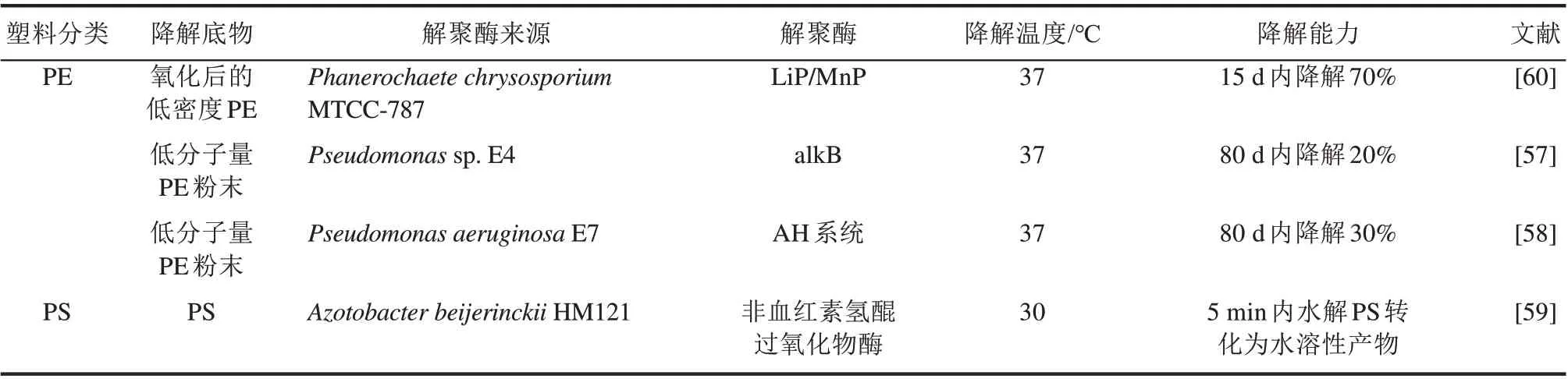
表4 非水解型塑料解聚酶元件挖掘研究进展Tab.4 Depolymerases responsible for plastics depolymerization through non-hydrolysis pathways
2.3 强化酶与底物的可及性
聚合物表面的疏水性特性,使得解聚酶表面的亲水基团无法有效地吸附到聚合物表面,即降低了酶与底物的可及性。若能在PET解聚酶中引入疏水结合模块,将增加酶与底物的可及性。Ribitsch等[64]将PET 角质酶Thc_Cut1 和两种木霉疏水蛋白HFB4 和HFB7 进行融合,获得的融合酶对PET 的水解效率提高了16 倍以上。Ribitsch 等[65]通过在PET角质酶Thc_Cut1中引入两种疏水性蛋白酶:分别来自于Hypocrea jecorina的纤维二糖水解酶CBM和来自于Alcaligenes faecalis 的聚羟基链烷酸解聚酶PBM,获得的融合酶对PET 的水解活性提高了3.8 倍。同样,Gamerith 等[66]在Nocardia farcinica的聚酰胺酶PA中引入了来自于A.faecalis的聚羟基链烷酸解聚酶PBM,融合酶PA_PBM水解聚合物的活性较PA提高了3倍。因此,增加酶与底物的可及性是提高解聚酶对疏水性聚合物水解活性的有效策略。另外,通过增加酶分子底物结合口袋的疏水性,促进疏水性塑料聚合物与酶吸附结合从而提高酶的催化效率,是强化酶与底物可及性的另一种方法。例如,Silva 等[67]通过设计双突变Gln132Ala/Thr101Ala 来增加角质酶Tfu_0883 底物结合口袋的疏水性,突变体对PET 纤维的降解活性提高了1.6倍。
2.4 减少酶的产物抑制
PET 在水解之后,会产生对苯二甲酸双酯(BHET)、对苯二甲酸单酯(MHET)、对苯二甲酸(TPA)和乙二醇(EG)这些降解单体,其中BHET和MHET会竞争性地结合到PET水解酶的底物结合位点,进而抑制PET 酶的解聚活性。针对这一问题,Wei 等[68]对TfCut2 的第62 位的氨基酸残基进行了突变,得到的G62A 突变体无法与MHET 相互作用,该酶对MHET 的结合常数降低到原来的2/11,对PET 的降解效率提高了2.7 倍。Carniel 等[69]通过组合C. antarctica 的脂肪酶CalB与HiC,可消除PET解聚产物MHET的积累,双酶体系对PET 的降解效率较单酶催化系统提高了7.7倍;Barth 等[70]建立了固定化双酶体系(TfCa-TfCut2 和TfCa-LCC)对PET 进行降解,其中TfCa用于水解中间产物BHET和MHET,与单酶处理相比,双酶的协同作用使得BHET和MHET的生产量分别增加了91% 和104%,提高了PET 的降解效率。
3 塑料降解物的高值化生物炼制
建立从塑料降解物到有用化学品的生物转化技术体系,不仅能推动循环经济发展,还能有效节约石油、天然气等不可再生资源,减少温室气体排放,保护生态环境。然而废塑料结构复杂、分类难度大、降解物多样,要想实现塑料降解物的高值化生物炼制,解聚过程需要化学方法和生物方法并用。无论是通过生物还是化学策略解聚获得的塑料单体,在明确降解所得的小分子单体或寡聚物后,定向挖掘可以利用这些小分子化合物的微生物,解析其降解路径,并利用合成生物学技术,设计与构建塑料降解物到高值化学品的合成途径,有望建立“降塑再造”的废弃塑料资源循环经济。
3.1 塑料降解物生物利用途径解析
结构的复杂与解聚条件的差异导致塑料降解物成分多样,主要包括有机酸、有机醇、芳香类化合物以及脂肪烃化合物,针对这几种塑料单体的生物利用过程,国内外研究者已经开展了大量研究,并取得了阶段性突破。
3.1.1 有机酸类塑料降解物
(1)己二酸 PU 等塑料的降解物之一,其代谢途径在不动杆菌(Acinetobacter)中已被解析[71]。如图2 所示,己二酸首先在琥珀酰CoA 转移酶(DcaIJ)的催化下形成己二酰CoA,紧接着在酰基CoA 脱氢酶(DcaA)的催化下生成5-羧基-2-戊烯酰CoA,随后被烯酰CoA 水合酶(DcaE)催化生成3-羟基己二酰CoA,然后在3-羟基己二酰CoA 脱氢酶(DcaH)作用下生成3-酮基己二酰CoA,最后在酰基CoA 硫解酶(DcaF)的催化下生成琥珀酰CoA 和乙酰CoA,进而进入TCA 循环,用于细胞的生长和代谢。
(2)6-羟基己酸 存在于PU塑料的降解物中,如图2 所示,6-羟基己酸可被微生物胞内的6-羟基己酸脱氢酶(ChnD)和6-氧己酸脱氢酶(ChnE)两步催化转化为己二酸,然后通过上述己二酸降解途径,最终形成琥珀酰CoA 和乙酰CoA 进入TCA循环[72]。
3.1.2 有机醇类塑料降解物
(1)乙二醇 PET、PU 等塑料的解聚产物之一,近年来,利用恶臭假单胞菌(P.putida)等土壤微生物转化乙二醇合成更高价值的乙醇酸、乙醛酸、鼠李糖酯等生物化学品受到广泛关注[73]。如图3(a)所示,在恶臭假单胞菌P. putida KT2440 中,乙二醇首先在周质吡咯并喹啉醌(PQQ)依赖性醇脱氢酶(PedE、PedH)的催化下转化为乙醇醛,紧接着在胞质醛脱氢酶PP_0545和PedⅠ的作用下生成乙醇酸,继而在膜锚定的乙醇酸氧化酶GlcDEF 的作用下生成乙醛酸。生成的乙醛酸可以通过两种方式进入TCA 循环:①在异柠檬酸裂解酶(AceA)的作用下与丁二酸缩合形成异柠檬酸进入TCA循环;②在苹果酸合成酶(GlcB)的作用下与乙酰CoA 缩合形成苹果酸,进入TCA循环[74]。然而,在路径①中,异柠檬酸转化为丁二酸的过程中伴随着两分子CO2的脱除,因此,乙二醇提供的两分子的碳元素无法进入中心代谢供给细胞生长;在路径②中,乙酰CoA 的不足制约了乙醛酸进一步转化为苹果酸进入中心代谢。因此,P. putida KT2440 无法利用乙二醇作为唯一碳源进行生长[74]。而在P.putida JM37 中存在另一条乙二醇代谢通路,乙醛酸可以通过乙醛酸羧化酶(Gcl)催化生成酒石酸半醛,紧接着在羟基丙酮酸异构酶(Hyi)和酒石酸酯半醛还原酶(GlxR)的作用下生成甘油酸,进而转化为2-磷酸甘油酸进入糖酵解途径,并最终进入TCA 循环[74]。因此,P. putida JM37 可以在以乙二醇为唯一碳源的培养基上良好生长。通过对乙二醇代谢路径中各基因元件的表达与转录水平进行全面考察发现,Gcl 和GlxR是乙二醇利用过程的关键节点,同时表达Gcl和GlxR 的恶臭假单胞菌实现了在以乙二醇为唯一碳源的培养基上的快速生长[73]。此外,在产乙酸木 杆 菌(Acetobacterium woodii)中,Trifunović等[75]发现pdu 基因簇编码的丙二醇脱水酶(PduCDE)和CoA 依赖的丙醛脱氢酶(PduP),除了可以催化1,2-丙二醇和2,3-丁二醇的降解外,还可以催化乙二醇脱水形成乙醛,并进一步转化为乙酰CoA 和乙醇。生成的乙酰CoA 被转化为乙酸,并通过底物水平磷酸化过程生成ATP。乙醇则部分被氧化为乙酸,产生的还原当量用于Wood-Ljungdahl通路固定CO2合成乙酸。
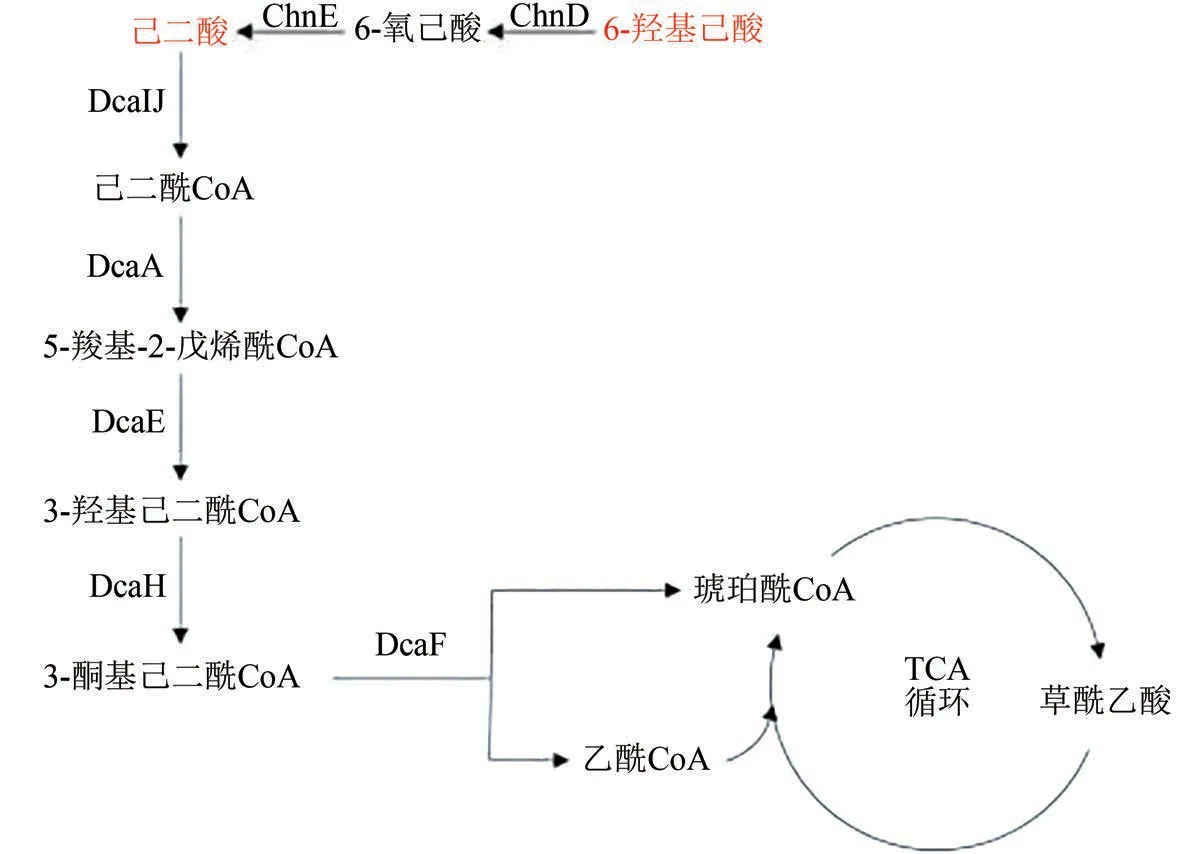
图2 有机酸类塑料单体(己二酸和6-羟基己酸等)的生物降解途径(途径涉及的关键酶:DcaIJ—琥珀酰CoA转移酶;DcaA—酰基CoA脱氢酶;DcaE—烯酰CoA水合酶;DcaH—3-羟基己二酰CoA脱氢酶;DcaF—酰基CoA硫解酶;ChnD—6-羟基己酸脱氢酶;ChnE—6-氧己酸脱氢酶)Fig.2 Biological degradation pathway for plastics from organic acid based monomers(adipic acid,6-hydroxyhexanoic acid,etc.)(Key enzymes in metabolic pathway:DcaIJ—succinyl-CoA transferase;DcaA—acyl-CoA dehydrogenase;DcaE—enoyl-CoA hydratase;DcaH—3-hyroxyacyl-CoA dehydrogenase;DcaF—acyl-CoA thiolase;ChnD—6-hydroxyhexanoate dehydrogenase;ChnE—6-oxohexanoate dehydrogenase)
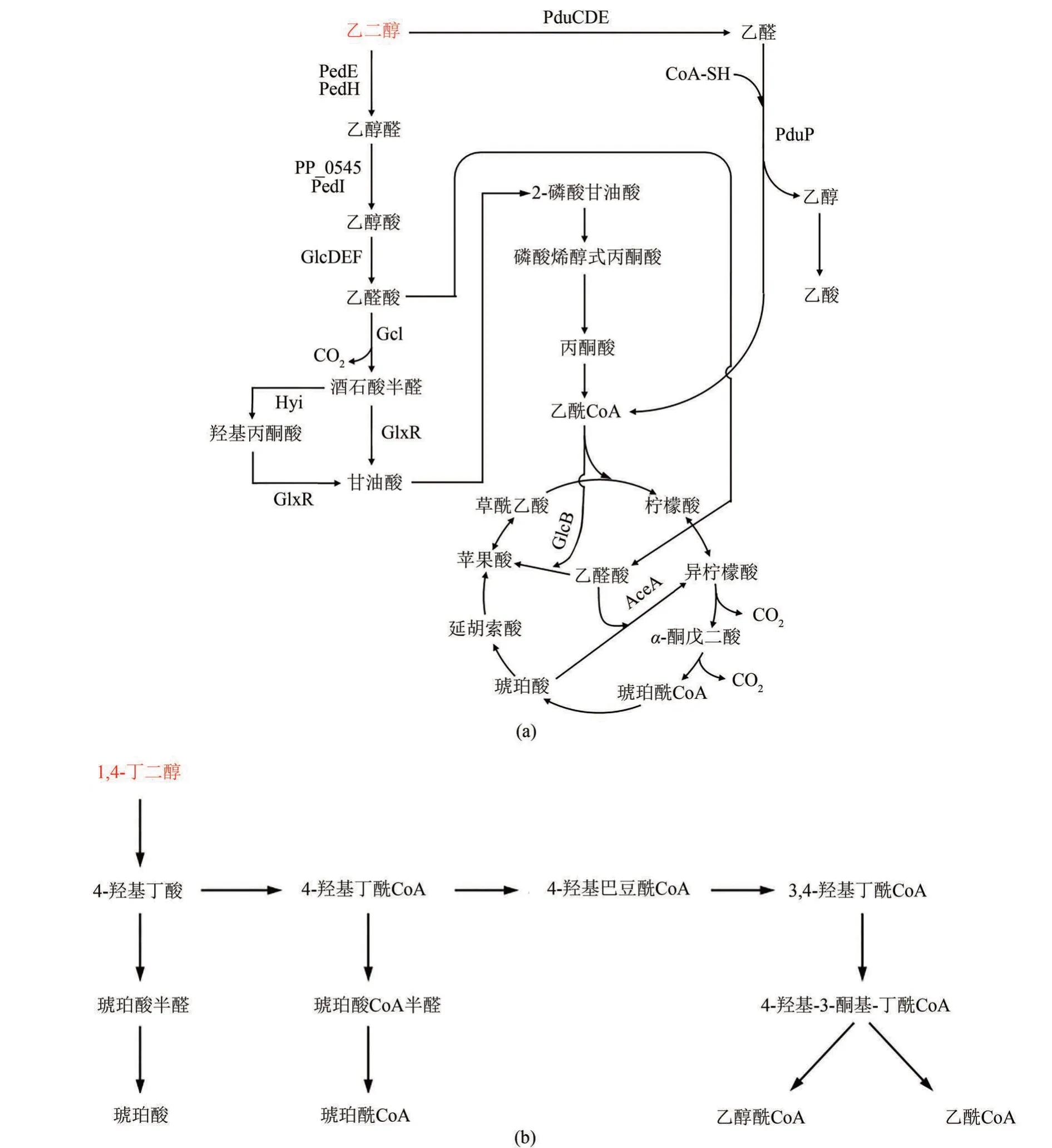
图3 有机醇类塑料单体(乙二醇和1,4-丁二醇等)的生物降解途径(途径涉及的关键酶:PedE,PedH—醌依赖性醇脱氢酶;PP_0545和PedI—醛脱氢酶;GlcDEF—乙醇酸氧化酶;Gcl—乙醛酸羧化酶;Hyi—羟基丙酮酸异构酶;GlxR—酒石酸酯半醛还原酶;AceA—异柠檬酸裂解酶;GlcB—苹果酸合成酶;PduP—丙醛脱氢酶)Fig.3 Biological degradation pathway for plastic from organic alcohol based monomers(ethylene glycol,1,4-butanediol,etc.)(Key enzymes in metabolic pathway:PedE,PedH—quinoprotein alcohol dehydrogenase;PP_0545 and PedI—aldehyde dehydrogenase;GlcDEF—glycolate oxidase;Gcl—glyoxylate carboligase;Hyi—hydroxypyruvate isomerase;GlxR—artronate semialdehyde reductase;AceA—isocitrate lyase;GlcB—malate synthase;PduP—propionaldehyde dehydrogenase)
(2)1,4-丁二醇 PU 的主要降解产物之一。P. putida KT2440 可以在以1,4-丁二醇为唯一碳源的培养基中生长,但其生长速率非常缓慢。通过适应性进化可以提高KT2440 对于1,4-丁二醇的利用效率。基于此,Li 等[76]通过对突变菌株进行基因组测序以及蛋白组学分析,解析了1,4-丁二醇的生物降解路径。如图3(b)所示,1,4-丁二醇首先被氧化为4-羟基丁酸,这一步主要由PP_2674-2680 ped 基因簇编码的高表达脱氢酶催化完成。生成的4-羟基丁酸可通过以下3条途径进行下一步的代谢:①进一步经ped 基因簇编码的脱氢酶催化氧化为琥珀酸;②经acyl-CoA 合成酶AcsA1(PP_4487)活化和acyl-CoA 催化为琥珀酰CoA;③通过β-氧化转化为乙醇酰CoA 和乙酰CoA[76]。目前,只有第3条路径得以确证,琥珀酸合成途径和琥珀酰CoA合成路径有待进一步证实。
3.1.3 芳香类塑料降解物
(1)对苯二甲酸 PET的另一重要降解物。转化对苯二甲酸合成更高价值的芳香族化合物可提高PET 塑料制品循环使用的经济性。丛毛单胞菌(Comamonas sp.)[77]、 戴 尔 福 特 菌(Delftia tsuruhatensis)[78]、红球菌(Rhodococcus sp.)[79]等微生物都可以在以对苯二甲酸为唯一碳源的培养基上生长代谢。如图4(a)所示,对苯二甲酸在微生物胞内的降解途径为:对苯二甲酸经1,2-双加氧酶(TphAabc)和1,2-二羟基-3,5-环己二烯-1,4-二羧酸酯脱氢酶(TphB)两步作用生成重要中间产物原儿茶酸[80]。原儿茶酸是一种简单的酚酸,可进一步转化合成没食子酸、邻苯三酚、黏康酸和香草酸等高价值芳香化合物,或用于合成鼠李糖酯、PHA 等重要生物制品。水溶性差,发酵底物浓度低是制约对苯二甲酸作为发酵底物的瓶颈之一。针对这一问题,Kenny 等[81]采用对苯二甲酸与甘油共底物用于P. putida GO16 培养发酵,PHA的生产强度达到108.8 mg/(L·h)。
(2)2,4-二氨基甲苯 PU 等塑料的一种解聚物。2020 年,Espinosa 等[82]从塑料垃圾场土壤中分离获得一株可以利用PU 降解寡聚物与2,4-二氨基甲苯为碳/氮源进行生长的假单胞菌Pseudomonas TDA1,通过基因组学分析,初步提出了2,4-二氨基甲苯的降解路径。如图4(b)所示,2,4-二氨基甲苯的甲基基团经氧化、脱羧和脱氨后形成4-氨基邻苯二酚,4-氨基邻苯二酚可能以二元醇的形式转化为4-氨基-2-羟基黏康酸,并通过类似儿茶酸的代谢途径进行进一步降解转化。未来,需对预测代谢途径中的相关基因进行蛋白质组学与转录组学方面的全面分析,并考察代谢中间物的分布与通量变化,从而准确绘制2,4-二氨基甲苯的降解路径。
3.1.4 脂肪烃类塑料降解物
PE、PP、PVC 等塑料制品经热解法处理后可获得多种小分子的脂肪烃。脂肪烃的代谢途径在自然界中广泛存在。在假丝酵母(Candida sp.)、解脂耶氏酵母(Yarrowia lipolytica)等真核微生物中,脂肪烃首先被内质网上CYP52 家族的单加氧酶P450 氧化为脂肪醇,脂肪醇随后在内质网或过氧化物酶体被氧化为脂肪醛,并进一步氧化为脂肪酸。脂肪酸经酰基CoA 催化生成脂酰CoA,脂酰CoA 或用于三酰甘油的合成,或在过氧化物酶体经β-氧化完全氧化为乙酰CoA 进入中心代谢途径[83]。
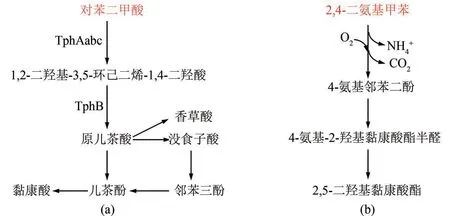
图4 芳香类塑料单体(对苯二甲酸和2,4-二氨基甲苯等)的生物降解途径(途径涉及的关键酶:TphAabc—对苯二甲酸1,2-双加氧酶;TphB—1,2-二羟基-3,5-环己二烯-1,4-二羧酸酯脱氢酶)Fig.4 Biological degradation pathway for plastics from aromatic monomers(terephthalic acid,2,4-diaminotoluene,etc.)(Key enzymes in metabolic pathway:TphAabc—TPA 1,2-dioxygenase;TphB—1,2-dihydroxy-3,5-cyclohexadiene-1,4-dicarboxylate dehydrogenase)
对于苯系的脂肪烃而言,其降解路径主要有开环和侧链氧化两种方式,如图5所示。开环降解报道不多,主要存在于红球菌中[84]:苯乙烯的芳环首先被苯乙烯双加氧酶(SDO)羟基化生成苯乙烯顺式乙二醇,再经顺式乙二醇脱氢酶(CGDH)进一步氧化形成3-乙烯基邻苯二酚,进而转化为丙酮酸进入中心代谢。开环路径无特异性,可以作用于所有包含苯环结构的物质。侧链乙烯基的氧化途径是苯乙烯的主要降解路径,广泛存在于Pseudomonas sp.[85]、Corynebacterium sp.[86]、Rhodococcus sp.[87]等微生物中。苯乙烯经过苯乙烯单加氧酶(SMO)、氧化苯乙烯异构酶(SOI)和苯乙醛脱氢酶(PAALDH)等酶作用转化生成苯乙酸。苯乙酸进一步完成羟基化后,通过β-氧化过程生成乙酰CoA 进入TCA 循环或转化为PHA。此外,苯乙烯氧化中间物苯乙酸还可以为苯乙醇和苯乙胺等高价值化学品的合成提供重要前体物质[88]。
3.2 塑料降解物合成高值化学品的路径设计与构建
PHA 是多数细菌胞内碳源和能源的储备物,因其可完全生物降解,被认为是可替代传统塑料的新型生物材料。近年来,利用塑料降解物为底物合成PHA受到广泛关注。2011年,Jasmina等[89]利用P. putida CA‐3 转化苯乙烯获得了3.36 g/L 的PHA 产出,建立了芳香族环境污染物降解与脂肪族PHA 合成的独特联系,为PS 塑料的循环利用提供了可行的方向。进一步,以低密度的PE 粉末为底 物,经 过21 d 的 生 物 转 化,Sen 等[90]利 用Cupriavidus necator H6 积累了细胞干重3.18%的短链PHA,这也是直接降解PE 材料并进行生物化合物合成的首次报道。此外,发现恶臭假单胞菌P.putida GO16、P.putida GO19 和弗雷德里克假单胞菌Pseudomonas frederiksbergensis GO23 在降解PET的同时可积累一定量的中等长度PHA,其中GO16和GO19积累PHA的速率可达到8.4 mg/(L·h)[91]。
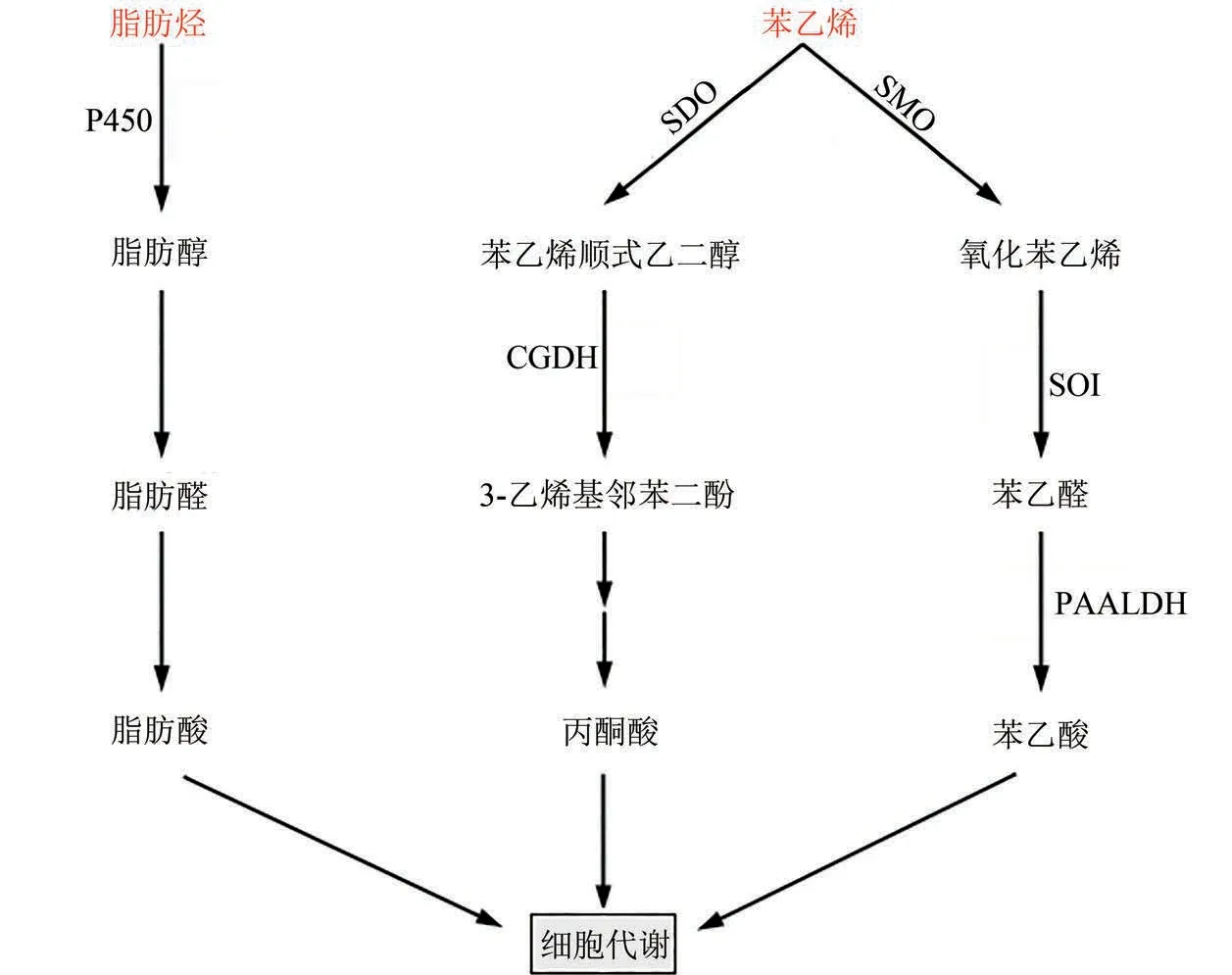
图5 脂肪烃类塑料单体的生物降解途径(途径涉及的关键酶:P450—单加氧酶P450;SDO—苯乙烯双加氧酶;SMO—苯乙烯单加氧酶;CGDH—顺式乙二醇脱氢酶;SOI—氧化苯乙烯异构酶;PAALDH—苯乙醛脱氢酶)Fig.5 Biological degradation pathway for plastics from aliphatic hydrocarbon monomers(Key enzymes in metabolic pathway:P450—monooxygenase P450;SDO—styrene dioxygenase;SMO—styrene monooxygenase;CGDH—cis-ethylene glycol dehydrogenase;SOI—styrene oxide isomerase;PAALDH—phenylacetaldehyde dehydrogenase)
表面活性剂可以乳化水性介质中的疏水性物质,从而增加细胞对疏水性物质的利用度。因此,PE、PP、PVC 等塑料经热解获得的疏水性脂肪烃等疏水性底物常用于表面活性剂的合成研究。例如,沙门菌Renibacterium salmoninarum 27BN 可利用正十六烷为唯一碳源生长并积累鼠李糖酯,鼠李糖酯的分泌又能进一步促进十六烷的利用[92]。值得一提的是,鼠李糖酯的合成与PHA 共用R-3-羟基链烷酸前体库,因此,许多具有同化塑料降解物合成PHA 的微生物也具有合成鼠李糖酯的潜力[93]。
油脂是微生物体内能量存在的主要物质,产油微生物可转化脂肪烃类塑料降解物合成并积累油脂。Y.lipolytica strain 78-003 可直接利用PP 塑料热裂解混合物(主要包含脂肪醇、烷烃和烯烃),细胞生物量达2.34 g/L,油脂含量达细胞干重的23%,底物到细胞转化率达0.13 g/g,其中油脂收率为0.03 g/g底物[94]。
芳香类化合物是苯系塑料降解物进行高值化生物再造的首选去向。Hee 等[80]通过在大肠杆菌内外源表达来自Comamonas sp. E6 的TphAabc 和TphB,获得工程菌株HBH-1,首先实现苯二甲酸到原儿茶酸的转化。进一步,以原儿茶酸为前体,Hee等又进行了一系列高价值芳香类化学品的合成研究。首先,通过外源表达来自P. putida KT2440的对羟基苯甲酸酯羟化酶(PobA),大肠杆菌Escherichia coli GA-1 可以转化原儿茶酸合成
1.4 mmol/L 没食子酸,转化率达40.1%。为消除没食子酸单菌合成中辅因子失衡问题,Hee等将没食子酸的合成途径分成两个模块:原儿茶酸合成模块(PCA-1)和没食子酸合成模块(HBH-2)。在最优菌株接种情况下,系统转化原儿茶酸合成没食子酸的转化率达92.5%。运用同样的策略,通过在没食子酸合成菌株GA-1 中外源表达没食子酸脱羧酶(LpdC),工程菌PG-1a 可以实现32.7%对苯二甲酸到邻苯三酚的转化。为解决此转化过程中副产物儿茶酚的积累,Hee等构建另一条以儿茶酸为中间物的邻苯三酚合成途径:原儿茶酸经脱羧形成邻苯二酚,再经过酚羟化酶(PhKLMNOPQ)的作用生成邻苯三酚。通过混合培养儿茶酸合成菌株与邻苯三酚合成菌株,最终对苯二甲酸转化合成邻苯三酚的产量达到0.6 mmol/L,是单菌培养的3 倍。运用同样的策略,Hee 等还完成了对苯二甲酸到黏康酸和香草酸的合成,这些成果为PET降解物的高值回收提供了宝贵经验。
许多塑料降解物或其降解中间代谢物具有细胞毒性,严重抑制了细胞的生长和产物的合成。例如,中间代谢物乙醇醛与乙二醛是乙二醇代谢过程的重要中间产物,4 mmol/L乙醇醛和7.5 mol/L乙二醇便可完全抑制恶臭假单胞菌的生长[73]。加快醛类物质到对应毒性较弱的醇或者酸的转化,是降低醛类物质毒性的常用策略。基于此,Franden等[73]通过过量表达乙醇酸氧化酶GlcDEF,减少了乙醇醛的积累, 使P. putida 工程菌MFL114,可以耐受2 mol/L(约124 g/L)乙二醇,并最终消耗0.5 mol/L(31 g/L)乙二醇生成细胞干重32.19%的PHA。
塑料降解物成分多样,单一微生物往往无法实现其完全降解。采用多细胞混合培养技术,针对性地选用功能微生物,或可加速塑料降解物的生物炼制过程。PU塑料的降解单体主要是己二酸、乙二醇、1,4-丁二醇和异氰酸酯[甲苯-2,4-二异氰酸酯(2,4-TDI)或4,4′-二苯基甲烷二异氰酸酯(4,4′-MDI)],异氰酸酯进一步衍生转化为2,4-甲苯二胺。基于此,研究人员首先鉴定并构建了聚氨酯单体的降解微生物[95]:据报道,拜氏不动杆菌Acinetobacter beijingii ADP1 具有很好的己二酸降解能力,通过克隆其己二酸降解关键阅读框dac(dcaAKIJP)并外源表达于P.putida KT2440,工程菌株P.putida KT2440 A12.1p 获得了在己二酸为碳源的培养基快速生长的能力;突变菌株P. putida KT2440 B10.1 和 工 程 菌P. putida KT2440ΔgclR ΔPP_2046 ΔPP_2662::14d 分别可以降解1,4-丁二醇和乙二醇。研究发现,2,4-甲苯二胺表现出严重的细胞毒性,同时也影响了聚氨酯水解体系中其他单体的生物利用效率。因此,研究人员利用石蜡油和二(2-乙基己基)磷酸(D2EHPA)作为溶剂和反应性萃取剂(助溶剂),对聚氨酯水解体系进行了TDA 萃取去除。在pH4 的情况下,TDA 的去除效率达到了93%。在此条件下,通过混合培养P. putida KT2440 A12.1p、P. putida KT2440 B10.1和P. putida KT2440ΔgclR ΔPP_2046 ΔPP_2662::14d,实现了混菌体系对体系其余塑料单体的完全转化。进一步,通过在己二酸、1,4-丁二醇和乙二醇降解的3个恶臭假单胞菌中外源表达鼠李糖酯合成关键基因RhlA 和RhlB,实现了聚氨酯塑料单体到鼠李糖酯的增殖生物再造。
4 展 望
近年来,国内外研究人员开展了各种废塑料降解微生物资源筛选和关键酶元件的挖掘改造工作,在PET 等聚酯型塑料的酶法解聚与催化机制方 面 取 得 了 令 人 瞩 目 的 重 要 突 破[19,62,96-97],CARBIOS 公司宣布将在法国化学谷建设PET 塑料酶法回收的工业示范工程,建立从PET 废弃物降解到单体利用的完整工业链,预计年利用能力在5 万吨到10 万吨之间(https://www.hbmedia.info/petplanet/2020/07/17/carbios-launched-construction-ofindustrial-demonstration-plant-for-the-enzymatic-petrecycling/?s=)。这些成果充分证明了基于合成生物学的生物解聚技术将是实现废弃塑料资源循环利用的有效途径。然而,废弃塑料种类多、成分复杂,除了PET 塑料之外的其他废弃塑料的生物解聚仍然面临着降解菌种/酶匮乏、解聚机制不明晰、降解体系效率低、降解物难以高效利用等一系列瓶颈问题亟待突破。
(1)非水解型塑料的生物氧化机制 非水解型塑料(聚乙烯、聚丙烯、聚氯乙烯、聚苯乙烯等)的市场占有率达到60%以上,其化学结构含有丰富的惰性C—C 主链并且不含其他活性官能团,这导致该类塑料可以抵抗生物酶的袭击,仅能通过高能氧化反应断裂[98]。目前,昆虫及其肠道微生物对非水解型塑料的解聚作用已有一些成功报道,但生物解聚效率相对较低,且涉及其降解过程的生物氧化酶和催化机制尚需要进一步明确[46-47,99-102]。聚乙烯和直链烷烃的单体结构相同,推测它们的生物降解机制也类似,烷烃羟化酶/单加氧酶(AlkB)被认为是参与降解聚乙烯的候选酶[103];而木质素分解酶(如LMSs)对于芳香族结构降解是有效的,可能是潜在的芳香族塑料聚苯乙烯的降解者[104]。鉴于此,基于烷烃羟化酶/单加氧酶和木质素分解酶的分子催化机制,结构导向“自下而上”的生物氧化酶从头设计方法可能比“自上而下”的昆虫降解更适合揭示非水解型塑料的生物氧化机制。
(2)塑料解聚酶的高效异源表达 塑料解聚酶制剂的高效低成本制备是实现塑料生物法降解产业化示范应用的关键。目前塑料解聚酶在大肠杆菌、毕赤酵母、枯草芽孢杆菌等宿主中的可溶性表达水平普遍较低,细菌来源PETase 可溶性表达量为6.3 mg/L,真菌来源角质酶TfCa 可溶性表达量为41.6 mg/L。宏基因组来源聚酯水解酶LCC可溶性表达量约为40 mg/L。漆酶、过氧化物酶、P450 酶等氧化还原酶的表达量更低。塑料解聚酶在异源表达过程中,当溶质-溶质(蛋白质-蛋白质)相互作用强烈于溶质-溶剂(蛋白质-缓冲液)相互作用时,蛋白质之间相互作用力(静电作用力、疏水作用力等)加强导致蛋白质聚集是影响其高效表达的重要因素[105-108]。随着合成生物技术发展,通过蛋白质工程提高蛋白质的胶体和结构稳定性[109-110]、翻译后修饰工程提高蛋白质的糖基化程度[105,111]将有望从源头上为塑料解聚酶聚集问题提供一种有效的解决方案。
(3)混合塑料解聚多酶/混菌体系构建 针对结构复杂的塑料(例如PU)或者混合塑料,单一的降解微生物/酶往往难以实现有效降解,为减轻单一微生物的代谢压力,可以将降解过程分成多个不同的过程来完成。细菌Ideonella sakaiensis 201-F6 就是通过分泌高活性PETase 和MHETase 协同作用使PET 得到充分的降解[62];Chen 等[112]基于极端嗜热混菌堆肥技术也实现了活性污泥中混合微塑料的原位生物降解。在废弃碳资源降解领域多酶/混菌降解体系已经取得了良好的效果,例如木质纤维素生物降解等[113]。与木质纤维素相比,塑料的疏水性和结晶程度更高、抗生物降解能力更强[114],因此在获取多种塑料降解微生物和降解元件的基础上,设计并构建高效、稳定的多酶/混菌体系,针对不同类型塑料组成定向调控多酶/混菌体系动态变化,将是塑料生物解聚重点突破的方向。
(4)塑料降解物高值化生物炼制途径 建立“塑料垃圾-解聚单体-高值化产品”的生物利用途径,不仅能推动塑料产业循环经济发展,还能有效节约天然资源,减少温室气体排放,保护生态环境。欧盟早在2015 年就启动了针对塑料生物降解和高值化利用项目-欧盟地平线2020 塑料生物降解及利用项目P4SB(from plastic waste to plastic value using Pseudomonas putida synthetic biology),打通了以PET 塑料单体乙二醇/对苯二甲酸和PUR塑料单体丁二醇/己二酸合成生物可降解塑料PHA和生物表面活性剂鼠李糖酯的技术路线[73,76,115-116],形成了一支国际塑料降解领域顶尖的研究团队(https://www.p4sb.eu/)。然而,现有的高值化生物炼制途径效率仍然较低[117],设计并构建高效的塑料单体降解途径和同化途径,并调控两条途径之间及与底盘细胞之间的适配性,真正实现“降塑再造”,推动循环经济发展,合成生物技术将发挥重要作用。
鉴于“白色污染”与废弃塑料资源浪费问题的严重性,我国“十三五”科技计划高度重视塑料生物降解与转化利用研究。国家自然科学基金委与欧盟委员会于2019 年在“塑料降解微生物菌群”方向共同资助了2项高强度国际(地区)合作与交流项目并开展实质性合作研究,“合成塑料降解转化微生物菌群”项目由山东大学祁庆生教授和爱尔兰阿斯隆理工学院Margaret Brennan Fournet教授作为负责人(https://www.bioicep.eu/),“废塑料资源高效生物降解转化的关键科学问题与技术”项目由南京工业大学姜岷教授和亚琛工业大学Lars M.Blank 教授作为负责人(https://www.mix-up.eu/)。同年,科技部又在国家重点研发计划“变革性技术关键科学问题”和“合成生物学”重点专项中分别部署了“合成塑料解聚酶的定向进化工程及应用”和“活性污泥人工多细胞体系构建与应用”两个指南方向,江南大学吴敬教授和中科院微生物研究所刘双江研究员分别获得2 个项目的资助。2020 年,在刚刚发布的国家重点研发计划“绿色生物制造”重点专项2021 年度指南征求意见稿中,对塑料生物解聚关键技术也进行了布局。2020年是上述塑料生物降解相关项目的启动实施之年,相信随着合成生物技术发展并在塑料生物降解转化过程的广泛应用,我国在废弃塑料资源的生物法降解转化方向将取得令人振奋的研究进展。

