梭菌正丁醇代谢工程研究进展
闻志强,孙小曼,汪庆卓,李亚楠,刘文正,蒋宇,杨晟,3
(1 南京师范大学食品与制药工程学院,江苏 南京 210046;2 中国科学院上海生命科学研究院湖州工业生物技术研发中心,浙江 湖州 313000;3 中国科学院分子植物科学卓越创新中心,中科院合成生物学重点实验室,上海 200032)
2019 年我国原油和石油对外依存度双破70%,连续多年保持低速稳步增长态势。一旦因疫情、战争或其他事件爆发造成我国外部资源进口遭到封锁,我国能源供给必须通过其他资源补充。另外,2020 年9 月22 日,习近平主席在第七十五届联合国大会上庄严承诺,中国的二氧化碳排放力争于2030 年前达到峰值,努力争取2060 年前实现碳中和,这要求我国必须加快发展生物能源,减少碳排放。生物质是众多可再生资源(如太阳能、风能、水能、地热能等)中唯一一类以碳为基础的实物性的资源,有潜力替代化石原料生产液体燃料、大宗化学品等,同时可减少碳排放。因此,生物炼制,特别是以丰富、廉价的木质纤维素为原料的绿色生物制造技术在保障国家能源安全和实现碳中和方面意义重大[1]。另外,它也在制止农作物秸秆焚烧、保护环境、促进农村经济发展等方面有重要作用。
正丁醇(以下丁醇若未特别说明均指正丁醇)是重要的大宗化学品和目前最易工业化、最易普及的可再生、替代性车用燃料之一,可由石油炼制或者梭菌发酵制取。在强调能源安全和碳中和的未来,以生物质为原料的丁醇发酵产业有望迎来新一轮发展机遇。然而,生物丁醇发酵面临着梭菌育种困难、副产物多、丁醇产量低/比例不高、底物利用效率低等问题[2]。幸运的是,近年来在合成生物学技术的驱动下,产丁醇梭菌在遗传操作工具开发领域取得很大进步,有力推动了梭菌在丁醇合成途径优化、底物谱拓展等领域的研究[3-5]。本文作者总结了近年来梭菌丁醇代谢工程的研究进展,力图勾勒本领域的研究概貌,为后续研究提供借鉴。
1 生物法合成正丁醇的途径和底盘
产溶剂梭菌如丙酮丁醇梭菌(Clostridium acetobutylicum)的溶剂发酵[也称ABE(acetonebutanol-ethanol)发酵]是制备生物丁醇的最主要的方法[6]。历史上,溶剂发酵也一度成为仅次于酒精发酵的世界第二大发酵工业。产溶剂梭菌中的丁醇合成途径已经非常清楚,是经典的辅酶A(CoA)依赖的碳链延长途径(图1)。
近年来,随着合成生物学的发展,一些新的丁醇合成途径被鉴定出来,同时跨物种募集基因元件以及重塑底盘细胞成为可能。于是,经典途径可以被改造优化,而一些新的丁醇合成途径被解析和组装,并在一些遗传背景清晰,遗传操作工具丰富的底盘细胞如大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae)等中被重构、调试和应用[7]。图1列举了微生物利用各种底物合成正丁醇的代谢途径,主要包括:①CoA依赖的合成途径;②ACP依赖的合成途径;③2-酮酸合成途径。
1.1 CoA依赖的正丁醇合成途径
CoA 依赖的正丁醇合成途径是产溶剂梭菌中天然存在的丁醇合成途径,也在其他类型微生物中完整地或者部分地存在。该途径的前体随底物代谢途径的变化而有所不同[8]。对食糖类或者食纤维素类微生物,其前体为糖酵解途径产生的丙酮酸;对食甘油类微生物,前体为甘油还原途径产生的丙酮酸;而对食气类微生物而言,前体为合成气经Wood-Ljungdahl 途径代谢产生的乙酰辅酶A。接下来,代谢进入以乙酰辅酶A 为起点的CoA 依赖的碳链延长途径。首先2 分子乙酰辅酶A 缩合(或经转乙酰基/羧化作用)形成1 分子乙酰乙酰辅酶A,然后还原为3-羟基丁酰辅酶A,接着脱水形成巴豆酰辅酶A,再还原为丁酰辅酶A,最后经醇醛脱氢酶2 步脱氢还原为丁醇[9]。
该途径的优点是,在产溶剂梭菌中该途径已经研究得比较清楚,可以比较方便地异源引入其他底盘细胞以合成丁醇。James Liao 实验室早在2008 年率先将丙酮丁醇梭菌中的CoA 依赖的丁醇途径基因导入大肠杆菌,并通过删除大肠杆菌内部旁路基因及优化培养方法进一步提升产量至0.55 g/L[10];同 年 晚 些 时 候,Jay Keasling 和Hideaki Yukawa 实验室也分别在大肠杆菌和酿酒酵母中以类似方法实现了丁醇生产,产量分别为1.18 g/L和25 mg/L[11-12]。
之后,相关研究逐渐拓展到其他非梭菌的宿主中,如恶臭假单胞菌(Pseudomonas putida)[13]、枯草芽孢杆菌(Bacillus subtilis)[13]、丁醇耐受性高的短小乳杆菌(Lactobacillus brevis)[14]、乙酰辅酶A前体丰富的解脂耶氏酵母(Yarrowia lipolytica)[15]、肺炎克雷伯氏菌(Klebsiella pneumonia)[16-17]、蓝藻(Synechocystis)[18-19]、酿酒酵母(Saccharomyces cerevisiae)[20-22]等,如表1所示。
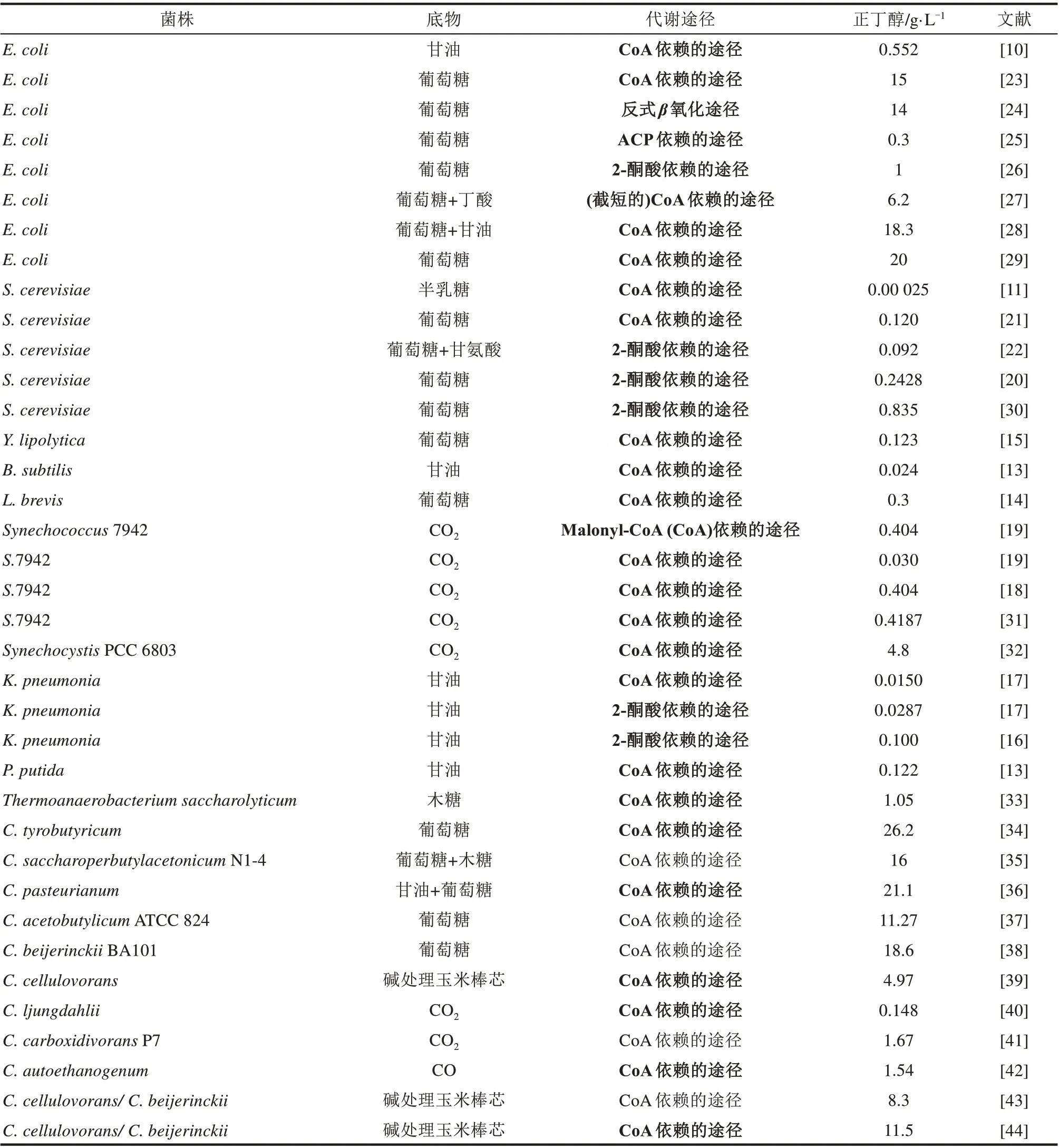
表1 各种微生物发酵生产正丁醇进展比较Tab.1 Comparison of n-butanol production by various microorganisms
需要指出的是,上述研究结果的丁醇产量普遍不高,这说明在异源宿主中直接引入的产溶剂梭菌丁醇合成途径可以实现丁醇合成,但在天然状态碳和还原力并不过多地往丁醇合成途径汇聚。原因一方面在于副产物分流,即在部分代谢节点如丙酮酸、乙酰辅酶A、乙酰乙酰辅酶A、丁酰辅酶A等存在2,3-丁二醇、乙醇、乙酸、丙酮、丁酸等合成途径,它们可能会消耗丁醇合成所需的碳流或还原力[45];另一方面,对氧气敏感而且催化方向可逆的BCD/ETFAB 酶复合体(丁酰辅酶A 脱氢酶)也被认为是影响异源丁醇产量的重要原因[10]。因此,如何寻找合适的催化不可逆反应的酶替代BCD/ETFAB,并合理设计和布局底盘细胞途径来驱动碳流和电子流往丁醇合成方向并减少副产物是至关重要的。
在新酶替代方面,Bond-Watts 等[46]于2011 年尝试了齿垢密螺旋菌(Treponema denticola)来源的反式二烯酰CoA 还原酶Ter(trans-enoyl-CoA reductase)。它能不可逆地催化巴豆酰辅酶A为丁酰辅酶A。于是研究者们在大肠杆菌中过表达真养产碱杆菌(Ralstonia eutrophus)来源的乙酰乙酰CoA 合酶基因phaA,齿垢密螺旋菌来源的ter,以及丙酮丁醇梭菌来源的hbd、crt、adhE2 基因组成杂合的CoA 依赖的丁醇合成途径。另外,过表达丙酮酸脱氢酶复合体操纵子aceEF.lpd 增加前体乙酰辅酶A 的供给,最终生产丁醇4.65 g/L,远超同类研究。同年,Liao 实验室也将ter 引入丁醇途径构建中,更进一步地,他们对底盘细胞大肠杆菌做了理性设计,通过敲除大肠杆菌中几乎所有还原力消耗途径(包括丁二酸、乙醇、乳酸等合成途径),构建了一个厌氧解救平台,迫使大肠杆菌只能通过生产丁醇来消耗还原力从而存活和实现胞内氧化还原平衡。最终获得的重组菌在摇瓶中可产15 g/L 丁醇[23]。这显示了不可逆酶引入与底盘细胞理性设计的巨大潜力,是电子流驱动碳流的经典案例。
在另外几个研究中,Liao 实验室延续了这一思路,不同的是以ATP 作为驱动力。他们先是在光能自养细长聚球藻(Synechococcus elongatus PCC 794)中构建了杂合的丁醇途径,接着替换了部分关键途径基因,利用ATP 驱动反应将乙酰CoA 转化为丙酰CoA,丙酰CoA 再与乙酰CoA 脱羧缩合驱动乙酰乙酰CoA 的生成,之后又将醛醇脱氢酶(AdhE2)替换为氧耐受的醛脱氢酶(PduP)和醇脱氢酶(YqhD),最终得到的重组藻种通过光和CO2培养12 天可积累产丁醇0.404 g/L[18,19,47]。
还有一种比较特殊的CoA 依赖的丁醇合成途径是利用脂肪酸-β-氧化中硫酯酶的逆反应,以乙酰CoA 为起点通过反式β-氧化实现碳链延长。Dellomonacol 等[24]在大肠杆菌MG1655 中实现了这一途径,重组菌可产丁醇14 g/L,丁醇转化率达到0.33 g/g 葡萄糖。目前在这一途径应用于丁醇生产的研究非常少,但也极具启发性。
1.2 2-酮酸依赖的正丁醇合成途径
2-酮酸是氨基酸合成及转化途径的中间产物,也是丁醛合成的前体物质,而丁醛仅需通过一步还原即可生产丁醇,因此某些氨基酸的代谢途径可用于丁醇合成。目前已报道的途径主要有2 种。一种是从TCA 循环中的草酰乙酸出发,经天冬氨酸和苏氨酸合成途径,生成2-酮基丁酸;2-酮基丁酸经2-异丙基苹果酸合酶作用生成苹果酸-2-乙酯,接着异构为苹果酸-3-乙酯,进一步脱羧氧化为2-酮基戊酸;2-酮基戊酸脱羧生产丁醛,丁醛还原生产丁醇[48]。另一种是从丙酮酸出发形成柠苹酸再脱羧氧化,生成2-酮基丁酸,最后生成2-酮基戊酸和丁醇[49]。
Liao 实验室最早开始这方面的尝试。他们证明,只需简单地表达酮酸脱羧酶和醇醛脱氢酶(乳酸乳球菌来源的酮酸脱羧酶Kvid和酿酒酵母来源的醇脱氢酶ADH2)即可实现丁醇及其他高级醇(如异丁醇、异丙醇等)的生产[48];另外,他们还尝试了过表达詹氏甲烷球菌来源的柠苹酸合酶(CimA)合成柠苹酸,再脱羧氧化到2-酮基丁酸、3-酮基戊酸,最后在Kivd 和ADH2 的催化下实现丁醇生产[49]。与Liao 实验室不同,伊利诺伊大学香槟分校赵惠民实验室以酿酒酵母为底盘细胞生产丁醇。他们对酿酒酵母的2-酮基戊酸途径做了深入改造,并理性设计了底盘细胞,丁醇产量最高可达0.835 g/L[20-21,30]。
最近报道的一种新途径是从甘氨酸出发,氧化为乙醛酸,然后与丁酰辅酶A 经苹果酸合酶催化生成苹果酸-3-乙酯,再脱羧氧化为2-酮基戊酸,最后一路脱羧还原得到丁醇。Branduardi 等[22]在酿酒酵母中通过表达甘氨酸氧化酶(goxB)实现了这一途径,但需要以甘氨酸作为辅助碳源,最终丁醇产量92 mg/L。
2-酮酸依赖的丁醇合成途径的优点是可以利用菌株内源的氨基酸代谢途径,只在关键代谢节点引入朝向丁醇合成代谢的酶即可。但缺点也很明显,部分宿主的氨基酸代谢流量偏低,导致丁醇普遍产量偏低,需要以氨基酸为辅助碳源,或者进一步改造提升氨基酸前体供应。
1.3 ACP依赖的正丁醇合成途径
ACP 依赖的丁醇合成途径以乙酰辅酶A 为起点,以脂肪酸合成的方式来实现碳链延伸。与CoA 依赖的途径不同的是,它合成的是脂酰-酰基载体蛋白(ACP),比如乙酰-ACP 和丙二酰-ACP。待两者缩合为乙酰乙酰-ACP 后,途径类似于CoA依赖途径的还原、脱水和还原,形成丁酰-ACP,再经酰基-ACP 硫酯酶剥离ACP,使之转化为相应的丁酸,再经羧酸还原酶形成丁醛,然后还原为丁醇。ACP 依赖的丁醇合成途径也可以视为脂肪酸合成途径的一部分,因而不需要绝对厌氧条件[25]。氧气的可及性在一定程度上甚至可以刺激丁醇合成。Jones 等[25]改造大肠杆菌获得丁酰-ACP,再由ACP 硫酯酶、羧酸还原酶(CAR)和醛还原酶(AHR)作用合成丁醇,在氧气存在条件下,可生产丁醇0.3 g/L,显示了较好的潜力。
表1比较了各种微生物利用不同原料合成丁醇的情况。可以看出,利用和改造CoA依赖的丁醇合成途径是主流,2-酮酸和ACP依赖的途径的报道相对较少,而且丁醇产量偏低。另外,丁醇合成的底盘细胞也由最初的产溶剂梭菌如丙酮丁醇梭菌、拜氏梭菌(Clostridium beijerinckii)[38]、糖丁酸多乙酸梭菌(Clostridium saccharoperbutylacetonicum)[35]等,逐渐拓展到大肠杆菌、酿酒酵母、枯草芽孢杆菌、肺炎克雷伯氏菌、蓝藻等模式微生物,以及一些有特殊潜能的底盘细胞,如解脂耶氏酵母(乙酰辅酶A 前体充足)、短小乳杆菌(丁醇耐受性高)等。值得一提的是,大肠杆菌、酿酒酵母等底盘细胞虽不能天然地合成丁醇,但其遗传背景清晰,遗传操作工具丰富,可进行比较复杂的遗传改造以理性设计合成途径,故而个别研究的丁醇产量已经接近甚至超过传统产溶剂梭菌的丁醇生产水平。然而,一个潜在的劣势是,经过多轮烦琐和复杂的遗传改造后,工程菌胞内辅因子平衡以及菌株鲁棒性可能比较脆弱,不太容易适应粗放的工业发酵条件。
产溶剂梭菌作为丁醇的天然细胞工厂,在产量和生产鲁棒性上有较大优势,然而难在遗传操作工具匮乏,以及底物谱狭窄[3,50]。幸运的是,近年来合成生物学的发展,已在很大程度上解决了这些困难,酪丁酸梭菌(Clostridium tyrobutyricum)[51]、永达尔梭菌(Clostridium ljungdahlii)[40]、嗜纤维梭菌(Clostridium cellulovorans)[52]等菌株的遗传操作系统和操作工具先后被开发出来,并被改造利用各种原料合成丁醇。
2 产正丁醇梭菌遗传操作工具开发
梭菌是原核生物中很重要的一个大类,包括近200 个不同的种[53]。梭菌来源广泛,大多数是梭状革兰氏阳性菌,专性厌氧,遇到恶劣环境产孢。基因组GC 含量低(一般在26%~32%)。按其致病性可分为致病性梭菌和非致病性梭菌,其中部分非致病性梭菌如丙酮丁醇梭菌、拜氏梭菌等由于能够利用淀粉、糖蜜等糖类原料发酵生产大宗的化学品如乙醇、丁醇、丙酮等,被称为产溶剂梭菌,有着重要的工业应用价值。还有部分梭菌能够直接以木质纤维素或者合成气(含氢气、一氧化碳、二氧化碳等)为原料生产短链的有机酸或者醇类,也具有很大的丁醇开发潜力[8]。
1992 年,Mermelstein 等鉴定并克服了质粒转移至丙酮丁醇梭菌的主要障碍——Ⅱ型限制性内切酶Cac824I,首次实现了对丙酮丁醇梭菌ATCC824 的代谢工程改造[54]。2001 年,丙酮丁醇梭菌ATCC824 基因组测序完成[55],这大大加速了梭菌遗传改造进展。此后,随着梭菌中各种Ⅱ型限制性内切酶和功能复制子的不断鉴定,更多的能够免于梭菌内限制修饰(R&M 系统)破坏的穿梭型质粒被开发出来,使得梭菌的DNA 转移技术取得很大进步,同时也发展出了多种遗传操作技术[56-60]。
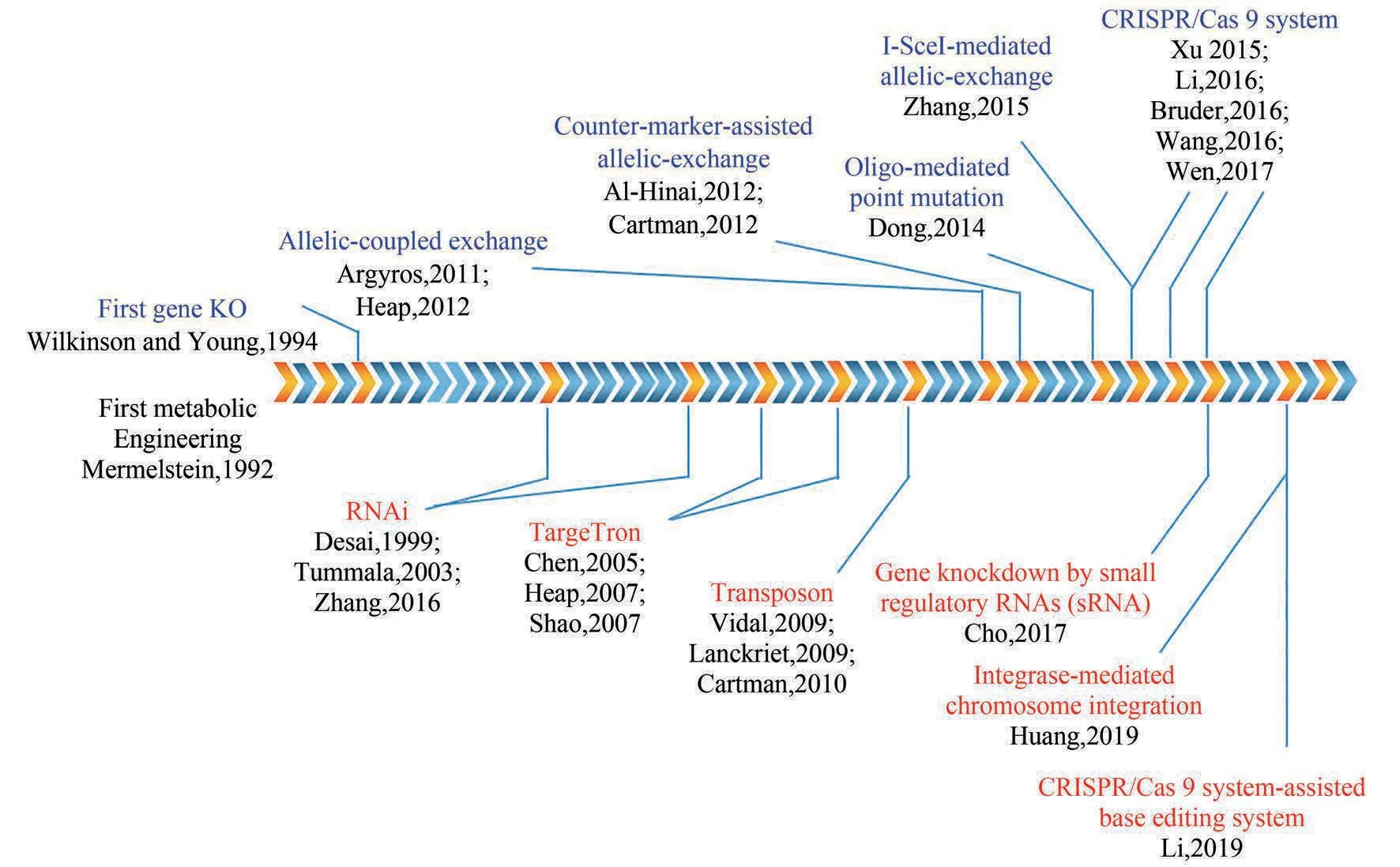
图2 梭菌遗传操作工具开发的里程碑式进展(蓝色字体代表基于同源重组的遗传操作工具,红色字体代表不依赖于同源重组的遗传操作工具)Fig.2 Milestones in the development of genetic manipulation tools for clostridia(Blue font represents genetic manipulation tools based on homologous recombination,and red represents genetic manipulation tools independent on homologous recombination)
图2列举了近年来梭菌遗传操作工具开发的里程碑式进展。可以看出,基于同源重组单交换的基因敲除研究早在1994 年就已经报道[61],但由于梭菌较弱的DNA 修复能力和很低的质粒转化效率,基于同源重组(homologous recombination,HR)的遗传工具很不好用,严重迟滞了梭菌的基因功能鉴定以及代谢工程研究。尽管不依赖于同源重组的RNA 干扰技术及其改进版本于随后几年被成功引入梭菌,但因只能在转录水平影响菌株,反响不大[62-63]。这一局面一直到TargeTron 技术的出现才得以扭转。TargeTron 是一种靶向基因编辑技术,它依赖于二型内含子的点特异性插入,而不是同源重组,因此非常适合梭菌的基因中断[64]。中科院上海植生所杨晟/姜卫红合作组和英国诺丁汉大学Nigel Minton课题组于2007年分别独立地开发了适用于产溶剂梭菌的依赖于乳球乳酸菌(Lactococcus lactis)来源的ⅡA 型内含子(Ll.LtrB)TargeTron 技术[65-66]。根据内含子上的识别序列与目的基因之间的配对作用具有特异性的原理,Nigel Minton 课题组还建立了名为“ClosTron”的网站(www.clostron.com),提供在线免费的内含子序列设计工具[67]。TargeTron技术几乎不具有宿主特异性,因此几乎适用于所有梭菌,如产溶剂梭菌Clostridium phytofermentans、C. butylicum、C. tyrobutyricum, 以及纤维素降解梭菌C.cellulolyticum、C. cellulovoran,还有食气梭菌C.ljungdahli、 C. autoethanogenum 等[65]。 此 外,Mohr 等开发了适用于用于嗜热梭菌[例如,热纤维梭菌(C.thermocellum)]的TargeTron 技术[68],这避免了中温TargeTron技术在嗜热菌中的低效率。然而,TargeTron 技术存在一些固有的缺陷,例如存在潜在的脱靶效应和一定概率的极性效应,以及只能中断而不是精确编辑目的基因等[50,69]。
通过单/双交换过程进行等位基因交换是基于同源重组进行精确基因编辑操作的经典遗传工具。它可以实现靶基因无痕的点突变、定点插入或者精确删除等操作。唯一的障碍是,由于梭菌的同源重组效率低和质粒转化效率低,获得阳性单交换突变株,或阳性双交换突变体的概率非常低[70],需要多次重复传代(积累转化子)以及大量的转化子验证才能筛选到罕见的阳性单交换突变株;引入反筛标记(如mazF和tdc 等)[71-72]或者归巢内切酶I-SceI[73],可以在第二次单交换时过滤掉绝大部分单交换突变株,减少验证双交换突变株的工作量,但仍然面临着较长的操作周期和较低的第一次单交换效率等问题。
在梭菌中引入CRISPR-Cas9 系统可有效提升第一次单交换频率,因为核酸酶Cas9 蛋白可以在sgRNA 引导下识别和切割梭菌基因组,在特定位点导致DNA 双键断裂(double strand break,DSB),迫使梭菌不得不启用DNA修复系统以完成同源重组,而未能完成同源同组(或DNA 修复)的菌株将被过滤掉,这大大加快了获得第一次单交换阳性突变株的进程[74]。然而,梭菌较低的同源重组效率往往导致DNA 双链断裂无法修复,即第一次单交换阳性突变株比较难以获得[75-76];此外,低的质粒转化效率进一步从转化层面上限制了阳性转化子的出现,也即在CRISPR-Cas9 系统及修复同源臂元件转化后往往没有或者仅有极少转化子出现。
为了避免双键断裂造成的细胞毒性,Xu 等[77]和Li等[75]分别在解纤维梭菌和丙酮丁醇梭菌中以Cas9刻痕酶(nCas9,nickase)替代Cas9进行基因编辑。nCas9 是Cas9 的突变体(D10A 或H840A),突变了2 个切割结构域(RuvC 或HNH)中的1 个,仅能切割DNA的一条链造成DNA缺刻,因而毒性较小。DNA 缺刻可在不严重伤害梭菌的同时,刺激梭菌启动同源重组修复,因而有效提升了CRISPR/nCas9 系统在梭菌中的基因编辑效率[75,77]。另外,CRISPR/Cpf1 也在艰难梭菌及产溶剂梭菌中有成功应用[78]。目前,大部分梭菌都是采用外源的CRISPR 系统进行基因编辑,也有少数借助内源CRISPR 系统实现基因组编辑的,如巴氏梭菌(Clostridium pasteurianum)[79]和酪丁酸梭菌(C. tyrobutyricum)[34]可分别利用自身的I-B 型CRISPR系统进行基因编辑。
在CRISPR-nCas9 基因编辑系统基础上,Li等[80]开发了该系统辅助的携带有胞苷脱氨酶(Apobec1)和尿嘧啶DNA 糖基化酶抑制剂(UGI)的碱基编辑系统。在该系统中,Apobec1和UGI可以有效地将CRISPR-Cas9 靶向窗口序列中的特定C·G 核苷酸碱基对转换为T·A,从而可以在基因中产生错义突变或无效突变。它与Cas9 介导的基因组编辑一样精确,但是不必切割DNA,因而它不需要DNA 修复模板。这个碱基编辑系统很容易设计和操作,并且在理论上可以编辑梭菌中的任何基因,极具应用潜力。
除基因组编辑外,CRISPR-Cas 系统还可用于调节基因表达[44,75,81],类似于经典的反义RNA技术[62-63],以及最近出现的基于小RNA 的基因下调技术[82]。CRISPR-Cas 系统也有望与传统的转座子技术结合(转座子技术可通过转座酶将随机插入失活这种突变形式引入基因组,以构建用于筛选特定表型的突变文库[83-86])。最近,Strecker 等在大肠杆菌中开发了一种具有CRISPR 相关转座酶的RNA引导的DNA插入方法[87]。该方法不依赖于同源重组,可望被引入梭菌中用于外源基因的染色体定点整合。事实上,Heap 等已在梭菌中开发了基于等位基因替换的目的基因染色体整合方法,并成功整合了超过40 kb 长λ 噬菌体染色体到丙酮丁醇梭菌中[88],但在实验设计、操作方面仍然比较麻烦,尤其在转化子获得和验证时易遭遇转化子少、假阳性高等挑战。最近Huang 等[89]开发了噬菌体丝氨酸整合酶介导的不依赖同源重组的染色体整合方法,但需预先利用CRISPR/Cas 系统或者别的方法将整合酶识别序列整合到染色体预定位置。
表2 总结和比较了各种遗传操作工具的原理效果以及优缺点。在CRISPR/Cas 系统出现之前,TargeTron 一直是梭菌基因敲除的首选,但是现在正逐步被CRISPR/nCas9 或者CRISPR/cpf1 以及它们辅助的碱基编辑技术替代。目前来看,CRISPR-Cas 系统是一种颠覆性技术,几乎完全改写了梭菌遗传操作技术发展的进程,但梭菌的同源重组能力低仍是编辑效率的瓶颈,需要通过引入诸如RecT 之类的重组元件来进一步提高[90]。
3 梭菌正丁醇合成途径改造研究进展
如前所述,丁醇是溶剂发酵的主要产物。一般来说,溶剂发酵结束时丁醇、丙酮和乙醇的质量比在6∶3∶1左右,也即丁醇仅占溶剂总量的大约60%。在梭菌中,丁醇合成从属于溶剂发酵,受溶剂发酵途径和调控的制约[6]。如图3所示,丁醇合成的主途径涉及的酶有Pfk/Pyk/Pfor(负责糖酵解途径以及前体丙酮酸和乙酰辅酶A 的合成和供应)、Thl/Hbd/Crt/Bcd-ETFAB(负责碳链延长及丁酰辅酶A 供应)、Aad/Ald/Bdh(负责丁酰辅酶A还原和丁醇生成)。副产物途径涉及的酶有Pta/Ack(负责乙酸合成)、Aad/Ald/Bdh(与丁醇合成途径相同,负责乙酰辅酶A 的还原和乙醇合成)、Ptb/Buk(负责丁酸的合成)、CtfAB/Adc(负责丁酸、乙酸的回用,以及丙酮的合成)。在部分梭菌中还存在2,3-丁二醇以及异丙醇的合成途径。副产物途径的存在导致了丁醇产量及丁醇比例不高等问题,影响了丁醇生产的经济性。丰富的适用于梭菌的遗传操作工具,为丁醇合成途径的代谢工程改造提供了便利条件。前述遗传操作工具多数已被应用于丁醇合成途径及竞争途径的改造或者调试,以进一步提升丁醇的产量、比例,或者摆脱原有途径及调控约束,从头构建丁醇途径。
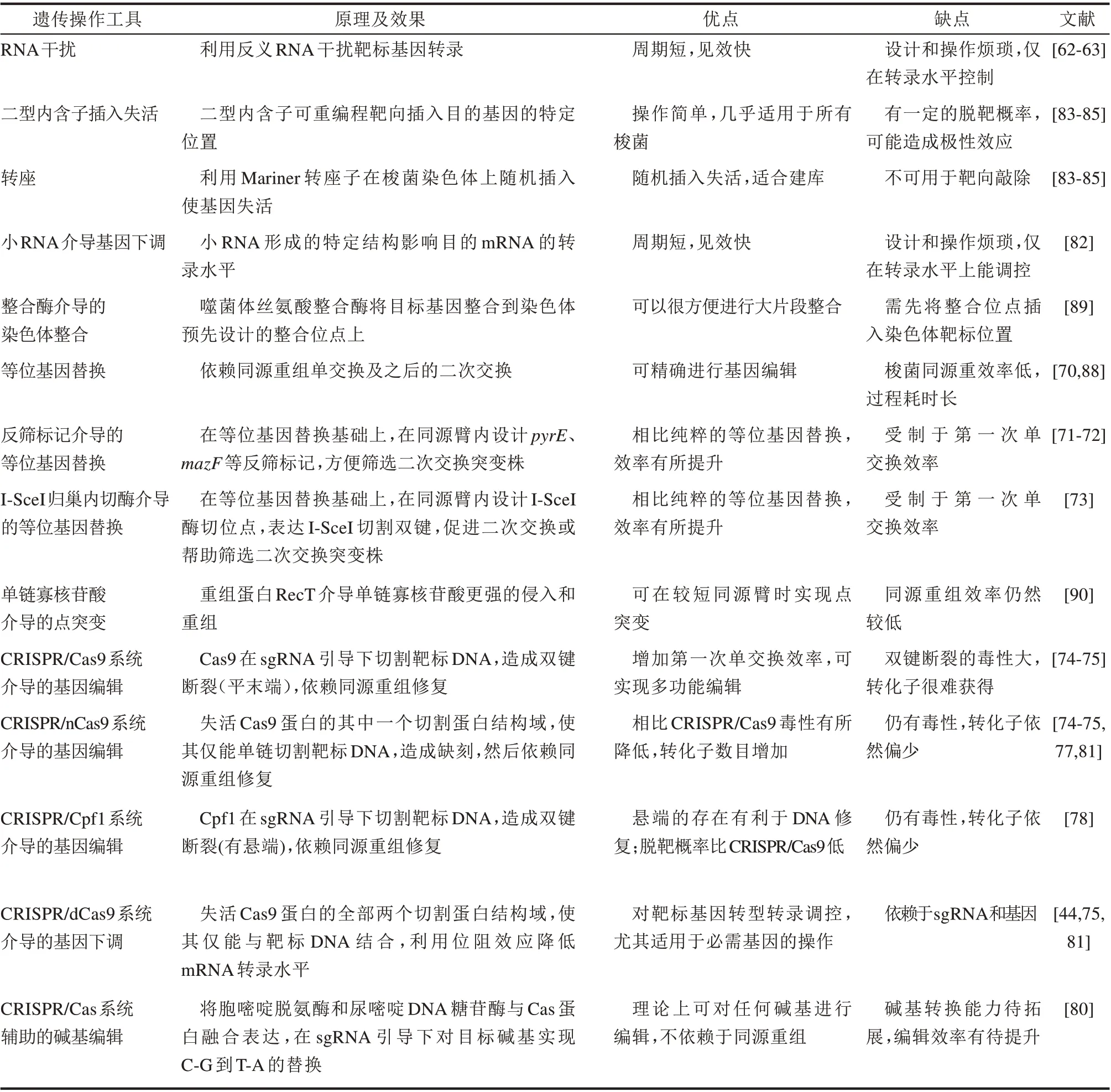
表2 梭菌遗传操作工具比较Tab.2 Comparison of different genetic tools applicable in Clostridium
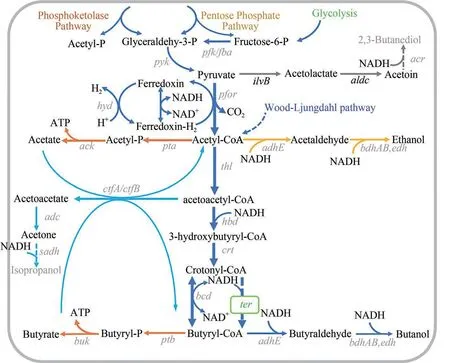
图3 梭菌正丁醇合成途径代谢工程改造(图中所示基因表达的酶:pfk—6-磷酸果糖激酶;fba—果糖-二磷酸醛缩酶;pyk—丙酮酸激酶;ilvB—乙酰乳酸合酶;aldc—乙酰乳酸脱羧酶;acr—乙偶姻还原酶;pfor—丙酮酸-铁氧还蛋白氧化酶;hyd—氢酶;pta—乙酰基磷酸转移酶;ack—乙酸激酶;thl—硫解酶;hbd—3-羟基丁酰CoA 脱氢酶;crt—巴豆酸酶;bcd—丁酰CoA 脱氢酶;ter—反式烯酰辅酶A 还原酶;ptb—磷酸丁酰转移酶;buk—丁酸激酶;ctfAB—乙酰乙酰CoA:乙酸/丁酸:CoA转移酶;adc—乙酰乙酸脱羧酶;sadh—异丙醇脱氢酶;adh—乙醇脱氢酶;bdh/edh—丁醇/乙醇脱氢酶;adhE—醇/醛脱氢酶)Fig.3 Metabolic engineering of clostridia for n-butanol production(pfk—6-phosphofructokinase; fba—fructose-bisphosphate aldolase; pyk—pyruvate kinase; ilvB—acetolactate synthase; aldc—acetolactate decarboxylase; acr—acetoin reductase; pfor—pyruvate-ferredoxin oxidoreductase; hyd—hydrogenase; pta—phosphate acyltransferase; ack—acetate kinase; thl—thiolase; hbd—3-hydroxybutyryl-CoA dehydrogenase; crt—crotonase; bcd—butyryl-CoA dehydrogenase; ter—trans-enoyl-CoA reductase; ptb—phosphobutyryl transferase; buk—butyrate kinase; ctfAB—acetoacetyl-CoA: acetate/butyrate: CoA transferase; adc—acetoacetate decarboxylase; sadh—isopropanol dehydrogenase; adh/edh—alcohol/ehanol dehydrogenase; bdh/edh—butanol/ehanol dehydrogenase; adhE—alcohol/aldehyde dehydrogenase)
3.1 代谢途径改造提升正丁醇产量
产溶剂梭菌的丁醇产量一般在10 g/L左右,距离菌株对丁醇的耐受极限(15~20 g/L)还有一定距离,因而有较大的提升空间[2]。低的丁醇浓度大幅增加了后续产物分离能耗和成本。据推测,传统丁醇发酵过程产物分离成本约占总成本的20%,而丁醇浓度由12 g/L 提高至19 g/L 时产物分离成本可降低一半[91]。现有的丁醇产量提升的策略很容易理解,主要通过增强主途径,弱化或者删除副产物途径来实现,有关进展如表3所示。
在主途径增强方面,增加前体如丙酮酸或者乙酰辅酶A 供应,疏通/增强碳链延长途径增加丁酰辅酶A 供给,以及强化丁酰辅酶A 还原最常用到。Ventura 等[92]过表达了内源的6-磷酸果糖激酶基因(pfkA)和丙酮酸激酶基因(pykA),提高了糖酵解通量,增加了ATP 和NADH 供应,使丙酮丁醇梭菌ATCC 824 的丁醇产量提高了29%,达到19.12 g/L。在另一项研究中,Mann等[93]过表达了点突变的硫解酶基因(thl)(R133G,H156N;G222V)(硫解酶对HS-CoA 非常敏感,微摩尔水平抑制效应就很明显;3 处点突变减弱了辅酶A 对硫酯酶的反馈抑制),增强了Thl 催化乙酰辅酶A缩合的能力,促进了主途径代谢,结果丁醇产量增加18%,达到12.4 g/L。类似地,Li 等[94]在C.diolis DSM 15410 中过表达了齿垢密螺旋菌来源的
反式烯酰辅酶A 还原酶基因(ter),不可逆地催化巴豆酰辅酶A 为丁酰辅酶A,以对冲内源的Bcd-ETFAB 的可逆催化效应,更大程度地将碳流往丁酰辅酶A 方向拉动,使得重组菌的丁醇产量因此提升了50.5%。同样,Hou 等[95]在丙酮丁醇梭菌ATCC824 中过表达主途径基因thl-hbd-crt-bcd 也增强了丁醇生产。在丁酰辅酶A 还原方面,主要用过表达野生型醇醛脱氢酶基因aad(或adhE)及其突变体aadD458G(485 位天冬氨酸突变为甘氨酸后,Aad 对NADH 和NADPH 均有较好亲和力,扩大了还原力来源范围)来实现丁醇增产[37,97-98]。在丙酮丁醇梭菌ATCC 824 中,aadD458G的过表达使丁醇增产11.3%;进一步表达拜氏梭菌(C.beijerinckii)来源的醛脱氢酶基因(ald),以及永达尔梭菌(C.ljungdahlii)来源的丁醇脱氢酶基因(bdh)时,丁醇产量增加了27.1%,达到16.9 g/L[98]。
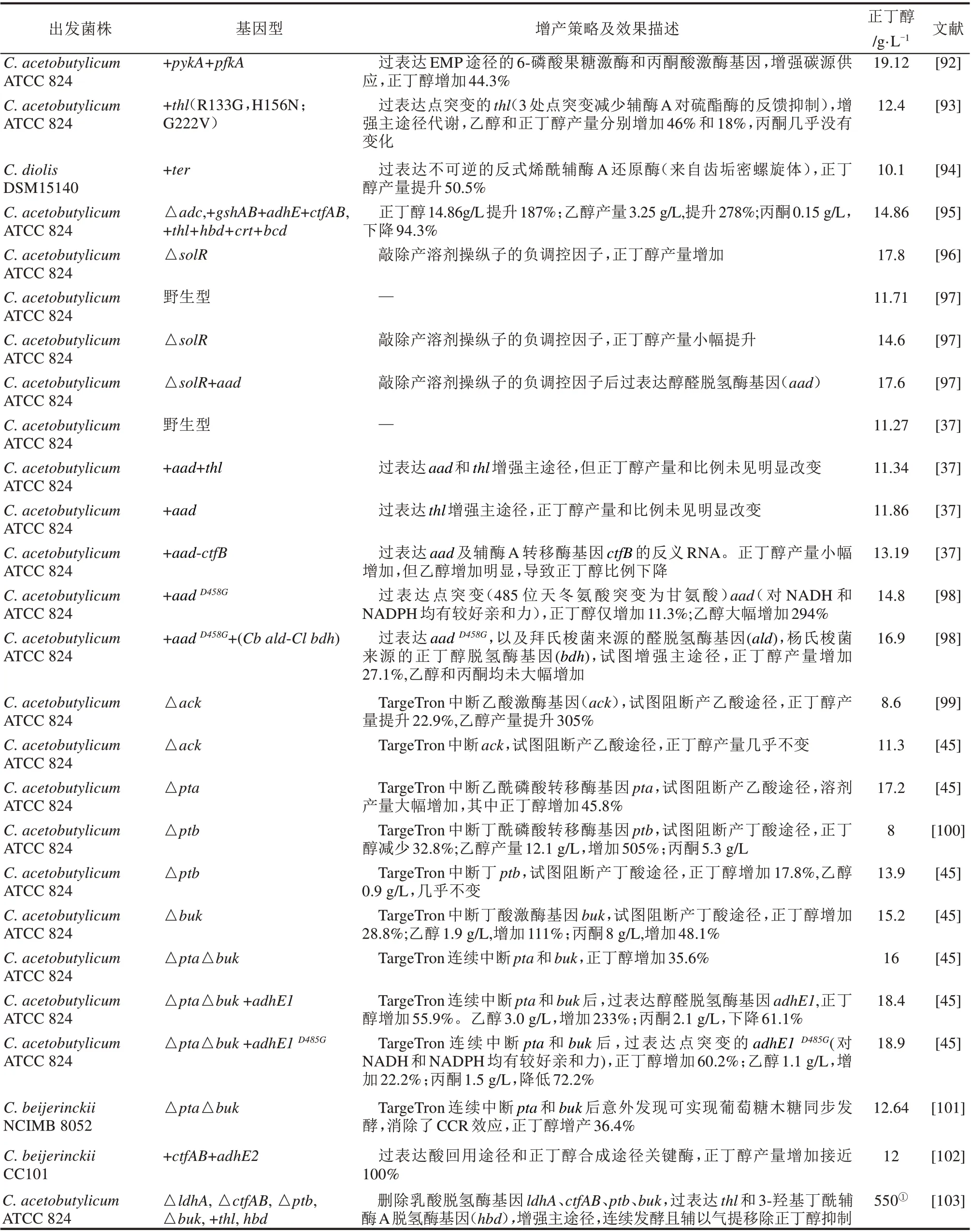
表3 正丁醇产量提升进展Tab.3 Summary of n-butanol titer enhancement in Clostridium
在副产物途径弱化或敲除方面,乙酸途径往往是首选。Cooksley等[99]用TargeTron中断了丙酮丁醇梭菌的乙酸激酶基因(ack),丁醇产量有22.9%的提升;而在另一个丙酮丁醇梭菌的研究中,Jang 等[45]同样以TargeTron 中断了(ack)(中断位点不同),丁醇产量却未见明显变化;有趣的是,当他们以TargeTron 中断乙酰基磷酸转移酶基因(pta)时,溶剂产量大幅增加,其中丁醇增加45.8%达到17.2 g/L;乙醇增加100%达到1.8 g/L,丙酮增加42.6%达到7.7 g/L。关于丁酸途径的弱化,Green 等[104]以非复制型质粒整合的方法敲除了丁酸激酶基因(buk),突变株的丁醇浓度提高10%。利用反义RNA技术下调buk基因转录的菌株也有类似表型[62]。在另一项研究中,Jang 等以TargeTron技术分别中断了丁酸途径相关基因ptb和buk。其中ptb 的中断提升了丁醇产量17.8%达到13.9 g/L(乙醇产量几乎不变);而buk 的中断使丁醇产量增加28.8%,达到15.2 g/L,同时乙醇和丙酮也分别有111%和48.1%的增加[45]。至于乙酸和丁酸途径的组合敲除,Jang 等也有尝试。他们以TargeTron 连续中断了pta 和buk 基因,丁醇增加35.6%,达到16 g/L。产酸途径的单独或组合敲除在另一种重要的产溶剂梭菌拜氏梭菌中也有较多研究。Wang 等[105]在拜氏梭菌NCIMB 8052 中分别敲除buk 和pta 基因,敲除菌产丁醇浓度分别提高28%和12%。而Liu 等[101]在连续中断了pta 和buk 后,突变株的丁醇产量提升了36.4%,达到12.64 g/L。意外的是,Liu等发现突变株的碳源利用有明显变化,葡萄糖、木糖利用几乎可以同步进行。
相比于单独的主途径增强或者副产物途径弱化,组合策略往往有更好的效果。Jang等[45]在pta和buk 组合敲除菌株的基础上,过表达了醇醛脱氢酶基因的突变体adhe1D485G(485位天冬氨酸突变为甘氨酸后,AdhE1对NADH 和NADPH 均有较好亲和力,扩大了还原力来源范围),拉动碳流往丁醇方向,使丁醇产量达到18.9 g/L,优于以往任何重组的产丁醇梭菌。在最近的一个研究中,Ngoc-Phuong-Thao 等[103]连续删除了乳酸合成途径基因ldhA,酸回用途径基因ctfAB,丁酸合成途径基因ptb 和buk,并同时过表达了thl 和3-羟基丁酰辅酶A脱氢酶基因(hbd)增强主途径。作者没有明确菌株的间歇发酵表型,但在连续发酵且辅以气提移除丁醇抑制的条件下,丁醇产量达到惊人的500 g/L。
需要说明的是,以上研究中的乙酸和丁酸途径基因的单独或者组合中断,并没有完全消除乙酸或丁酸的生产,这暗示可能存在未知的酸合成途径[45]。另外,ptb 基因的敲除、中断或者转录下调操作需要谨慎,因为其催化产物丁酰磷酸是胞内重要的磷酸基团供体,对全局性的代谢调控有较大影响,也许会降低丁醇产量[106]。至于个别文献之间的相同基因的中断或者敲除的效果迥异甚至互相矛盾的现象,也要辩证看待,要考虑到遗传操作工具的局限性(如脱靶、极性效应等)以及实验设计的严谨性(比如是否有对照试验,敲除基因的补全实验等)。
3.2 代谢途径改造提升正丁醇比例
目前产溶剂梭菌的丁醇得率普遍在0.2 g/g 葡萄糖左右,远低于按化学计量学计算出来的理论得率(0.41 g/g)[2,6,91]。丁醇比例的提升有望在丁醇得率、产物分离等方面提升丁醇发酵的经济性,因而一直是重要的努力方向。众所周知,溶剂发酵是个典型的双阶段过程,分为“产酸期”和“产溶剂期”。在产酸期,梭菌利用碳源快速增殖,通过底物磷酸化过程产生丁酸、乙酸和ATP,pH迅速下降;在第二阶段,丁酸和乙酸被梭菌通过辅酶A 转移酶(CoA-transferase,CTFAB)回用,pH缓慢回升。酸回用可消除酸的毒性作用,同时为乙醇和丁醇的合成提供乙酰辅酶A和丁酰辅酶A等前体,但也导致副产物丙酮的生成。所以,尽管增强酸回用途径也是一种重要的丁醇增产策略,但它可能会在一定程度上降低丁醇比例,因而一般会谨慎使用[107]。丙酮是梭菌丁醇发酵的主要副产物,阻断或者减少丙酮的合成是提高丁醇比例的关键[108]。
如图3 所示,丙酮的合成途径与辅酶A 转移酶(CTFAB)以及乙酰乙酸脱羧酶(ADC)密切相关,因而它们成为最主要的改造靶点。Papoutsakis ET课题组最早尝试利用反义RNA(antisense RNA,atRNA)抑制丙酮合成途径。他们发现adc 的转录下调并不会显著影响丙酮产量(因为可能存在自发的脱羧反应),而辅酶A转移酶CTFAB的下调导致丙酮和丁醇产量同时下降(下降近1/3),尽管丁醇比例有一定提升,但并不具有实际意义[37,63]。TargeTron 技术出现后,Jiang等[108]在丙酮丁醇梭菌EA2018中利用该技术首次成功中断adc基因,证实adc的缺失确实会同步影响丁醇产量。不过经发酵条件优化(培养基中添加CaCO3及甲基紫精),丁醇产量仍可以回复。最终,重组菌的丙酮产量降低至0.1 g/L,下降90.8%,而丁醇产量达到14.1 g/L,比例由70% 提 升 至82%。后 来,Cooksley 等[99]和Lehmann等[109]也分别尝试了adc的中断,确认丙酮途径的阻断会显著影响丁醇的合成。在辅酶A转移酶的中断方面,Cooksley 等发现分别中断ctfA 和ctfB,丙酮会完全消失,但乙醇和丁醇产量也有明显降低;Lehmann等证实了ctfA的中断结果[109],而Jang 等证实了ctfB 的中断结果[45]。上述研究说明,在产溶剂梭菌中,丙酮的生产与丁醇的高产存在很大程度上的耦联关系,试图通过改造丙酮合成途径实现丁醇高量和高比例生产有很大难度。所以,在维持丙酮合成途径的同时,通过前述策略尽可能提升丁醇产量,进而提升丁醇比例可能是比较可行的方法。事实上,Jang等[45]通过敲除产酸途径以及过表达丁醇合成途径关键酶获得的几株丁醇高产菌的丁醇比例都在80%左右,最高可达87.8%。Hou等[95]敲除了丙酮丁醇的adc 基因,同时以过表达ctfAB以及主途径的thl-hbd-crt-bcd-adhE关键基因来补偿丁醇合成,获得的突变株实现了丁醇增产和比例增加的双重效果(产量14.86 g/L,比例81.4%)。
以上研究主要是是在产溶剂梭菌中进行(如表4 所示),很难突破双阶段溶剂发酵特性的刚性约束,也就无法实现丁醇合成与丙酮合成的解耦。如果从普通底盘细胞的角度看待梭菌,完全可以重构非丙酮耦联的丁醇合成途径,从而实现同型丁醇(homobutanol)发酵[7]。

表4 正丁醇比例提升进展Tab.4 Summary of n-butanol ratio enhancement in Clostridium
3.3 代谢工程重构正丁醇合成途径
近年来,随着系统生物学和合成生物学的发展,越来越多的非常规梭菌开始进入科学家视野,包括产丁酸梭菌(如C. butylicum 和C. tyrobutyricum)、食气梭菌(如C. ljungdahli、C. autoethanogenum、C. carboxidivorans P7)、纤维素降解梭菌(如C.cellulolyticum、C.cellulovoran 和C.thermocellum)、甘油利用梭菌(如C. pasteurianum 和C. diolis)等[8]。它们的遗传背景日渐清晰,遗传操作系统和遗传操作工具也在不断完善,有作为底盘细胞的潜力。由于同属梭菌属,CoA依赖的丁醇合成途径在这些梭菌中天然地全部或者部分地存在(如图4所示),为丁醇代谢途径重构提供了极大便利。
酪丁酸梭菌(C.tyrobutyricum)是最高效的发酵糖类原料生产丁酸的梭菌之一,在优化的培养条件下,批次发酵丁酸产量接近50 g/L[110]。该菌有非常特殊的丁酸和乙酸回用机制,借助其独有的辅酶A转移酶(Cat1)可以将乙酸、丁酸高效转化为乙酰辅酶A和丁酰辅酶A,完全不需要和丙酮合成耦联。以上特点使得C. tyrobutyricum 特别有潜力作为丁醇高效合成的底盘细胞。俄亥俄州立大学杨尚天课题组长期致力于酪丁酸梭菌的研究,在丁酸和丁醇合成途径重构、底物范围拓展、纤维床生物反应器开发、连续发酵工艺优化等领域取得多项重要进展[110]。他们仅在酪丁酸梭菌引入丙酮丁醇梭菌来源的醇醛脱氢酶(AdhE2),便可使重组菌以葡萄糖为碳源生产1.1 g/L丁醇。在ack基因缺失的底盘中如此操作,丁醇产量达到10 g/L[51];他们曾尝试在此突变株的基础上过表达拜氏梭菌来源的辅酶A 转移酶基因ctfAB,但对丁醇产量增加的贡献有限(从10 g/L提升到12 g/L),且引入了丙酮这一副产物[111]。在其他的研究中,他们尝试了多种农林废弃物资源(如木薯渣、玉米纤维、棉花秸秆、甘蔗渣等)的水解液作为碳源,丁醇产量均超过12 g/L。特别需要指出的是,当该菌以还原性底物山梨醇为碳源时,产量甚至可达20.5 g/L[51,111-114]。最近,美国奥本大学王义课题组刷新了这一纪录。他们在测试酪丁酸梭菌内源Type I-B CRISPR/Cas系统的基因编辑效果时,偶然发现使用醇醛脱氢酶基因adhE2原位替换替代cat1基因后,丁醇产量达到史无前例的26.2 g/L[34]。然而该菌的副产物乙酸和丁酸的终浓度仍然较高(分别为15.2 g/L 和2.4 g/L),因此需要继续深入精细设计酸回用途径,使更多碳流用于丁醇合成。
与酪丁酸梭菌类似,嗜纤维梭菌(C.cellulovoran)的主要产物也是丁酸,而且可以直接以纤维素原料为碳源底物[39]。尤其值得注意的是,该菌种有完整的非丙酮耦联的CoA 依赖的丁醇合成途径,但是几乎不能生产丁醇。在嗜纤维梭菌中重构丁醇途径长期受困于遗传操作系统和工具的匮乏。杨尚天课题组最早鉴定了该菌的限制修饰系统,并通过过表达醇醛脱氢酶的方法使该菌能利用微晶纤维素生产丁醇[52]。同期,中科院上海植生所杨晟课题组也独立开发了该菌的遗传操作系统,并在该菌中验证了TargeTron、Allelic exchange、CRISPR/Cas9 等多种遗传操作工具的效果[44]。基于这些遗传操作工具,Wen 等[115]在一个可耐受高浓度丁醇的嗜纤维梭菌驯化株中通过补全溶剂发酵途径(表达ctfAB-adc-adhE1 基因)的方式实现了3.47 g/L 丁醇生产,但有副产物丙酮的产生。在接下来的研究中,Wen 等[39]对嗜纤维梭菌的丁醇合成途径进行了从头设计,以避免副产物丙酮,并提升丁醇得率。他们聚焦于糖-乙酰辅酶A-丁酰辅酶A-丁醇的代谢途径的4 个限速步骤(木糖利用、乙酸/丁酸回用、丁酰辅酶A 可逆合成、丁醛还原),提出基于碳流“推—拉”策略的代谢工程改造思路。获得的工程菌的丁醇产量较野生型提升了235 倍,达到4.96 g/L,为重组单梭菌直接降解木质纤维原料产丁醇的最高水平,展示了嗜纤维梭菌在直接降解纤维素产丁醇领域的应用潜力。杨尚天课题组[116]也在对嗜纤维梭菌的潜力做持续挖掘和探索,最新研究的丁醇产量(以微晶纤维素为碳源)已达到4.0 g/L。
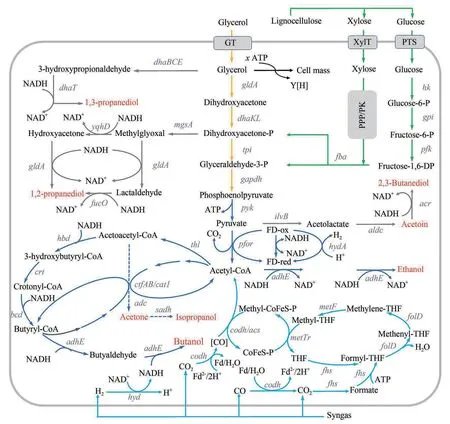
图4 梭菌的正丁醇合成途径重构[绿色代表梭菌的糖类代谢途径;黄色代表梭菌的甘油代谢途径;湖蓝色代表食气梭菌的合成气代谢途径;正蓝色代表梭菌内的正丁醇代谢途径(部分梭菌途径并不完整)。图中所示基因表达的酶:dhaBCE—甘油脱水酶;dhaT—1,3-丙二醇脱氢酶;gldA—甘油-3-磷酸脱氢酶;dhaKL—磷酸二羟丙酮激酶;mgsA—甲基乙二醛合酶;yqhD—醇脱氢酶;fucO—1,2-丙二醇脱氢酶;hk—己糖激酶;gpi—果糖-6-磷酸异构酶;gapdh—甘油醛-3-磷酸脱氢酶;codh—一氧化碳脱氢酶;acs—乙酰辅酶A 合酶;fdh—甲酸脱氢酶;fhs—甲酰-四氢叶酸合成酶;folD—亚甲基四氢叶酸环化酶/脱氢酶;metF—亚甲基四氢叶酸还原酶;metTr—甲基转移酶;cat1—辅酶A转移酶(图3已出现的基因代表的含义此处不再列出)]Fig.4 Reconstruction of n-butanol synthesis pathway in clostridia[Green lines represent carbohydrate metabolic pathway; the yellow lines represent the glycerol metabolic pathway; the lake blue represents the syngas metabolic pathway in gas-fermenting clostridia; the positive blue lines represent the synthesis pathway of n-butanol in Clostridium.dhaBCE—glycerol dehydratase; dhaT—1,3-propanediol dehydrogenase; gldA—glycerol-3-phosphate dehydrogenase; dhaKL—dihydroxyacetone phosphate kinase; mgsA—methylglyoxal synthase; yqhD—alcohol dehydrogenase; fucO—1, 2-propanediol dehydrogenase; hk—hexokinase;gpi—fructose-6-phosphate isomerase; gapdh—glyceraldehyde-3-phosphate dehydrogenase; codh—carbon monoxide dehydrogenase;acs—acetyl-CoA synthase; fdh—formate dehydrogenase; fhs—formyl-tetrahydrofolate synthase; folD—methylenetetrahydrofolate cyclase/dehydrogenase; metF—methylenetetrahydrofolate reductase; metTr—methyltransferase; cat1—CoA transferase (Genes appeared in Figure 3 is not listed here)]
同为纤维素降解菌,解纤维梭菌(C.cellulolyticum)和热纤维梭菌(C.thermocellum)没有像嗜纤维梭菌中那样完整的乙酰辅酶A 到丁酸的代谢途径,产物主要是乙酸和乙醇。在解纤维梭菌和热纤维梭菌中需重建乙酰辅酶A到丁酰辅酶A的碳链延长途径(包括thl-hbd-crt-bcd等基因),以及丁酰辅酶A 的还原途径(包括adhE 等基因)。Gaida 等[117]和Tian等[118]分别在解纤维梭菌和热纤维梭菌中重建了丁醇合成途径,相应的丁醇产量仅分别达到0.12 g/L 和0.357 g/L,这暗示复杂的途径重建的效果有时不尽人意,更精细的途径规划和理性设计势在必行。
以合成气(包括氢气、一氧化碳和二氧化碳)为原料的食气梭菌也面临上述这样的问题。食气梭菌的产物往往以乙酸(和乙醇)为主。这意味着,要使这些菌株生产丁醇,就必然要引入碳链延长和丁酰辅酶A 还原途径。以研究得比较多的C. ljungdahli、C.autoethanogenum 为例,两菌通过Wood-Ljungdahl(WL)途径(也称还原性乙酰辅酶A途径)来吸收和固定CO2和CO。该途径是由甲基分支反应和羰基分支反应两个通路组成。CO2经甲基分支反应途径生成甲基四氢叶酸。随后与(CO或CO2经羰基分支反应形成的)碳基以及辅酶A、甲基在一氧化碳脱氢酶/乙酰辅酶A合成酶(CODH/ACS)的催化下形成乙酰辅酶A,然后进入中心代谢途径[119]。WL途径的效率决定了乙酰辅酶A的供给水平,也决定了乙酰辅酶A下游途径的代谢通量。食气梭菌C. ljungdahli、C.autoethanogenum、C.aceticum等的遗传操作系统已经建立[40,119-122],引入异源的碳链延长途径以及丁酰辅酶A还原途径也不十分困难,但仅有少数几个产微量丁醇的报道,这暗示丁醇途径重构与调试还有问题有待解决。食气梭菌C.carboxidivorans P7可天然地利用合成气生产浓度在g/L水平的丁醇和己醇[41],显示了极大的潜力,但该菌的遗传操作系统开发尚未报道。
常见的利用甘油的梭菌如巴氏梭菌(C.pasteurianum)中尽管有完整的丁醇代谢途径,但是以甘油为唯一碳源时,1,3-丙二醇产量很高,有时甚至超过丁醇[123]。有研究表明,引入糖类作为共同碳源,通过优化甘油和糖的配比,可以显著降低1,3-丙二醇产量[36]。但要完全消除1,3-丙二醇的合成,则必须对1,3-丙二醇合成途径或者丁醇合成途径进行改造。Pyne 等[124]在C.pasteurianum ATCC 6013 中以TargeTron 中断了1,3-丙二醇脱氢酶基因dhaT 后,丁醇产量提升近30%,1,3-丙二醇产量减少超过80%,意外的是1,2-丙二醇代谢途径变得活跃,产生了0.43 g/L 1,2-丙二醇;在另一项研究中,Schwarz 等[125]开发了一种适用于巴氏梭菌的基于同源重组的无痕基因敲除方法,成功删除了甘油脱水酶基因(dhaBCE),完全消除了1,3-丙二醇的合成,而丁醇的合成几乎不受影响(最终生产了约7 g/L)。他们还测试了与产溶剂途径密切相关的脱氢酶基因hydA以及氧化还原响应调控基因rex的敲除对代谢途径的影响,发现敲除前者可使1,3-丙二醇产量降低19%(约12 g/L),丁醇产量提高12.8%(约7.78 g/L);敲除后者可使1,3-丙二醇产量降低50%(约7 g/L),丁醇产量提高43%(约9.8 g/L)。这再次证实,在以甘油为底物时,梭菌内的1,3-丙二醇途径和丁醇合成途径在碳流和电子流方面存在紧密而复杂的联系,要完全解耦两者,实现完全的丁醇合成,必须敲除1,3-丙二醇途径。
值得注意的是,丙酮丁醇梭菌中也有丁醇合成途径重构的研究。丙酮丁醇梭菌很早就被观察到,当它丢失携带产溶剂操纵子(sol operon)的大质粒pSOL1时,其产溶剂能力丧失,也即菌株退化(退化的菌株被命名为M5 或者DG1)[126-127]。丙酮丁醇梭菌的这一特性,让研究者意识到,可以在突变株中重构非丙酮耦联的丁醇合成途径。Nair 和Papoutsakis[127]最早在突变株M5中引入醇醛脱氢酶基因(ald),发现重组菌可回复丁醇生产至6.23 g/L,没有丙酮产生。大质粒丢失导致M5 缺失酸回用途径,因而乙酸、丁酸积累较多,Sillers 等[128]尝试在M5 中分别敲除ack 和buk 基因,然后转入ald,但仅获得乙酸敲除株的过表达转化子,且该突变株的丁醇产量未见明显提高。Jang等则在M5中同时过表达了ald及ctfAB,可使丁醇浓度提高到11.41 g/L,但仍有较多乙酸和少量积累[129]。
总的来说,丁醇合成途径的重构摆脱了产溶剂梭菌的溶剂发酵途径和调控机制的约束,在同型丁醇发酵以及丁醇高产方向已取得重要进展,如表5所示。更重要的是,该策略很好地借助了各种梭菌的固有的碳源利用能力,赋能梭菌直接利用木质纤维原料(农业废弃物)、甘油(生物柴油的主要副产物)或合成气(工厂尾气)等生产丁醇,极大地拓展了丁醇的原料范围,是未来的重要研究方向。
4 代谢工程改造产正丁醇梭菌的戊糖代谢途径
直接利用木质纤维原料或合成气发酵生产丁醇代表了未来的重要发展方向,而当前,使用木质纤维原料(如秸秆、玉米芯等)经物理或者化学预处理后的酶解液作为碳源是非粮丁醇发酵成本最低,最接近工业化的选择[2]。木质纤维原料的酶解液成分复杂,除了少量的乙酸、糠醛、呋喃、5-羟甲基糠醛等发酵抑制物,主要是D-葡萄糖、D-木糖、L-阿拉伯糖、D-半乳糖、D-甘露糖等各种糖类物质,其中木糖和阿拉伯糖的含量仅次于葡萄糖。由于碳源代谢抑制效应,在葡萄糖存在的情况下,梭菌无法高效利用木糖、阿拉伯糖等戊糖,这严重影响了丁醇发酵的速率以及得率[132]。改进梭菌戊糖利用效率的第一步是理解梭菌的戊糖转运、代谢途径,及其碳源代谢抑制效应的调控机制,然后再进行针对性改造。不过,梭菌戊糖代谢的解析、重构及工程改造一直在交织进行,从未严格分开(表6)。

表5 正丁醇合成途径重构研究进展Tab.5 Summary of n-butanol synthesis pathway reconstruction in Clostridium
2010 年,Gu 等[140]率先通过使用TargeTron 结合其他遗传和生化方法,鉴定了丙酮丁醇梭菌中木糖代谢的一些关键基因,并根据他们以前的研究和比较基因组学的预测,在丙酮丁醇梭菌中重建了木糖代谢途径。接着,Liu 等[141]通过同位素示踪技术揭示了丙酮丁醇梭菌如何通过戊糖磷酸途径(PPP)和磷酸酮醇酶途径(phosphoketolase pathway,PK 途径)同时代谢木糖。他们用TargeTron 敲除了xfp(CA_C1343,编码木酮糖-5-磷酸/果糖-6-磷酸酮醇酶)基因,出乎意料地发现木糖代谢没有明显变化。有趣的是,该基因与阿拉伯糖的磷酸酮醇酶代谢途径密切相关,这已被Servinsky 等证实[142]。在另一项研究中,Zhang等[143]利用TargeTron 分析了丙酮丁醇梭菌中阿拉伯糖代谢调控基因araR 和核糖激酶基因araK 的功能,然后重建了阿拉伯糖代谢途径。上述研究基本上比较清晰地绘制了产溶剂梭菌中戊糖转运代谢途径,即木糖和阿拉伯糖经各自的特异性转运蛋白进入胞内后,各自经过异构及磷酸化作用后汇聚于木酮糖-5-磷酸,然后经PPP 途径或者PK 途径进入中心代谢,并与转运葡萄糖的磷酸转移酶系统(phosphotransferase system,PTS)和代谢途径有紧密联系(图5)。
基于这些认识,Gu 等[133]过表达了大肠杆菌来源的PPP 途径转醛醇酶基因talA,提升了木糖利用速率,但木糖利用仍受葡萄糖抑制。进一步,Jin 等[134]过表达了内源的PPP 途径的转醛醇酶基因(tal)、转酮醇酶基因(tkl)、核糖-5-磷酸异构酶基因(rpe)、核酮糖-5-磷酸3-差向异构酶基因(rpi),发现重组菌木糖利用明显增快,溶剂产量提升42%。此外,木糖转运工程研究也取得了不少进展。Xiao 等[139]鉴定了拜氏梭菌中的D-木糖特异性的转运蛋白编码基因(xylT),然后过表达它以增强拜氏梭菌的木糖摄取。同时,Sun 等[144]证明了六蛋白模块XylFII-LytS/YesN-XylFGH 与拜氏梭菌中的木糖利用有关。他们进一步证实,这是一种新的“三组分”木糖响应和调节系统,其分子机理也在随后得到了深入分析[145]。在另一项研究中,Xiao 等[135]证实葡萄糖转运的弱化也能带来戊糖利用的改进。他们利用TargeTron 中断了PTS 系统组成基因(glcG,编码PTS 系统的酶II,与木糖代谢阻遏高度相关),然后过表达内源
木糖转运蛋白基因(xylT)以及木糖异构酶基因(xylA)和木酮糖激酶基因(xylB)。获得的重组菌基本上消除了碳代谢抑制效应(carbon catabolite repression,CCR),溶剂产量增加24%。
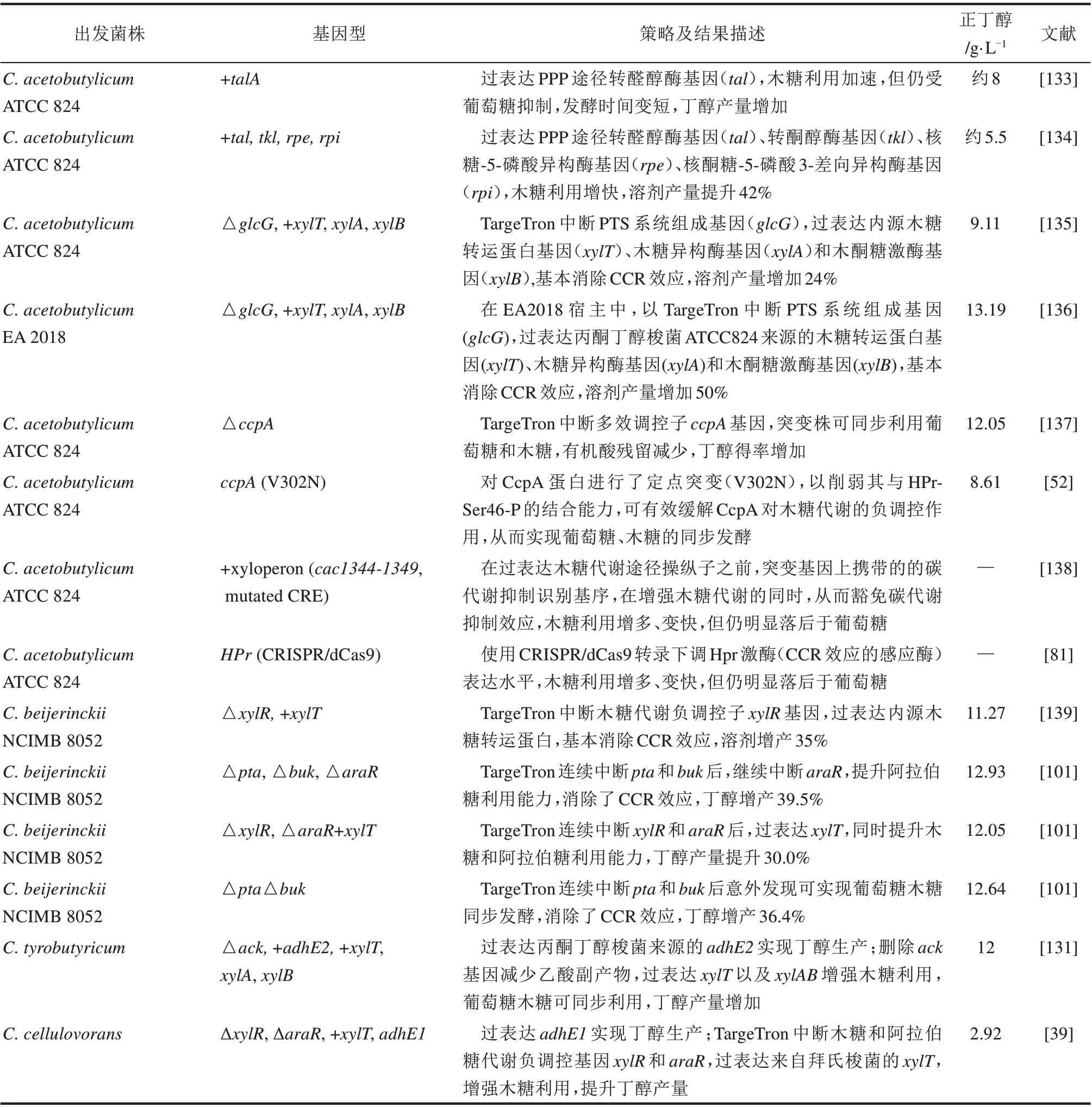
表6 产正丁醇梭菌的戊糖代谢工程总结Tab.6 Summary of pentose metabolism pathway engineering in n-butanol-producing Clostridium
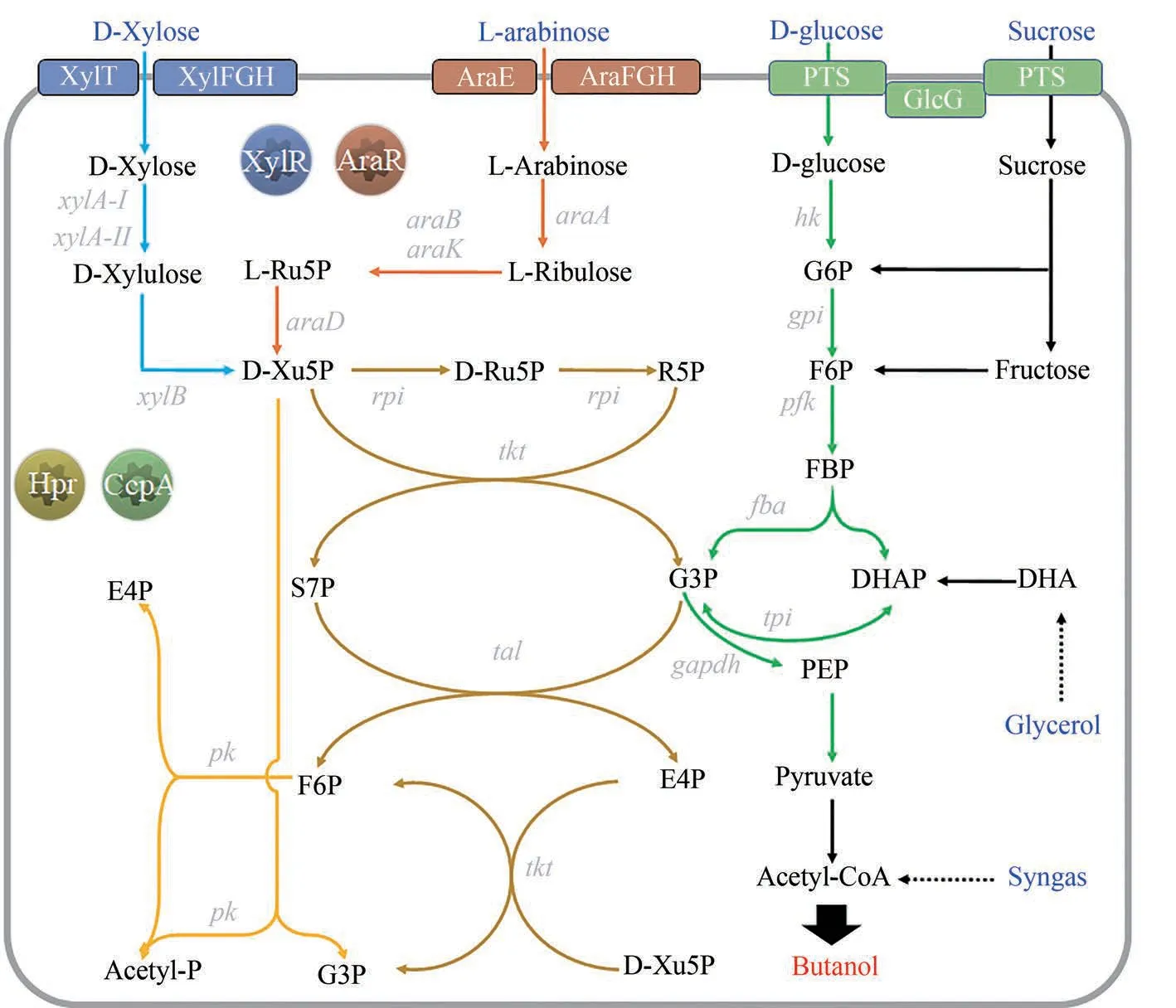
图5 产正丁醇梭菌的戊糖代谢途径及其调控蛋白(XylT/XylFGH—木糖特异性转运蛋白;AraE/AraFGH—阿拉伯糖特异性转运蛋白;PTS—己糖的磷酸转移酶系统;GlcG—PTS的组成酶II,与碳源代谢抑制效应密切相关;G6P—葡萄糖-6-磷酸;F6P—果糖-6-磷酸;FBP—果糖-1,6-二磷酸;E4P—赤藓糖-4-磷酸;S7P—景天庚酮糖-7-磷酸;Ru5P—核酮糖-5-磷酸;Xu5P—木酮糖-5-磷酸;G3P—3-磷酸甘油醛;DHA—二羟丙酮;DHAP—磷酸二羟丙酮;PEP—磷酸烯醇式丙酮酸图中所示基因表达的酶:xylA-I/II—木糖异构酶;xylB—木酮糖激酶;araA—阿拉伯糖异构酶;araB/K—核酮糖激酶;araD—核酮糖-5-磷酸异构酶;rpi—5-磷酸核糖异构酶;tal—转醛酶;tkt—转酮酶;pk—磷酸酮醇酶)Fig.5 Pentose metabolism pathway and involved regulatory proteins in n-butanol-producing clostridia[XylT/XylFGH—xylose-specific transporter;AraE/AraFGH—arabinose-specific transporter; PTS—phosphotransferase system; GlcG—enzyme II of PTS, closely related to the CCR; G6P—glucose-6-phosphate; F6P—fructose-6-phosphate; FBP—fructose-1,6-Diphosphate; E4P—erythrose-4-phosphate; S7P—sedum heptulose-7-phosphate; Ru5P—ribulose-5-phosphate; Xu5P—xylulose-5-phosphate; G3P—3-Glyceraldehyde phosphate;DHA—dihydroxyacetone; DHAP—dihydroxyacetone phosphate; PEP—phosphoenolpyruvate; xylA-I/II—xylose isomerase; xylB—xylulose kinase;araA—arabinose isomerase; araB/K—ribulose kinase; araD—ribulose-5-phosphate isomerase; rpi—5-phosphoribose isomerase; tal—transaldolase;tkt—transketolase;pk—phosphoketolase(Genes appeared in Fig.2~4 are not listed here)]
在梭菌戊糖代谢的调控机理解析方面,研究人员已经认识到,在梭菌中,碳源代谢抑制效应主要由分解代谢控制蛋白A(CcpA)介导。它可以与组氨酸磷酸化蛋白HPr(heat-stable,histidine,phosphoryl protein)形成复合物[146]。该复合物可以与靶标基因的启动子区域,或共转录单元编码序列中的分解代谢物响应基序(catabolite responsive element,CRE)结合以抑制转录[147],使CcpA 可以在一定程度上抑制木糖代谢[137]。
基于构效关系的深入理解,Wu 等[52]对CcpA蛋白进行了定点突变(V302N),以削弱其与HPr-Ser46-P 的结合能力,可有效缓解CcpA 对木糖代谢的负调控作用,从而实现葡萄糖、木糖的同步发酵。由于CcpA 是多效调控因子,Perry Chou 课题组将目光投向其互作蛋白及靶标调控基因。他们在过表达木糖代谢途径操纵子之前,突变了基因上携带的CRE 序列,使CcpA 不能与之正常结合,从而在增强木糖代谢的同时,一定程度上豁免碳代谢抑制效应。所获得的突变株的木糖利用增多、变快,但仍明显落后于葡萄糖[138]。在随后的研究中,他们利用CRISPR/dCas9 抑制了hprK 基因(编码HPr 磷酸化酶/激酶,HPrK)的转录,以减少CcpA 与Hpr 的结合,从而减少负调控效应,使重组菌在一定程度上能同时利用木糖和葡萄糖[81]。
梭菌中的木糖代谢也受其他一些机制的调节。Hu 等[148]和Xiao 等[139]分别在丙酮丁醇梭菌EA 2018和拜氏梭菌NCIMB 8052中鉴定出了与木糖代谢有关的CEA_G2622 和Cbei_2385(xylR)等转录调节子。xylR中断失活已被证明可以显著上调木糖异构酶基因(xylA-II,CA_C2610)和木糖激酶基因(xylB,CA_C2612)的转录,从而促进木糖代谢利用[139]。最近,Liu 等研究了拜氏梭菌中阿拉伯糖代谢调控子编码基因araR 的功能,证实araR的中断可有效提升阿拉伯糖的代谢效率[101]。
总的来说,梭菌中的戊糖代谢途径和调控机制已经比较清晰,为戊糖利用效率提升打下了良好基础。然而需要注意的是,上述研究多在产溶剂梭菌中进行,相关认知需要在其他梭菌中进一步验证。Yu 等[131]和Wen 等[39]分别在酪丁酸梭菌和嗜纤维梭菌验证了过表达xylT、xylA、xylB 的作用,以及敲除xylR、araR 并过表达xylT 的作用,暗示前述梭菌的戊糖代谢途径相似性和改造策略通用性较高,在严谨验证的前提下有较好的推广价值。
5 总结与展望
生物丁醇作为重要大宗化学品和极具前景的可再生能源,在减少碳排放和保障国家能源安全方面有重要作用。当前生物丁醇遭遇的最大困难在于生产成本高昂,难以和化石来源的丁醇竞争。目前有很多研究致力于提升生物丁醇的经济性,包括使用廉价原料、提升菌株性能、优化发酵工艺、引入气提等节能分离提取方法等等,其中产丁醇菌株的代谢工程改造仍是研究重点。
近年来,合成生物学的飞速发展为梭菌的遗传改造提供了丰富的工具和资源。目前梭菌在丁醇产量和比例提升、丁醇合成途径重构、戊糖代谢途径改造等领域已经取得很大进展,但仍面临一些问题,尤其是菌株对高浓度的丁醇及木质纤维素水解液中的抑制物耐受能力不足[149-150]。众所周知,菌株的抗逆性能往往和细胞生理特性、全局性调控网络等密切相关,涉及到DNA 修复、蛋白质合成与泛素化、酶的活性调节、细胞膜组成变化等多个层面[151-152],这其中的基因靶点也未完全揭示,这意味着现有的代谢工程手段和策略可能无法很好地胜任抗逆性能提升的工作。而一些传统的、非理性的适应性驯化,或者物理化学诱变方法反而能更快帮助菌株获得优异的抗逆表型[149]。当然,在利用系统生物学、合成生物学以及遗传验证获得关键靶点后,反向代谢工程在构建背景清晰的高性能菌株方面仍大有用武之地。
产丁醇菌株开发的另外一个瓶颈是,目前几乎没有菌株可以直接利用木质纤维素高效生产丁醇[3],因为这涉及到纤维素酶生产、木质纤维素降解、己糖戊糖共发酵、丁醇高效合成等多个环节,对单个菌株的要求极高。在纤维素降解菌中引入丁醇代谢途径(表6),或者在高产丁醇梭菌中过表达纤维素酶均未能达到预期目的[153]。Wen等[43-44,154]利用合成生物学的理念,设计和构建由纤维素降解菌和丁醇生产菌构成的共生菌群,再辅以代谢工程改造协调两菌分工合作,可直接发酵木质纤维素,获得的丁醇发酵水平与玉米糖培养基发酵水平接近,显示了合成生物学“师法自然”、超越自然的独特魅力。
可以预期,随着合成生物学的进一步发展,未来的梭菌丁醇代谢工程将更多地与遗传操作工具开发、基因组规模代谢网络模型预测、多组学分析、适应性驯化/高通量筛选、功能菌群设计和调试等合成生物学技术及思想紧密结合,为下一代产丁醇梭菌开发做出更大贡献。

