齐墩果酸对hiPSCs衍生心肌细胞成熟的促进作用及机制
谢敏,周琴,2,颜亮,叶亮,张心愿,许皓,易勤,谭彬,田杰,朱静*
1重庆医科大学附属儿童医院儿科研究所/儿童发育疾病研究教育部重点实验室/国家儿童健康与疾病临床医学研究中心(重庆)/儿童发育重大疾病国家国际科技合作基地/儿科学重庆市重点实验室,重庆 400014;2电子科技大学医学院附属妇女儿童中心医院/成都市妇女儿童中心医院检验科,成都 611731;3重庆医科大学附属儿童医院检验科/儿童发育疾病研究教育部重点实验室/国家儿童健康与疾病临床医学研究中心(重庆)/儿童发育重大疾病国家国际科技合作基地/儿科学重庆市重点实验室,重庆 400014
世界卫生组织的最新数据表明,心血管疾病(CVD)引起的死亡人数占全球1/3以上[1]。尽管采取了相应的治疗措施,但心肌不能自我更新,因此受损的心肌无法修复及再生。干细胞疗法的出现为心脏修复及再生提供了一种新的视角。从成体干细胞到胚胎干细胞(ESC),适合的干细胞来源一直备受关注。诱导多能干细胞(induced pluripotent stem cells,iPSCs)是2006年Takahashi等[2]通过对体细胞重编程导入4种转录因子(Oct3/4、Sox2、c-Myc及Klf4)产生的可自我更新且具有多向分化潜能的干细胞。利用患者PSCs衍生的心肌细胞进行移植不仅有望补充受损心肌,且不会发生免疫排斥。人诱导多能干细胞(hiPSCs)主要通过调节Wnt信号通路,并经过乳酸无糖培养基纯化而分化为心肌细胞[3]。但是,目前hiPSCs衍生的心肌细胞(hiPSC-CMs)在结构及功能上类似于胎儿心肌细胞[4],移植至成年心脏后可能导致心律不齐,影响疗效。因此,增强hiPSC-CMs的成熟度有利于提高其临床应用效果。在心肌细胞成熟过程中,选择性剪接(AS)扮演了重要角色,胚胎和成年心肌细胞通过不同剪接表达不同的同工型蛋白[5]。丙酮酸激酶(PK)是糖酵解过程中最后一个限速酶,在心肌成熟过程中AS开关打开,PK由2型(PKM2)逐渐转变为1型(PKM1)[6]。有研究表明,过表达PKM1可增加线粒体活性[7],而高PKM2/PKM1比值可抑制氧化磷酸化[8],因此促进PK同工型转换可能促进心肌细胞的成熟。齐墩果酸(OA)是天然的五环三萜类化合物,具有保肝[9]、抗炎[10]、神经保护[11]、抗糖尿病[12]、心脏保护[13]等多种药理作用。有研究发现,OA可促进PKM2向PKM1的同工型转换[14],也可影响细胞凋亡、细胞周期停滞[15]及细胞分化[16]等过程。本研究通过在hiPSC-CMs成熟过程中加入OA并进行分析,探讨了OA在hiPSC-CMs成熟过程中的作用。
1 材料与方法
1.1 细胞及试剂 hiPSC细胞系、PSCeasy人多潜能干细胞消化液、PGM1人多潜能干细胞培养基均购自北京赛贝生物技术有限公司;基质胶购自美国康宁公司;RPMI 1640培养基、乳酸钠、OA购自美国Sigma公司;CHIR99021和IWP2购自美国Selleck公司;无糖RPMI 1640、Tryple Express干细胞消化液、含胰岛素及不含胰岛素的B27购自美国Thermo Fisher Scientific公司;BCA蛋白浓度测定试剂盒、EDU-488细胞增殖检测试剂盒购自中国碧云天生物技术有限公司;蛋白酶抑制剂、磷酸酶抑制剂、裂解缓冲液、细胞周期检测试剂盒购自中国凯基公司;线粒体红色荧光探针(Mito-Tracker Red CMXRos)购自中国翌圣生物科技公司;心肌肌钙蛋白T(cTnT)一抗、缝隙连接蛋白43(Cx43)一抗、兔二抗购自英国Abcam公司;Nanog、Sox2、α-辅肌动蛋白(α-actinin)一抗购自美国Proteintech公司;PKM1、PKM2一抗购自美国CST公司;MFN2一抗购自美国Santa Cruz公司;β-actin一抗、鼠二抗购自中国中杉金桥公司;配胶试剂盒购自中国雅酶公司;引物TNNI3、MYH6、MYH7购自中国擎科生物技术有限公司。
1.2 实验方法
1.2.1 hiPSCs的培养、诱导分化及分组 hiPSCs培养于基质胶包被的孔板,用PGM1培养基维持细胞未分化状态,待细胞长至80%~90%时用PSCeasy消化液消化传代。在12孔板上进行细胞诱导,当细胞长至100%时,以RPMI 1640培养基+不含胰岛素B27为基础培养基,在诱导第0天添加CHIR99021(6 μmol/L)培养48 h,第3天添加IWP2(5 μmol/L)培养48 h,第7天换RPMI 1640培养基+含胰岛素B27,第14天换无糖RPMI 1640培养基+含胰岛素B27+乳酸钠(4 mmol/L)培养72 h后,在第17天重新接种于12孔板上。诱导的细胞在第7天左右开始跳动。hiPSC-CMs重接种后培养48 h,然后将第19天的细胞分为空白对照组(添加B27的RPMI 1640培养基)、DMSO组(添加DMSO 2 μl/ml)、OA加药组(添加5 mmol/L的OA 2 μl/ml),所有培养基每2 d更换1次,持续处理7 d,每个处理组至少重复3次。诱导分化方案见图1。
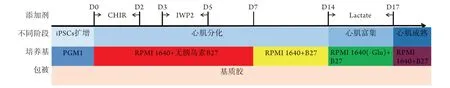
图1 hiPSC-CMs分化过程Fig.1 Differentiation process of the generation of hiPSC-CMs
1.2.2 Western blotting检测各组hiPSC-CMs蛋白表达情况 分别提取各组蛋白,以30 μg上样量进行SDS-PAGE凝胶电泳分离蛋白,然后将蛋白电转到PVDF膜上封闭,加入PKM1、PKM2、MFN2、β-actin一抗、兔二抗或鼠二抗孵育,最后显影得到目的蛋白条带,并采用Image Lab软件进行分析。
1.2.3 RT-qPCR检测hiPSCs及hiPSC-CMs mRNA表达情况 采用Trizol法提取hiPSCs及hiPSC-CMs细胞RNA,反转录得到cDNA。以GAPDH为内参照,在cDNA的基础上进行扩增,检测MYH6、MYH7、TNNI3的表达。RT-qPCR反应条件为:95 ℃ 3 min预变性;95 ℃ 5 s变性、60 ℃ 30 s退火延伸,共39个循环;65 ℃ 5 s,95 ℃ 5 s获得熔解曲线。数据分析采用2–ΔΔCt法,结果取3次平均值。引物序列见表1。
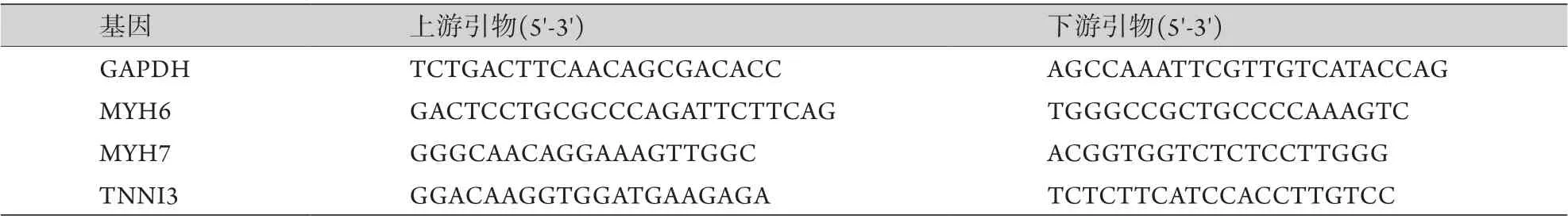
表1 RT-qPCR引物序列Tab.1 Primer sequences for RT-qPCR assay
1.2.4 hiPSCs及hiPSC-CMs的免疫荧光染色 未分化的hiPSCs及处理的各组hiPSC-CMs接种于包被后的爬片上或共聚焦皿中进行后续染色:d-PBS摇床洗1 min×1次,4%多聚甲醛固定20 min;d-PBS洗5 min×3次,0.5% Triton通透10 min;d-PBS洗5 min×3次,5% BSA封闭30 min;加入稀释的一抗(Nanog、Sox2、cTnT、Cx43、α-actinin)4 ℃过夜;37 ℃复温30 min,d-PBS洗5 min×3次,加稀释的荧光二抗,37 ℃孵育60 min;d-PBS洗5 min×3次,加稀释的DAPI,37 ℃避光孵育60 min;d-PBS洗5 min×3次,加荧光抗猝灭剂封片。采用荧光显微镜或激光共聚焦显微镜观察。采用α-actinin进行免疫荧光染色的图片在共聚焦显微镜下进行肌节和细胞整体拍摄,采用尼康NIS-Elements系统,每个样本选取3~5张图片,统计每张图片的细胞面积、圆度指数,同时每张图片随机选取40~50个肌小节统计肌节长度。结果取平均值。
1.2.5 电镜观察hiPSC-CMs的线粒体结构 处理后各组细胞800 r/min离心5 min,将细胞吹散后转移到EP管中;1200 r/min离心10 min,吸弃上清,加入戊二醛固定,进行后续电镜观察。
1.2.6 线粒体Mito-Tracker染色 处理的各组hiPSCCMs接种于共聚焦皿中进行染色,细胞经d-PBS摇床洗1 min×1次,加入37 ℃预热的染色工作液及稀释的DPAI染液中共孵育30 min,d-PBS摇床洗3 min×3次,加入新鲜培养基于激光共聚焦显微镜下观察。1.2.7 hiPSC-CMs细胞周期检测 处理的各组hiPSC-CMs经PBS振荡混匀洗涤1次,加胰酶消化后1000 r/min离心5 min,弃上清后加冷PBS涡旋,1000 r/min离心5 min后,加入250 μl冷PBS涡旋,再加入750 μl无水乙醇4 ℃固定过夜。1000 r/min离心3 min,弃上清,加入PBS将细胞震荡混匀洗涤后1000 r/min离心3 min×2次,加入100 μl A液37 ℃水化30 min,最后加入400 μl B液避光孵育30~60 min,然后采用流式细胞仪检测hiPSC-CMs细胞周期。
1.2.8 EDU检测hiPSC-CMs细胞增殖情况 处理的各组hiPSC-CMs接种于包被后的爬片上,加入EDU工作液37 ℃孵育2 h;然后加入4%多聚甲醛固定15 min,洗涤液洗5 min×3次;加入0.3% Triton孵育15 min,洗涤液洗5 min×3次;加入Click反应液混匀,避光孵育30 min,洗涤液洗5 min×3次;加入Hoechst染液避光孵育10 min,洗涤液洗5 min×3次,最后加荧光抗猝灭剂封片,于荧光显微镜下观察。采用ImageJ手工计数增殖细胞(绿色细胞核)占总细胞数目(蓝色DAPI核总数)的比例。
1.3 统计学处理 采用GraphPad Prism 8软件进行统计分析。计量资料以±s表示,hiPSC-CMs与hiPSCs RT-qPCR结果(TNNI3、MYH6、MYH7)比较采用t检验;三组间Western blotting检测结果、细胞面积、圆度指数、肌节长度、细胞增殖结果比较采用单因素方差分析,进一步多重比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 hiPSCs的鉴定 光镜下hiPSCs集落细胞排列致密,边缘整齐光滑,细胞正常增殖(图2A)。免疫荧光染色结果显示,干细胞多能性标志物Nanog、Sox2在hiPSCs中呈阳性表达(图2B)。
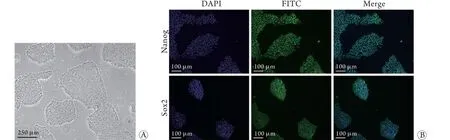
图2 hiPSCs集落观察和多能性鉴定Fig.2 Observation and pluripotency identification of hiPSCs
2.2 hiPSC-CMs的鉴定 光镜下可见重新接种前hiPSC-CMs成片跳动,重新接种后约24 h部分细胞恢复跳动。诱导后的hiPSC-CMs细胞呈团聚集,有黏液感(图3A)。RT-qPCR结果显示,与hiPSCs比较,hiPSC-CMs心肌相关基因TNNI3、M Y H 6、M Y H 7 的表达(分别为3.6 1±0.2 1、10 442.64±506.69、352 961.7±37 918.04)明显上调,差异有统计学意义(P<0.05或P<0.01,图3B)。免疫荧光染色结果显示,hiPSC-CMs表达心肌相关标志物cTnT、Cx43、α-actinin(图3C)。
2.3 OA对线粒体的影响 Mito-Tracker染色结果显示,与空白对照组、DMSO组比较,OA加药组线粒体连接成网络状(图4A)。电镜观察结果显示,与空白对照组、DMSO组比较,OA加药组线粒体嵴更丰富且有融合趋势,线粒体体积增大(图4B)。Western blotting检测结果显示,与空白对照组、DMSO组比较,OA加药组PKM1/PKM2比值(分别为1.00±0.00、0.97±0.08、1.36±0.13)及MFN2的表达(分别为1.00±0.00、1.21±0.25、2.02±0.004)明显升高,差异有统计学意义(P<0.05,图4C)。
2.4 OA对细胞结构的影响 免疫荧光染色结果显示,经α-actinin染色,各组均可见细胞轮廓及肌节,与空白对照组、DMSO组比较,OA加药组细胞面积[分别为(3053.62±570.19) μm3、(4276.04±234.05) μm3、(5679.70±733.26) μm3]、肌节长度[分别为(1.62±0.06) μm、(1.58±0.09) μm、(1.93±0.10) μm]明显增加,圆度指数(分别为0.84±0.06、0.88±0.08、0.76±0.08)明显降低,差异均有统计学意义(P<0.05,图5)。
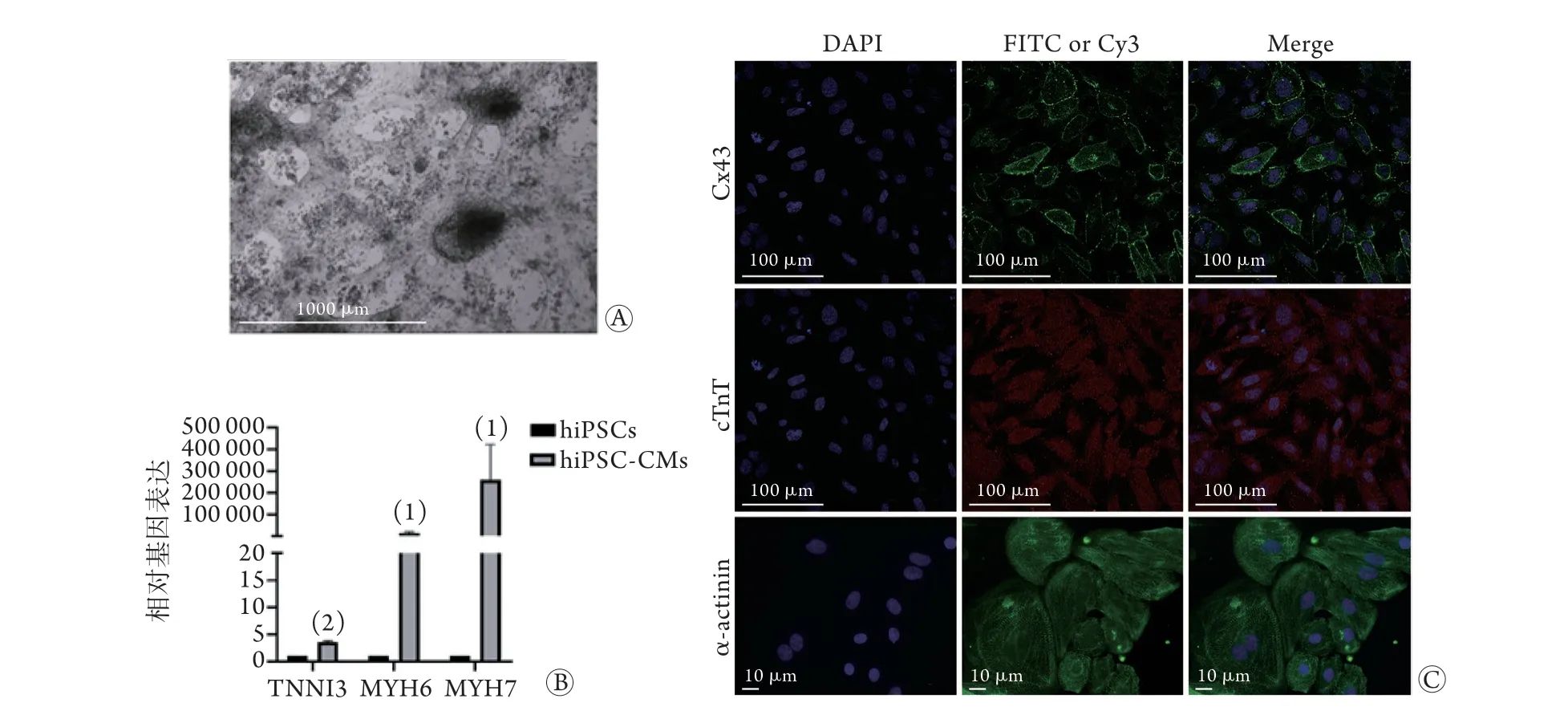
图3 hiPSC-CMs形态观察及鉴定Fig.3 Observation and identification of hiPSC-CMs
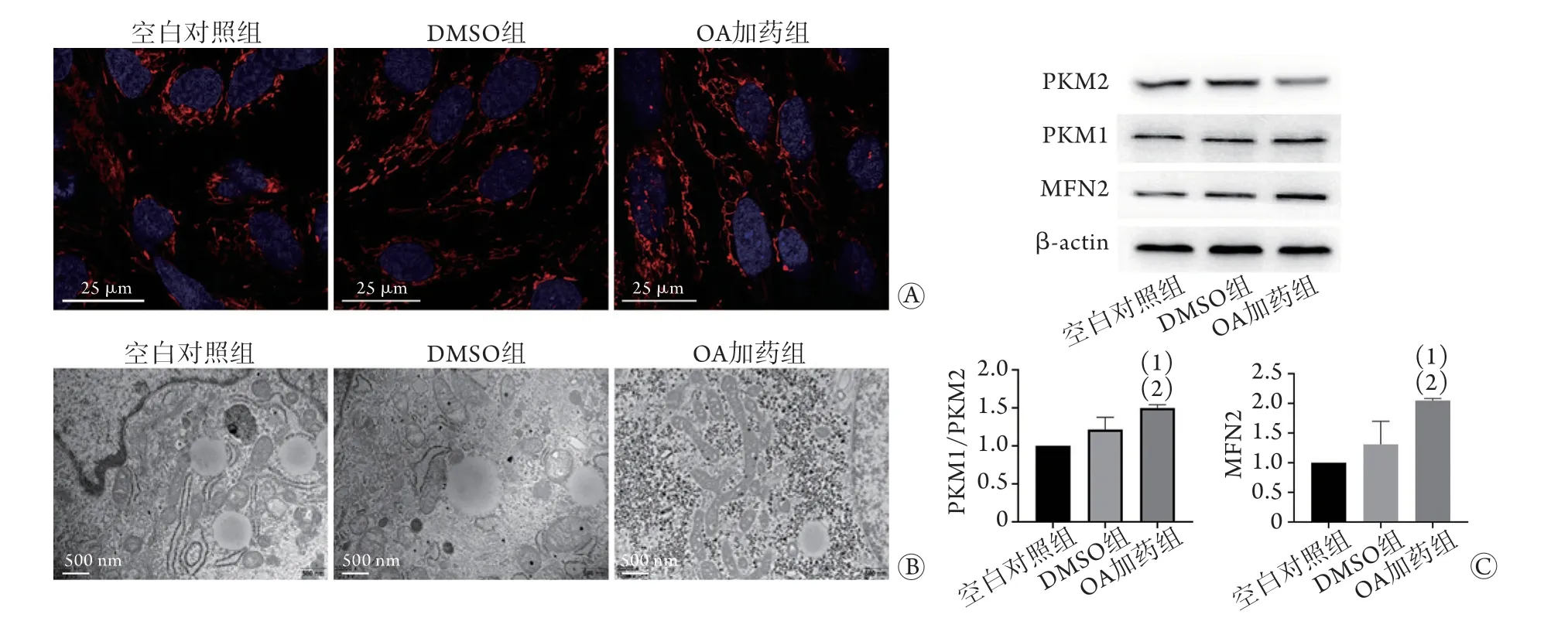
图4 hiPSC-CMs PK和线粒体相关检测Fig.4 Detection of PK and mitochondria in hiPSC-CMs
2.5 OA对细胞周期的影响 EDU检测结果显示,与空白对照组、DMSO组比较,OA加药组增殖细胞率明显降低(P<0.001,图6A、B)。流式细胞仪检测结果显示,OA加药组≥4N的细胞数较空白对照组及DMSO组明显增多(图6C、D)。
3 讨 论
心血管疾病造成的心肌细胞损伤无法修复及再生,而心肌代偿性肥大及炎性细胞浸润形成不良重塑,后期可导致心力衰竭。干细胞疗法可提供整合到宿主心脏的细胞,从而减轻不良重塑。hiPSCs作为治疗心血管疾病的替代细胞来源,在心脏再生中的潜力巨大,而探寻促进hiPSC-CMs成熟的方法对其临床应用意义重大。
本研究加入OA后观察到了与文献[14]一致的PK同工型转换。AS在胚胎发育后期及出生早期心脏中普遍存在,是驱动小鼠心脏发育过程的决定性变化[5]。PKM1及PKM2是由同一基因产生的,分别包含第9、10外显子[17],单外显子的差异赋予这两个同工型不同的结构和功能。PKM2主要在胚胎和增殖细胞中表达,而PKM1主要在终末分化的组织中表达[8]。高比例的PKM2/PKM1可抑制氧化磷酸化,促进糖酵解[18]。在神经细胞中,己糖激酶及乳酸脱氢酶受到抑制,PKM2可向PKM1转变,从而代谢,使细胞从有氧糖酵解转变为氧化磷酸化[8]。
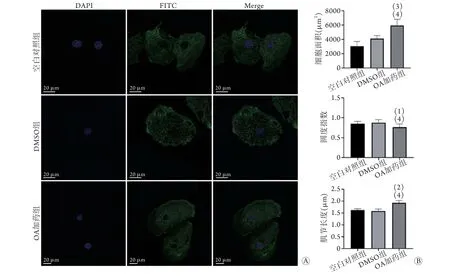
图5 各组hiPSC-CMs α-actinin免疫荧光染色及细胞面积、圆度指数、肌节长度比较Fig.5 Immunofluorescence staining of α-actinin in hiPSC-CMs and cell area, sarcomere length and cell circularity index
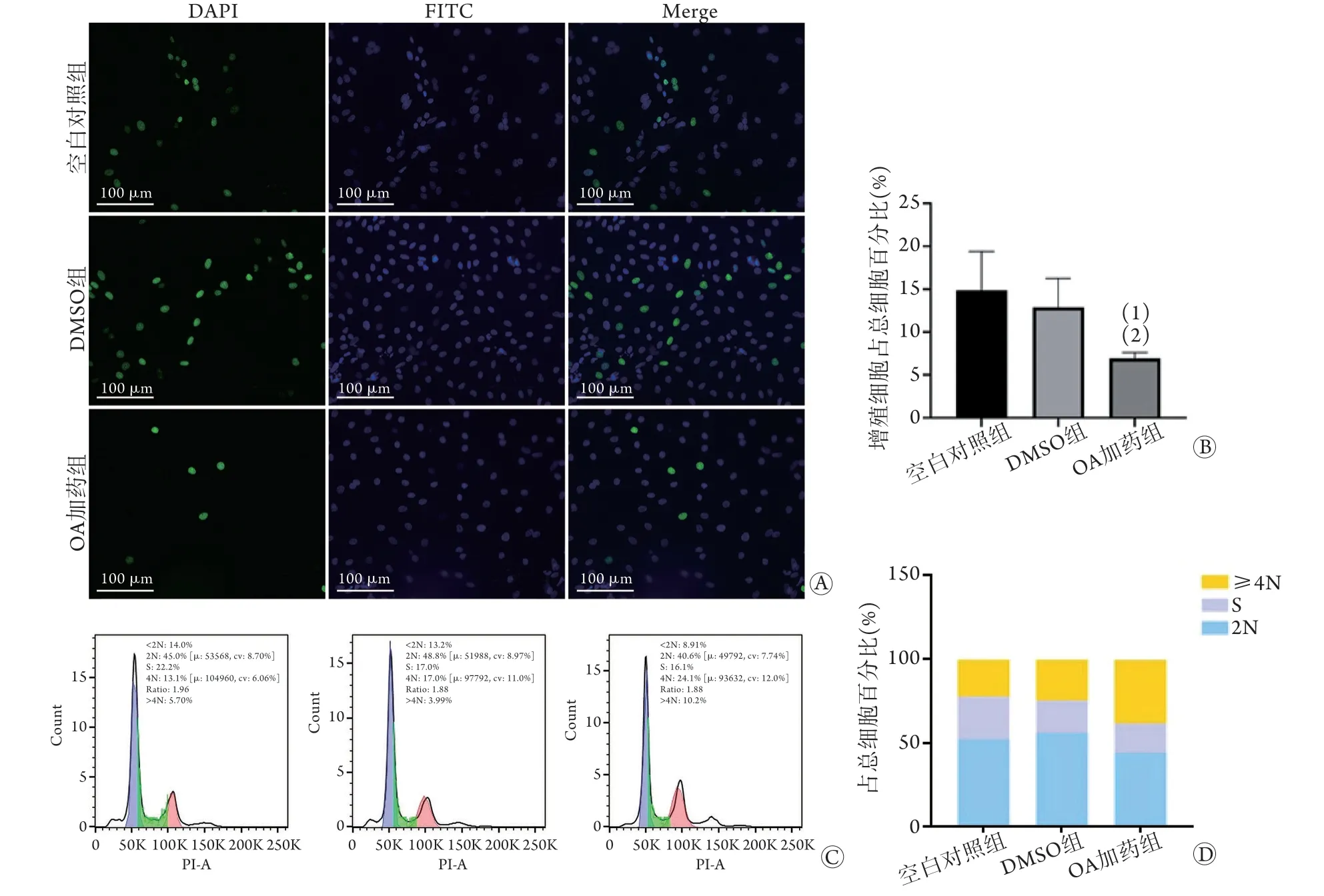
图6 hiPSC-CMs的增殖情况及细胞周期检测Fig.6 Cell proliferation and cell cycle of hiPSC-CMs
心脏是人体中代谢最活跃的器官之一,但心肌细胞内并无高浓度的ATP,而是通过线粒体快速合成ATP。在成人心肌细胞中,线粒体占细胞体积的20%以上,持续不断地进行氧化磷酸化以满足高能量需求[19]。在发育过程中,心肌细胞的分化和成熟伴随着代谢方式的转变,线粒体的状态影响着整个过程。线粒体的融合与分裂是一个连续交替的过程,线粒体结构不断改变以适应细胞发育及周围环境的变化。线粒体融合,即小而呈点状的线粒体融合在一起,重新形成细长且相互连接的线粒体[20]。在hiPSCs分化过程中,线粒体由点状变为线状,而在成熟的心肌中形成更为规则有序的网状结构,小线粒体融合形成较大的线粒体,融合的线粒体网络有助于为心肌细胞提供更多的能量。本研究发现,加入OA后线粒体融合增加。有研究发现,PKM2可与MFN2结合而促进线粒体融合[21],而本研究中虽然PKM1/PKM2的比值有所升高,但其蛋白表达绝对值并未降低。在加入OA促进细胞成熟的过程中,未完全沉默PKM2可能是这一阶段促进线粒体融合的原因。
在心脏的发育过程中,心肌细胞会经历一系列复杂的结构变化,最终形成成年表型。大多数哺乳动物出生后不久心肌细胞即失去增殖能力[22],不再依靠细胞数目增长实现生长,而肥大性生长则占据主导地位,人类心肌细胞可增大10~20倍[23],在此过程中往往伴随着心肌细胞从单核到双核的转变[24],最终实现心肌细胞的终末分化。细胞体积增大的同时细胞形态也发生变化,从圆形变为棒状,细胞类圆度减小。此类细胞形态的改变与心肌细胞的功能改变息息相关,增大的细胞表面积与膜电容的增加呈正比,同时影响着脉冲传播及收缩力[25],而棒状结构则可促进兴奋-收缩耦联[26]。除了细胞形态,支撑细胞的细胞骨架也在成熟过程中发生了改变。在心肌细胞成熟过程中,肌球蛋白、肌钙蛋白发生了胎儿同工型到成年同工型的转变[27],肌节变得更为整齐有条理,肌小节长度增加,最终促进收缩力的产生。本研究发现,与空白对照组比较,经过OA处理的hiPSC-CMs形态结构发生了与正常心肌成熟过程一致的变化,表明OA可从形态结构方面促进hiPSC-CMs的成熟。
除了结构方面,心肌细胞的成熟还包括代谢方面的改变。在心脏发育早期,主要由糖酵解提供细胞所需能源,随着心肌细胞的成熟及终末分化,代谢方式逐渐从糖酵解转变为氧化磷酸化。代谢过程由糖酵解向氧化磷酸化的转变与线粒体结构的变化同时发生,为心肌细胞搏动提供充足的能量[19]。本研究发现,加入OA后线粒体结构发生了改变,而线粒体结构的改变往往伴随着代谢改变,从而实现代谢层面上的心肌细胞成熟,但其机制仍有待进一步研究。
近年来,对植物生物活性成分的研究不断增多,且从植物中提取的有效成分在抗肿瘤[28]、保肝[29]、抗心血管疾病[30]等方面的作用已得到证实,其中三萜类化合物已用于治疗各种疾病[31]。五环三萜类化合物OA存在于多种植物中,最初作为保肝药物应用,但是随着研究的深入,发现它在多种疾病的治疗中具有一定作用。OA在多种细胞生命历程中发挥了重要作用[15-16],本研究也发现,加入OA可促进hiPSC-CMs的成熟。总之,采用OA促进hiPSCCMs的成熟可为hiPSC-CMs的研究提供一种新的思路,为促进hiPSC-CMs未来的临床应用提供了理论依据。

