利用流式细胞术鉴定软枣猕猴桃倍性的方法
刘振盼
(辽宁省经济林研究所,辽宁 大连 116031)
软枣猕猴桃Actinidiaarguta为猕猴桃科猕猴桃属多年生木质藤本植物[1],其果实具有开胃健脾、抗氧化、抗炎、抗肿瘤等多种药理功效[2],被誉为“水果之王”[3]。该属植物种类较多且倍性变异复杂,存在二倍体、四倍体、六倍体、八倍体以及非整倍体等倍性不同的系列,染色体小且倍性变异丰富[4]。在育种实践中,不当的倍性亲本选配可能会造成杂交失败、后代不育等后果。因此,进行倍性鉴定不仅是开展猕猴桃常规育种亲本选择前提条件之一,也对其倍性育种等现代育种技术的开展具有重要意义。目前,多倍体鉴定常用的方法有两种:一种是染色体计数法,另一种是流式细胞术(flow cytometry,FCM)。与计数法相比,流式细胞技术虽然起步较晚,但因其高效快速、制样简单、试材用量少且数据重复性高等优势,成为目前最常用的植物基因组大小[5-8]或者植物倍性研究[9-10]的方法。本研究通过流式细胞仪对软枣猕猴桃进行倍性鉴定,以期建立一套高效的软枣猕猴桃倍性鉴定技术,为后续的倍性育种和常规杂交育种等工作提供保障。
1 材料与方法
1.1 材 料
供试材料均采自辽宁省经济林研究所松木岛科研基地软枣猕猴桃资源圃。2020年4月中旬在设施棚内用剪刀剪取新抽出未展开的叶片,放入冰盒带回实验室,用预冷的清水洗去叶片表面的灰尘,然后用吸水纸擦干净备用。供试植株树龄4 a,每个品种采集5个叶片。倍性分析参照品种为‘红阳’(2n=58),测试样品为‘魁绿’、‘桓优1号’、‘安娜’、‘紫色萨瓦多’及自选雄株。
1.2 试验方法
取新鲜待测样本0.5 cm2,置于培养皿中。取Sysmex Partec CyStain UV Precise P 裂解液400 μL 加于样本周围,用锋利刀片将其切碎,以充分提取出完整的细胞核,提取时间60 s。将培养皿中的液体用50 μm滤网过滤至样品管中。向样品管中加入Sysmex Partec CyStain UV Precise P 染液1 600 μL,染色60 s后上机测试。
待测样品的倍性值估算方法:待测样品的倍性值(ploidy value)=参照样品的倍性×(待测样品 G0/G1峰的荧光均值/参照样品 G0/G1峰的荧光均值)。
2 结果与分析
本研究利用流式细胞仪对6个猕猴桃品种的染色体倍性进行了鉴定,结果见图1。二倍体‘红阳’G1其峰值在横坐标的位置是197.86 (图1-A),以此为对照进行其他样品的染色体倍性分析,根据DNA含量相对比例情况,从表1结果显示:‘魁绿’其峰值横坐标位置是396.89,与对照品种的比值为2.01,判断其为四倍体(图1-B);同理,‘桓优1号’的峰值横坐标位置为392.16,与对照品种的比值为1.99,判断其为四倍体(图1-C);‘安娜’的峰值横坐标位置为394.65,与对照品种的比值为1.99,判断其为四倍体(图1-D);‘紫色萨瓦多’的峰值横坐标位置为395.57,与对照品种的比值为2.00,判断其为四倍体(图1-E);自选雄株的峰值横坐标位置为585.62,与对照品种的比值为2.96,判断其为六倍体(图1-F)。可见,通过本试验的方法,获得主峰清晰、杂峰少,可以快速判断材料的倍性。

表1 不同倍性猕猴桃属植物细胞核DNA相对含量
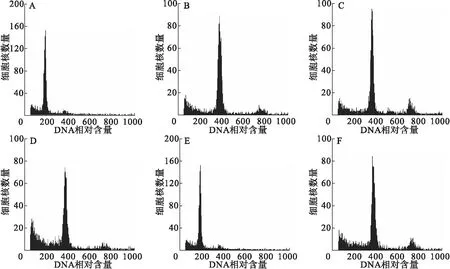
图1 流式细胞技术鉴定猕猴桃品种的相对DNA含量
注:A为‘红阳’;B为‘魁绿’;C为‘桓优1号’;D为‘安娜’;E为‘紫色萨瓦多’;F为自选雄株。单个荧光峰代表品种细胞核数量的相对荧光强度。
3 讨 论
自1997年开始,国内陆续开展了猕猴桃属植物倍性鉴定工作[11-16]。前人研究表明,在猕猴桃属内,软枣猕猴桃是倍性最为复杂的物种之一,存在2X、4X、6X、7X、8X等多种倍性水平,目前发现的物种以4X居多,6X较为少见[16]。由于软枣猕猴桃倍性复杂,染色体量基数较大,给采用传统的压片法进行其倍性鉴定带来了困难。因此,建立准确、高效的倍性鉴定技术十分必要。本方法通过采集软枣猕猴桃的组培苗幼嫩叶片进行倍性鉴定,建立了一套利用流式细胞仪进行软枣猕猴桃倍性鉴定方法,该方法主峰清晰、杂峰少,适用于软枣猕猴桃倍性的快速鉴定。
随着软枣猕猴桃产业的不断发展,种质创新越来越重要。虽然我国目前自主培育的软枣猕猴桃品种较少,但我国拥有丰富的猕猴桃属资源。这些资源不仅具有较强的商品特性(丰产、味美等),而且具有较强的抗寒性,今后可通过杂交育种手段将其与国外优良品种资源进行杂交,也可通过多倍体诱导或融合等现代生物技术实现亲本间的优势互补,开发出适宜不同生长环境的优良软枣猕猴桃新品种。采用流式细胞术鉴定软枣猕猴桃组培苗倍性,将为后续的倍性研究提供技术支撑。相对于传统压片法,流式细胞法具有样品用量少、准确性高等优点,是一种更为高效的鉴定染色体倍性的方法。

