血管细胞黏附分子-1对脑心肌炎病毒体外增殖的影响及其作用机制
李生军,张海霞,王兴陇,李倩,包晓婧,李向茸,冯若飞
1.西北民族大学 生物医学研究中心生物工程与技术国家民委重点实验室,甘肃兰州730030;
2.西北民族大学生命科学与工程学院,甘肃兰州730030
脑心肌炎是由脑心肌炎病毒(encephalomyocarditis virus,EMCV)引起的以脑炎、心肌炎、心肌周围炎为主要临床特征的急性传染病,可感染猪等哺乳类动物及灵长类动物[1-2]。1945年,首次分离获得EMCV,1958年EMCV感染确定为猪的致死性病因之一[3-4]。EMCV感染宿主的范围较广,其中仔猪致病率和致死率较高,其暴发流行对人类公共卫生及养殖产业均造成了较大影响[5]。EMCV为无包膜单股正义链RNA病毒,病毒粒子直径约30 nm,呈球形,蛋白质分子量约2 600 ku[6]。EMCV基因组包含4种结构蛋白(VP1、VP2、VP3、VP4)和7种非结构蛋白,结构蛋白均参与病毒抗原表位的形成,其中VP1是最重要的中和性抗原表位,还与病毒粒子表面的拓扑结构、抗原性、受体吸附及脱壳密切相关;VP2上存在的2个B细胞线性表位也有一定的免疫活性[7]。
血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)属于免疫球蛋白超家族,又称为CD106[8],广泛表达于内皮细胞、平滑肌细胞、骨髓基质细胞及成纤维细胞等细胞表面[9]。研究表明,VCAM-1不仅参与机体的免疫反应、炎症反应、肿瘤的发展及转移等多种病理生理过程,也参与多种病毒感染机制,如巨细胞病毒、肠道病毒71型[10-14]。HUBER[15]研究证实,VCAM-1参与EMCV的感染过程,但未见VCAM-1对EMCV增殖调控作用的相关报道。本研究通过探讨VCAM-1对EMCV体外增殖的影响及其作用机制,以期为EMCV感染相关疾病的治疗及其相关疫苗的研发奠定基础。
1 材料与方法
1.1 毒株、质粒、细胞及基因EMCV GS-01株、感受态E.coliBL21(DE3)、载体pcDNA3.1、表达质粒pcDNA3.1-VCAM-1、pET30a-VP1(含His标签)、pET30a-VP2(含His标签)、pET30a-VP3(含His标签)及pGEX-6P-1-VCAM-1(含GST标签)由西北民族大学生物工程与技术国家民委重点实验室保存;C2C12小鼠成肌细胞由甘肃省动物技术创新中心提供;siNC(5′-UUCUCCGAA-CGUGUCACGU-3′)和siVCAM-1(5′-GGATAATCCT-GAAGAAGAA-3′)均由广州瑞博生物科技有限公司设计及合成。
1.2 主要试剂 胎牛血清购自兰州民海生物工程有限公司;质粒小提试剂盒、RNAiso plus细胞/细菌总RNA提取试剂盒、高纯质粒小提试剂盒、TIANScript M-MLV及TaqDNA聚合酶均购自天根生化科技(北京)有限公司;SYBR Select Master Mix试剂盒购自美国ABI公司;LipofectamineTM2000 Reagent购自美国Invitrogen公司;ECL显色试剂盒购自美国Perkin-Elmer公司;兔抗VCAM-1单克隆抗体及鼠抗β-actin单克隆购自美国Abclonal公司;兔抗His单克隆抗体及鼠抗GST单克隆抗体购自美国Abcam公司;HRP标记的山羊抗兔及山羊抗鼠IgG购自美国Jackson公司;Easy Pure Quick Gel Extraction Kit购自北京全式金生物技术有限公司;Pierce GST protein Interaction Pull-down Kit购自美国Thermo公司。
1.3 引物设计及合成 根据GenBank中登录的鼠源VCAM-1基因序列(X67783.1),应用Primer Premier 5.0软件设计qPCR检测用引物(VCAM-1-qF/R)、内参引物(mGAPDH-qF/R)、EMCV检测用引物(EMCVLZD-F/R)及探针(EMCV Probe)[16],见表1。引物及探针均由生工生物工程(上海)股份有限公司合成。

表1 引物及探针序列Tab.1 Sequences of primers and probes
1.4 EMCV感染时间对C2C12细胞中VCAM-1表达水平影响的检测 将C2C12细胞按1×106个/孔接种于6孔板,用含10% NBS的DMEM培养基于37℃培养18~24 h;待细胞密度达90%时,将EMCV按MOI=0.001感染,同时设未感染组,于37℃感染24和48 h,收取细胞。采用RNAiso plus试剂盒提取细胞总RNA,逆转录为cDNA,以其为模板,进行qPCR扩增,扩增条件为:95℃预变性30 s,95℃变性5 s,60℃退火34 s,共40个循环。采用RIPA裂解细胞,经15% SDS-PAGE分离蛋白后,电转移至PVDF膜,加入兔抗VCAM-1单克隆抗体(1∶3 000稀释)及鼠抗β-actin单克隆抗体(1∶5 000稀释),于室温孵育2 h;TBST洗涤5次,加入HRP标记的山羊抗兔及山羊抗鼠IgG(1∶10 000稀释),室温孵育1 h;TBST洗涤5次,ECL法显色。
1.5 过表达VCAM-1对EMCV体外增殖影响的检测按1.4项方法培养C2C12细胞,待细胞密度约达80%时,在LipofectamineTM2000的介导下,将2μg pcDNA3.1和pcDNA3.1-VCAM-1分别转染C2C12细胞,于37℃,5% CO2培养箱中培养24 h,qPCR及Western blot法(同1.4项)检测VCAM-1过表达情况。再将EMCV按MOI=0.001感染,继续培养24 h,收集细胞及上清液,反复冻融3次,于4℃,943×g离心10 min,取上清液,参照文献[16]的qPCR法和TCID50法分别检测病毒拷贝数和病毒滴度。
1.6 抑制VCAM-1表达对EMCV体外增殖影响的检测 按1.5项方法将150 nmol/L siNC和siVCAM-1分别转染C2C12细胞,于37℃,5% CO2培养箱中培养24 h,qPCR及Western blot法(同1.4项)检测VCAM-1抑制表达情况。再按1.5项方法感染EMCV,并检测病毒拷贝数及病毒滴度。
1.7 VCAM-1与EMCV结构蛋白间相互作用的检测将表达质粒pET30a-VP1、pET30a-VP2、pET30a-VP3及pGEX-6P-1-VCAM-1转染至感受态E.coliBL21(DE3),用LB培养基于37℃中培养12 h;按1∶100的比例转接至新鲜LB培养基,继续培养至A600为0.6时,加入终浓度为0.5 mmol/L的IPTG,于28℃诱导24 h,收获表达产物。采用Pierce GST protein Interaction Pull-down Kit试剂盒将含有GST标签的VCAM-1融合蛋白固化在树脂上,用预冷的PBS洗涤10次,加入2 mL蛋白结合缓冲液,冰浴30 min;分别加入含有His标签的VP1、VP2和VP3融合蛋白,用预冷的蛋白结合缓冲液(50 mmol/L Tris-HCl,pH 7.4,100 mmol/L NaCl)洗涤10次,加入1 mL洗脱液(50 mmol/L Tris-HCl,pH 7.4,10 mmol/L NaCl,10 mmol/L还原性谷胱甘肽),室温振荡30 min,收集产物。经Western blot法检测VCAM-1与病毒结构蛋白VP1、VP2和VP3之间的相互作用,方法同1.4项,其中一抗为鼠抗GST单克隆抗体(1∶3 000稀释)及兔抗His单克隆抗体(1∶5 000稀释)。
1.8 统计学分析 应用GraphPad Prism 5.0软件进行统计学分析,所有数据均采用均数±标准差(x±s)表示,组间比较采用单因素ANOVAs或t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 EMCV感染时间对C2C12细胞中VCAM-1表达水平的影响 与未感染组比较,EMCV感染C2C12细胞24 h时,感染组VCAM-1基因mRNA转录水平及VCAM-1蛋白表达水平差异均无统计学意义(t=0.845,P>0.05);感染48 h时,感染组VCAM-1基因mRNA转录水平及VCAM-1蛋白表达水平均明显降低(t=10.61,P<0.001)。见图1及表2。表明C2C12细胞内VCAM-1蛋白的表达水平随着EMCV感染时间的延长明显降低。
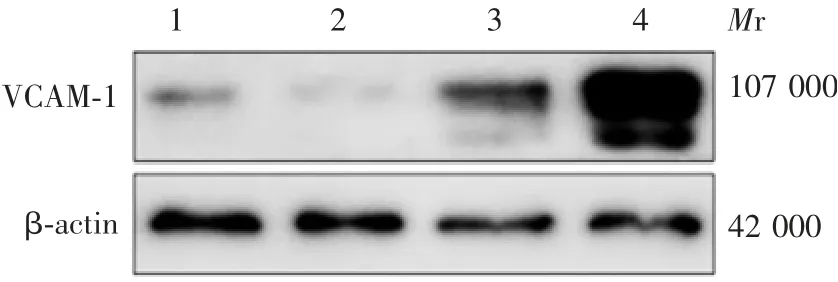
图1 Western blot法检测C2C12细胞感染EMCV后VCAM-1蛋白的表达情况Fig.1 Western blotting of expression of VCAM-1 in C2C12 cells infected with EMCV

表2 C2C12细胞感染EMCV后VCAM-1基因mRNA转录及VCAM-1蛋白表达水平Tab.2 The mRNA transcription and VCAM-1 protein expression levels of VCAM-1 gene in C2C12 cells after EMCV infection
2.2 过表达VCAM-1对EMCV体外增殖的影响pcDNA3.1-VCAM-1转染组及pcDNA3.1转染组C2C12细胞中VCAM-1基因mRNA转录水平分别为9.97和1.05,VCAM-1蛋白表达水平分别为1.84和0.90,见图2。pcDNA3.1-VCAM-1转染组C2C12细胞中VCAM-1基因mRNA转录水平及VCAM-1蛋白表达水平明显高于pcDNA3.1转染组(t=14.35,P<0.01)。感染EMCV后,pcDNA3.1-VCAM-1转染组及pcDNA3.1转染组C2C12细胞EMCV病毒拷贝数分别为3.45×108和3.02×109,病毒滴度分别为10-3.37和10-4.96TCID50/mL。与pcDNA3.1转染组比较,pcDNA3.1-VCAM-1转染组EMCV病毒拷贝数及病毒滴度均显著降低(t分别为13.59和12.55,P<0.001)。表明过表达VCAM-1可抑制EMCV增殖。
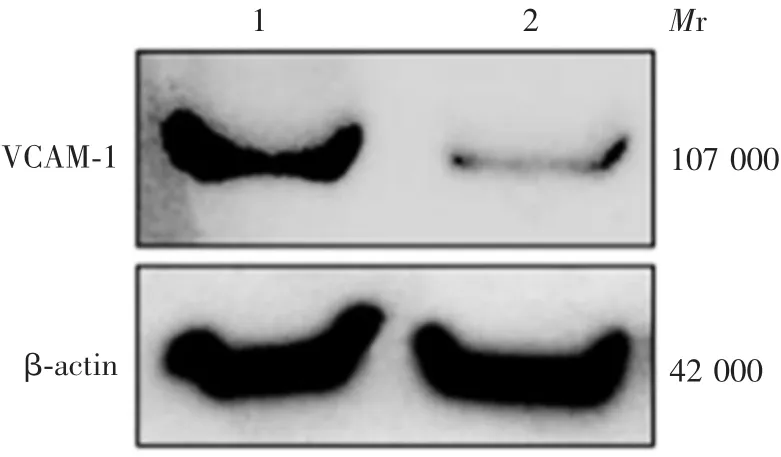
图2 Western blot法检测C2C12细胞中VCAM-1蛋白的过表达情况Fig.2 Western blotting of overexpression of VCAM-1 in C2C12 cells
2.3 抑制VCAM-1表达对EMCV体外增殖的影响siNC转染组和siVCAM-1转染组C2C12细胞中VCAM-1基因mRNA转录水平分别为1.10和0.18,VCAM-1蛋白表达水平分别为2.20和1.11,见图3。siVCAM-1转染组C2C12细胞中VCAM-1基因mRNA转录水平及VCAM-1蛋白表达水平明显低于siNC转染组(t=51.08,P<0.001)。感染EMCV后,siVCAM-1转染组及siNC转染组C2C12细胞EMCV病毒拷贝数分别为6.72×107和5.57×106,病毒滴度分别为10-5.3和10-3.8TCID50/mL。与siNC转染组比较,siVCAM-1转染组EMCV病毒拷贝数及病毒滴度均显著升高(t分别为13.23和12.99,P<0.001)。表明抑制表达VCAM-1可促进EMCV增殖。

图3 Western blot法检测C2C12细胞中VCAM-1蛋白的抑制表达情况Fig.3 Western blotting of inhibition of VCAM-1 in C2C12 cells
2.4 VCAM-1与EMCV结构蛋白间的相互作用加入融合蛋白GST-VCAM-1的Pull-down收获液及Input收获液均可与鼠抗GST单克隆抗体发生特异性结合,表明GST-VCAM-1成功固化在树脂上。加入融合蛋白His-VP1、His-VP2或His-VP3的Input收获液均可与兔抗His单克隆抗体发生特异性结合,加入His-VP1、His-VP2的Pull-down收获液可与兔抗His单克隆抗体发生特异性结合,加入His-VP3的Pull-down收获液未见该结合条带,见图4。表明VCAM-1与病毒蛋白VP1和VP2有明显的直接相互作用,与VP3无相互作用。

1:VP1;2:VP2;3:VP3。
3 讨论
多年来,已在多个国家相继报道了EMCV感染的暴发和流行,主要引起孕猪流产、死胎、弱胎及仔猪的急性、致死性脑炎、心肌炎等疾病,严重威胁养猪业的经济发展[17-18]。
相关研究发现,血管内皮细胞损伤是病毒性脑炎发病的一个主要机制,正常情况下非活化内皮细胞中VCAM-1呈不表达或低表达,当受到外源因子刺激或诱导后,组织、器官会产生各种病变,一般是从黏附分子的过量表达开始[19-20]。作为主要的两种黏附分子,细胞间黏附分子(intercellular cell adhesion molecule,ICAM-1)和VCAM-1可使细胞之间或与基质之间发生黏附,主要参与细胞生长、分化及与疾病相关的炎性反应[21-22]。研究表明,高表达VCAM-1可与整合素家族的极晚期抗原-4(very late antigen-4,VLA-4)相互作用,发挥炎症性损伤作用[23]。VCAM-1还与血栓形成、心功能衰退等疾病相关[24]。研究发现,在脂多糖(lipopolysaccharide,LPS)诱发的心肌炎性反应中,ICAM-1和VCAM-1表达显著上升,该反应主要通过I-κB的磷酸化和降解,从而释放、活化NF-κB p65,过量表达的ICAM-1和VCAM-1可加重炎性反应[22]。目前针对VCAM-1的研究基本上均与疾病的发展进程相关,如VCAM-1参与免疫细胞的黏附和迁移,VCAM-1与配体结合后具有加强黏附的作用,可促进炎性细胞的运动和迁移等,表明VCAM-1在炎症、肿瘤转移等病理过程中发挥重要作用[25-26]。
本研究通过检测EMCV感染后C2C12细胞内VCAM-1的表达情况,结果表明,C2C12细胞内VCAM-1基因转录及VCAM-1蛋白的表达水平随着EMCV感染时间的延长明显降低(P<0.001),验证了EMCV感染可抑制VCAM-1在细胞内的表达。进一步检测过表达及抑制表达细胞内VCAM-1对EMCV增殖的影响,结果显示,过表达VCAM-1可明显抑制EMCV增殖(P<0.001),抑制VCAM-1表达可促进EMCV增殖(P<0.001)。为验证VCAM-1与EMCV结构蛋白之间的相互作用,选取病毒蛋白VP1、VP2及VP3进行原核表达,利用带GST标签的VCAM-1作为诱饵蛋白,进行Pull-down验证,分别捕获含有His标签的VP1、VP2、VP3蛋白,结果显示,VCAM-1与VP1、VP2存在明显的相互作用,与VP3无相互作用。综上所述,VCAM-1对EMCV体外增殖发挥抑制作用,可能是通过VCAM-1与EMCV结构蛋白VP1、VP2的相互作用实现的。本实验为EMCV感染相关疾病的治疗及其相关疫苗的研发奠定了基础。

