花烟草植物防御素1蛋白在毕赤酵母中的表达及纯化
杨德奕,赵懿琛,龚伟伟,李昆鹏
1.贵州大学茶学院山地植物资源保护与种质创新省部共建教育部重点实验室贵州省农业生物工程重点实验室,贵州 贵阳550025;2.武汉金开瑞生物工程有限公司,湖北 武汉430223
植物防御素1(Nicotiala alatadefensin 1,NaD1)是植物固有免疫系统的重要组成部分,是植物抵御真菌攻击的第一道防线[1],一般对哺乳动物和植物细胞无毒,对植物及人类的真菌病原体具有较强抗菌活性[2-3]。NaD1蛋白可在花烟草Nicotiala alata的花芽中提取获得[4]。研究发现,在花烟草Nicotiala alata中,NaD1蛋白穿过真菌细胞质膜及进入细胞质前,与真菌细胞壁发生特异性作用,进入细胞后,迅速引发产生活性氧(reactive oxygen species,ROS),真菌质膜发生透化,导致真菌细胞死亡[5-7]。NaD1蛋白对尖孢镰刀杆菌(Fusarium oxysporum)、灰霉菌(Botrytis cinerea)、念珠菌(Candida albicans)等多种致病性真菌也具有良好的抗菌活性[8]。另有研究表明,NaD1蛋白可与磷酸酰肌醇4,5-二磷酸发生特异性、高亲和力的相互作用,从而发挥抑制肿瘤细胞活性的作用[9],但作用机制尚未明确。
NaD1蛋白的传统分离纯化方法复杂,成本较高。甲醇毕赤酵母具有表达量高、糖基化机制较接近高等真核生物、分泌蛋白便于纯化、可高密发酵、生长繁殖迅速、可耐受较高强度的流体静压、易于大规模生产等优点[10-11]。研究表明,已有500多种蛋白在毕赤酵母中实现了分泌表达,其中大部分为可投入产业化的药用蛋白[12]。毕赤酵母对原核生物大量繁殖培养较容易,对真核生物基因产物可进行正确折叠及翻译后修饰加工[13-14]。武如娟[15]将抗菌抗病毒杂合肽Cecropin(1-8)-LL37(17-30)基因克隆至毕赤酵母表达载体pPICZαA中,表达纯化后每升发酵液中可提取190.65 mg的重组杂合肽;李旭锋等[16]将新城疫病毒(Newcastle disease,NDV)HN蛋白的基因克隆至毕赤酵母表达载体pPICZαA中,表达纯化后可获得纯度高于90%的重组蛋白。本研究将重组表达质粒pPIC9K-NaD1于毕赤酵母GS115中诱导表达,并进行Ni-NTA纯化,以期获得较高纯度的重组蛋白NaD1,为后续NaD1蛋白杀伤真菌及抑制癌细胞作用机制的研究奠定基础。
1 材料与方法
1.1 质粒及菌株 重组表达质粒pPIC9K-NaD1由武汉金开瑞生物工程有限公司构建(将NaD1基因序列[17]克隆至载体pPIC9K,经双酶切验证构建正确);载体pPIC9K、感受态E.coliTOP10及感受态毕赤酵母GS115均由该公司提供。
1.2 主要试剂及仪器 磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)、甘油(C3H8O3)、葡萄糖(C6H12O6)、甲醇(CH3OH)、乙二胺四乙酸二钠(EDTA·2Na)、三氯乙酸(trichloroacetic acid,TCA)、酪蛋白及咪唑均购自北京国药集团化学试剂有限公司;内切酶SacⅠ、RDB培养基及Geneticin(G418)均购自美国赛默飞世尔科技有限公司;BMGY液体培养基及YP培养基均由贵州大学茶学院山地植物资源保护与种质创新省部共建教育部重点实验室自制;限制性内切酶EcoRⅠ、NotⅠ、小鼠抗NaD1单克隆抗体、HRP标记的羊抗小鼠IgG、消泡剂、质粒提取试剂盒、Ni-NTA柱、0.22μm过滤器、10 kDa超滤管均由武汉金开瑞生物工程有限公司提供。
1.3 重组表达质粒的转化 将重组表达质粒pPIC9KNaD1经内切酶SacⅠ线性化后,进行1.2%琼脂糖凝胶电泳,回收酶切产物,电转化至感受态毕赤酵母GS115中(参数设置为:电压1 500 V,时间5 ms),涂布于RDB+G418平板培养基,于30℃孵育3~4d进行筛选。
1.4 阳性克隆的鉴定 根据GenBank中登录的NaD1基因序列(AF509566.1)的开放阅读框,应用Oligo 7软件设计引物,F:5′-GAGAGGCTGAAGCTTACGTAGAATTCATGCACCATCACCATCACCATAGAGAATG-3′,R:5′-TGTCTAAGGCGAATTAATTCGCGGCCGCTTAGTTATCCATTATCTCTTCTTCAAG-3′,扩增产物大小为278 bp。引物由武汉金开瑞生物工程有限公司合成。挑取筛选的重组阳性克隆单菌落,进行菌落PCR检测。PCR反应体系为:dNTP 1.6μL,10×buffer 2.0μL,上、下游引物各0.2μL,Enzyme 0.2μL,ddH2O补足总体系至20.0μL。PCR反应程序为:94℃5 min;94℃30 s,57℃30 s,72℃90 s,共30个循环;72℃7 min。同时设空白对照(未加模板)。PCR产物经1.2%琼脂糖凝胶电泳检测。将检测正确的重组阳性克隆送武汉金开瑞生物工程有限公司测序。
1.5 重组蛋白的小量诱导表达 挑选菌落PCR鉴定阳性的克隆,加至1.5 mL BMGY液体培养基中,于30℃,200 r/min摇床培养48 h;静置5~6 h,弃上清,加入1 mL BMMY液体培养基,继续培养24 h;加入200μL含5%甲醇的YP培养基,继续培养24 h;8 929×g离心10 min,取上清,加入150μL TCA,冰浴2 h;重复离心,弃上清,加入200μL丙酮洗涤沉淀,重复离心,弃上清,置60℃烘箱烘干15~20 min;加入20μL 1×loading buffer重悬后,进行15%SDS-PAGE分析。同时设阴性对照(转染空载体pPIC9K的菌落)。
1.6 重组蛋白的大量表达及纯化 挑取小量诱导表达水平较高的单菌落,接种于1 L BMGY液体培养基中,于30℃200 r/min培养24 h;4 722×g离心3 min,弃上清,接种于1 L BMMY培养基中,加入200μL消泡剂,继续培养24 h;加入1%的甲醇,继续诱导培养24 h;重复上步操作,4 722×g离心5 min,取上清,经不锈钢圆盘过滤器过滤,透析柱法浓缩至200 mL,即浓缩上清。用1 mol/L Tris(pH 9.0)调节浓缩上清pH至8.0;经0.22μm过滤器过滤,以1 mL/min的流速上样Ni-NTA柱,用NTA-0缓冲液(pH 8.0)洗至流出液体不含蛋白,再用250 mmol/L咪唑洗脱,收集洗脱液,经10 kDa超滤管超滤浓缩至1~2 mL。
1.7 纯化产物的鉴定 采用Western blot法。纯化的重组蛋白NaD1经15% SDS-PAGE分离后,电转移至PVDF膜,用含1%酪蛋白的封闭液于37℃封闭2 h;PBST洗涤3次,加入小鼠抗NaD1单克隆抗体(1∶1 000稀释),于37℃孵育60 min;PBST洗涤3次,加入HRP标记的羊抗小鼠IgG(1∶3 000稀释),于37℃孵育60 min;ECL法显色。另取200μL纯化的重组蛋白NaD1,加入2×上样缓冲液,煮沸10 min,送武汉金开瑞生物工程有限公司进行蛋白质谱鉴定。
2 结果
2.1 重组表达质粒的鉴定 重组表达质粒pPIC9KNaD1的单切酶(SacⅠ)产物经1.2%琼脂糖凝胶电泳分析,可见9 572 bp的目的基因片段,大小与预期一致,见图1。
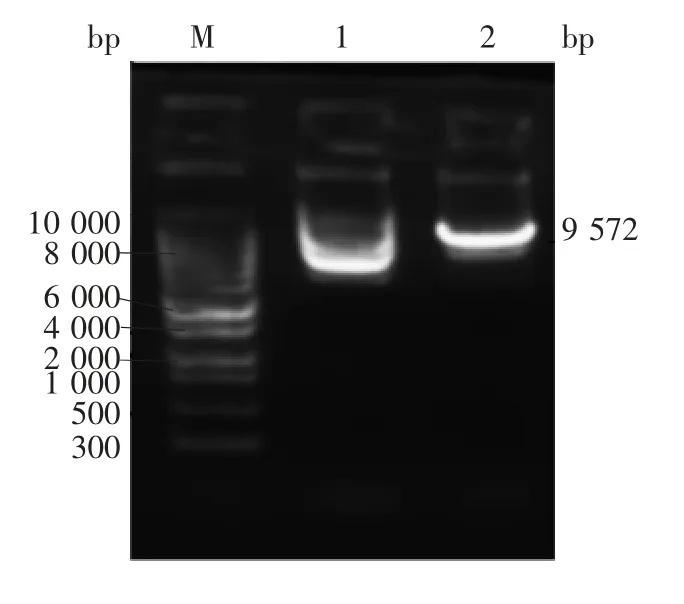
图1 重组表达质粒pPIC9K-NaD1的单酶切产物(SacⅠ)电泳图Fig.1 Electrophoretic profle of recombinant plasmid pPIC9KNaD1 digested with SacⅠ
2.2 阳性克隆的鉴定 经电转化获得的重组阳性克隆经菌落PCR检测,可见278 bp的目的条带,大小与预期一致,见图2。测序结果表明,目的基因序列与GenBank中登录的NaD1基因序列(AF509566.1)开放阅读框一致。
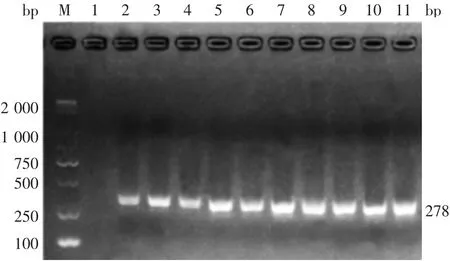
图2 阳性克隆的菌落PCR鉴定Fig.2 Identification of positive clones by PCR
2.3 小量诱导表达产物的鉴定 所有阳性克隆重组蛋白的表达均不明显,因此需进一步进行大量诱导表达。其中5号阳性克隆诱导表达的重组蛋白水平相对较高,于相对分子质量约20 000处略可见目的蛋白条带,见图3。因此,选择5号阳性克隆进行大量诱导表达重组蛋白。
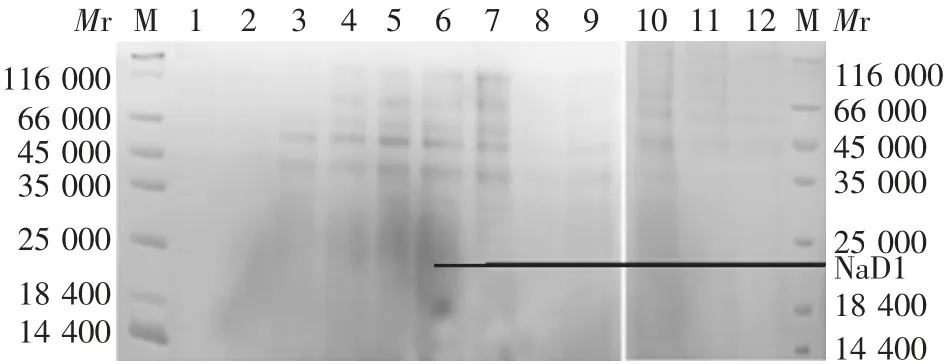
图3 阳性克隆表达产物的SDS-PAGE分析Fig.3 SDS-PAGE profile of expressed product in positive clones
2.4 纯化产物的鉴定 纯化产物相对分子质量约20 000,大小与预期一致,见图4;纯化产物可与小鼠抗NaD1单克隆抗体发生特异性结合,且于相对分子质量约20 000处可见特异性结合条带,见图5。纯化重组蛋白NaD1纯度可达85%,蛋白得率为0.25mg/L。在可信度conf≥95%,Unique peptides≥1时,重组蛋白NaD1鉴定到的蛋白质总数为8,覆盖度(Coverage)最高比对蛋白为6 His-NaD1,覆盖度达12%,相对分子质量为9 700,大小与理论值相符,见表1。上述结果表明,于酵母表达系统中成功纯化获得了重组蛋白NaD1。

图4 纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE profile of purified product

表1 纯化产物的蛋白质谱鉴定结果Tab.1 Protein mass spectrometry of purified product
3 讨论
本研究将重组表达质粒pPIC9K-NaD1电转化至毕赤酵母感受态GS115中进行NaD1重组蛋白分泌表达。转化重组表达质粒pPIC9K-NaD1的GS115通过G418筛选,获得了阳性克隆菌株,经甲醇诱导后,表达水平较低,可能是由于小量表达诱导不足所致。因此,选择了表达量相对较高的单菌落进行扩大培养,大量表达的重组蛋白经Ni-NTA纯化后,纯化产物可与小鼠抗NaD1单克隆抗体发生特异性结合,于相对分子质量约20 000处可见特异性结合条带,条带大小与重组蛋白NaD1理论值11 000不符,是由于含有His标签所导致的;蛋白条带呈弥散状态,推测是由于酵母系统表达中发生了糖基化修饰[18]及NaD1蛋白形成了多聚体[19]。本研究获得纯化产物的纯度为85%,得率为0.25 mg/L,今后将进一步优化其表达体系,以期得到更高表达及纯化效率的NaD1蛋白。
综上所述,本研究于毕赤酵母表达系统中成功表达了重组蛋白NaD1,并进行了纯化,获得了纯度较高的重组蛋白NaD1,为后续NaD1蛋白杀伤真菌和抑制癌细胞作用机制的研究奠定了基础。

