百日咳丝状血凝素与志贺毒素B亚单位的融合表达及其免疫保护效果评价
刘兆禄,朱力,潘超,卢瑛,王恒樑,
1.上海海洋大学,上海201306;2.军事医学研究院生物工程研究所,北京100071
百日咳是由百日咳博德特菌引起的急性呼吸道传染病,其最早于1414年在法国出现,也是世界上使用疫苗控制效果较差的可预防疾病之一[1]。百日咳的临床特征为阵发性或暴发性的多次快速咳嗽,并伴有特征性的“鸡鸣”样吸气性吼声,最常见的并发症是继发性肺炎。该病多发于儿童及婴幼儿年龄段,特别是小于6个月的婴儿[2]。尽管目前已有针对百日咳的预防性疫苗且疫苗接种率高,但百日咳仍为儿童死亡的主要病因之一。
天然的丝状血凝素(filamentous haemagglutinin,FHA)是在细菌细胞表面表达的百日咳博德特菌黏附素,也会分泌到细胞外环境中,其包含几个促进细菌黏附于纤毛呼吸道上皮细胞的结构域,包括保守的三肽序列RGD(Arg-Gly-Asp)、碳水化合物识别结合域和肝素结合域[3]。FHA通过RGD与巨噬细胞和其他细胞表面的3型补体受体(type 3 complement receptor,CR3)结合来启动吞噬作用,然后毒素介导的细胞内杀伤抑制作用可促进细菌存活[4]。为探究FHA最具免疫原性的区域,ASGARIAN-OMRAN等[5]通过人血清抗体对FHA不同区域进行测定,证明在FHA氨基酸残基1877-2250位置能够诱导最有效的免疫应答,是FHA最具免疫显性的区域。
志贺毒素B亚单位(shiga toxin B subunit,StxB)早期即被证实可作为载体蛋白在轮状病毒抗原刺激小鼠后提供保护性黏膜体液和细胞免疫反应[6]。StxB作为抗原载体与特定细胞表面受体结合,使树突状细胞(dendritic cell,DC)以受体介导的内吞方式高效摄取抗原蛋白,显著活化初始T细胞进行增殖。同时,StxB还为抗原提供了更加复杂的结构,更利于抗原提呈及淋巴结引流,有效诱导机体的免疫应答。因此,在疫苗研发领域,StxB已成为亚单位疫苗有效的载体之一。
本研究以百日咳FHA氨基酸残基1877-2250片段与StxB作为融合蛋白构建亚单位疫苗,并分析其免疫原性和免疫保护效果,为百日咳疫苗的研究提供新的思路。
1 材料与方法
1.1 质粒、菌种及FHA片段StxB序列载体及表达载体pET-28a(+)由军事医学研究院生物工程研究所八所二室保存;感受态大肠埃希菌DH5α、BL21(DE3)购自北京全式金生物技术有限公司;BCA蛋白定量试剂盒购自美国Thermo Fisher公司;百日咳Bp148株菌由北京儿童医院姚开虎教授惠赠;FHA氨基酸残基1877-2250片段由南京金斯瑞生物技术有限公司合成。
1.2 实验动物SPF级BALB/c小鼠,5~6周龄,雌性,体重18 g,购自北京维通利华公司,动物生产许可证号:SCXK(京)2016-0006,使用许可证号:1100111911040351。在军事医学研究院动物中心(AAALAC认证)根据国家科技部《实验动物管理条例》饲养。
1.3 主要试剂T4 DNA连接酶和DNA marker购自日本TaKaRa公司;蛋白定量试剂盒、EcoRⅠ和XhoⅠ限制性内切酶购自美国Thermo Fisher Scientific公司;IPTG购自美国Amresco公司;氢氧化铝佐剂购自美国Sigma-Aldrich公司;10×TBS、PCR2×Super Pfx MasterMix酶、质粒提取试剂盒和PCR产物回收试剂盒均购自北京康为世纪生物科技有限公司;HRP-Anti-6×His tag购自上海Abmart生物医药有限公司;HRP标记的羊抗鼠IgG购自北京TransGen Biotech有限公司;兔源补体由中国食品药品检定研究院提供;无水甲醇、甘氨酸和Tris购自国药集团化学试剂有限公司;其他常用试剂为国产分析纯。
1.4 引物设计及合成 通过DNAclub软件设计合适的引物扩增StxB和FHA1877-2250片段,并在StxB的3′端和FHA1877-2250的5′端添加一段接头蛋白GGGS序列(GGCGGATCCGGC)将两个片段连接在一起。FHA1877-2250片段引物序列:FHA-F1:5′-CGGAATTCGACGAGCACCGTCACCTGCTGAACG-3′(下划线部分为EcoRⅠ酶切位点),FHA-R1:5′-GCCTCGAGACCATCCGCCAGGCTGGTCTGC-3′(下划线部分为XhoⅠ酶切位点),扩增片段大小为1 134 bp。StxB片段引物序列:StxB-F1:5′-CGGAATTCATGAAAAAAACATTATTAATAGCTGC-3′(下划线部分为EcoRⅠ酶切位点),StxB-R1:5′-ACGAAAAATAACTTCGCTGAATCCCCCTCC-3′,扩增片段大小为267 bp。所有引物由北京天一辉远生物科技有限公司合成。
1.5 各目的片段的扩增 以带有FHA1877-2250片段的质粒为模板,利用引物FHA-F1和FHA-R1进行PCR扩增,反应条件:94℃预变性6 min;95℃变性30 s,58℃退火25 s,72℃延伸30 s,共25个循环;72℃终延伸8 min。以带有StxB片段的质粒为模板,利用引物StxB-F1和StxB-R1进行PCR扩增,反应条件:94℃预变性6 min;95℃变性30 s,58℃退火15 s,72℃延伸30 s,共25个循环;72℃终延伸8 min。以扩增片段StxB和FHA1877-2250为模板,通过引物StxBF1和FHA-R1扩增融合片段StxB-Fha1877-2250。PCR反应条件:94℃预变性6 min;95℃变性30 s,58℃退火40 s,72℃延伸30 s,共25个循环;72℃终延伸8 min。扩增片段均经1%琼脂糖凝胶电泳鉴定。
1.6 重组表达质粒的构建 将StxB-Fha1877-2250、FHA1877-2250片段和载体pET-28a(+)分别经EcoRⅠ和XhoⅠ双酶切后回收,通过T4 DNA连接酶连接,分别构建重组表达质粒pET-28a-StxB-Fha1877-2250和pET-28a-FHA1877-2250。将重组质粒转化感受态大肠埃希菌DH5α,涂布于含卡那霉素(50μg/mL)的LB平板,于37℃培养箱中培养过夜。次日挑取单克隆,经PCR验证,阳性单克隆送天一辉远公司测序,验证引物序列:FHA-F:5′-GCAACGTTGGAAGGATTTCAAAGCGG-3′,T7-Ter-R:5′-GCTAGTTATTGCTCAGCGG-3′。
1.7 目的基因的诱导表达 将测序正确的重组表达 质 粒pET-28a-StxB-Fha1877-2250、pET-28a-FHA1877-2250转化大肠埃希菌BL21(DE3),涂布于含卡那霉素(50μg/mL)的LB平板上,隔夜挑取单克隆,接种于含卡那霉素(50μg/mL)的LB液体培养基中,置28℃,220 r/min振荡摇床中培养至A600值达0.6左右时,加入终浓度为1 mmol/L的IPTG诱导12 h,取1 mL菌体,加入90μL ddH2O重悬,再加入90μL 2×SDS Buffer充分混匀,沸水浴10 min,进行12%SDS-PAGE分析。
1.8 表达产物的Western blot鉴定 表达的重组蛋白经12% SDS-PAGE分离后,转移至PVDF膜上,用封闭液(1 g脱脂奶粉加入20 mL TBST)于37℃恒温箱中封闭1.5 h;加入His-tag抗体(1∶5 000稀释),37℃孵育1 h;1×TBST清洗3次,每次8 min,在显影仪上显影。设置显影曝光时间为15 min。
1.9 重组蛋白的纯化与复性 培养500 mL表达菌,离心弃上清,将菌体沉淀用上样缓冲液A1(0.5 mol/L NaCl,13.3 mL Tris-HCl,0.1 mmol/L Imidazole,pH 7.5)重悬,用细胞破碎仪破碎菌体,离心取破碎沉淀,用含尿素的缓冲液A2(0.5 mol/L NaCl,13.3 mL/L Tris-HCl,0.1 mmol/L Imidazole,8 mol/L Urea,pH 7.5)重悬菌液,待破碎菌体完全溶解后,6 941×g离心10 min,取上清进行纯化。将镍柱用10倍柱体积的缓冲液A2进行平衡,再将蛋白样品用4 mL/min的流速上样,最后以5倍柱体积的洗脱液(0.5 mol/L NaCl,13.3 mL/L Tris-HCl,8 mol/L Urea,0.5 mol/L Imidazole,pH 7.4)洗脱,收集目的蛋白。洗脱后的蛋白加入透析袋中,4℃环境下复性,复性后蛋白最终透析于储存液1×PBS(pH 8.0)溶液6~8 h。透析复性结束后,上清用0.22μm滤器过滤后分装,-80℃冻存备用。
1.10 动物分组及免疫 将30只健康BALB/c小鼠随机分为3组:StxB-Fha1877-2250、FHA1877-2250和对照组,每组10只。前两组免疫蛋白2.5μg/只+1/10体积的氢氧化铝佐剂,免疫剂量为100μL/只,对照组免疫等体积的PBS。所有小鼠均经皮下免疫3次,间隔2周。末次免疫后10 d经尾静脉采血,4℃隔夜后5 039×g离心7 min分离血清,测定小鼠血清抗体水平。
1.11 小鼠血清抗体水平的检测 采用间接ELISA法。以带有GST标签的FHA1877-2250蛋白作为包被抗原,加入96孔板,100μL/孔,含GST-Fha1877-2250蛋白10μg,4℃包被过夜;次日用TBST洗涤3次,加入5%脱脂牛奶,37℃封闭1 h;加入倍比稀释的小鼠血清,37℃孵育1 h;用PBST洗涤3次,加入HRP标记的羊抗鼠IgG(1∶20 000稀释),37℃孵育1 h;用PBST洗涤3次,加入TMB溶液,避光显色15 min;加入终止液H2SO4终止5 min后,用酶标仪读取波长490 nm处吸光度值。以对照组小鼠血清平均A490值的2.1倍为阳性判定标准,计算免疫动物抗体滴度。
1.12 血清体外杀菌试验 将百日咳Bp148株培养至A600为2.0时,用生理盐水稀释至菌浓度为100~200 CFU/10μL,取10μL稀释的菌液,与倍比稀释的10μL血清(预先58℃水浴30 min,以灭活其中的补体成分)混合,37℃孵育1 h;加入20μL补体充分混匀,37℃孵育1 h;全部涂LB平板,37℃温箱培养5 d,计数平板菌落总数,计算杀菌率。
1.13 动物攻毒保护试验 末次免疫后第14天,对3组小鼠腹腔接种2倍半数致死剂量(1.21×108CFU)的百日咳Bp148株菌液,感染后观察14 d,统计小鼠死亡情况。
1.14 统计学分析 应用Graphpad Prism 7.00软件进行统计学分析,通过非配对t检验,方差不齐经Welch矫正分析,以P<0.05为差异有统计学意义。
2 结果
2.1 扩增产物的鉴定StxB、FHA1877-2250、StxB-Fha1877-2250片段的扩增产物经1%琼脂糖凝胶电泳分析,分别可见约250、1 100和1 500 bp的特异条带,大小均与预期一致,见图1。
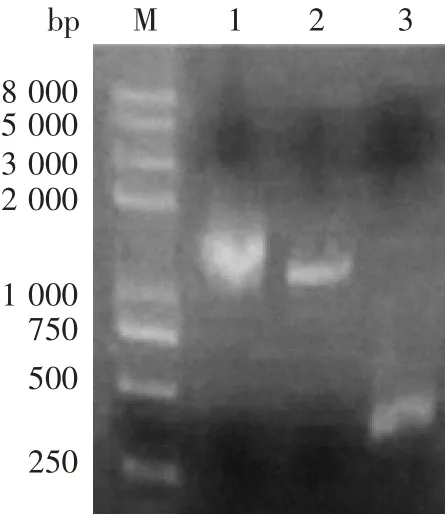
图1 StxB、FHA1877-2250、StxB-Fha1877-2250基因PCR扩增产物电泳图Fig.1 Electrophoretic profile of PCR products of StxB,FHA1877-2250 and StxB-Fha1877-2250 genes
2.2 重组表达质粒的鉴定 菌落PCR验证结果显示,重组质粒pET-28a-StxB-Fha1877-2250和pET-28a-FHA1877-2250的单克隆均可扩增出351 bp的特异片段,与理论序列大小一致,见图2。阳性单克隆的StxBFha1877-2250测序结果与GenBank中登录的cDNA序列(BX470248.1)进行比对,结果100%同源,表明重组表达质粒构建正确。
2.3 表达产物的鉴定12%SDS-PAGE分析显示,与未诱导菌相比,诱导菌在相对分子质量约43 000、51 000处有明显表达的蛋白条带,与目的蛋白FHA1877-2250、StxB-Fha1877-2250的预测值相符。Western blot进一步验证了目的蛋白表达正确。见图3。
2.4 纯化产物的鉴定 复性后的蛋白经12% SDSPAGE分析,纯度超过98%,见图4。经BCA蛋白定量试剂盒检测,纯化后StxB-Fha1877-2250蛋白含量为399.36μg/mL,FHA1877-2250蛋白含量为269.79μg/mL。
2.5 免疫小鼠抗体水平 间接ELISA检测结果显示,末次免疫后第10天,StxB-Fha1877-2250和FHA1877-2250组小鼠均能产生抗FHA的特异性抗体,抗体效价与对照相比,差异均有统计学意义(F分别为17.92和20.43,P均<0.000 1),且StxB-Fha1877-2250组相比于FHA1877-2250组能够产生更高水平的特异性抗体(F=3.81,P=0.001 7),见图5。表明重组蛋白StxBFha1877-2250免疫小鼠后能有效刺激机体产生特异性B细胞免疫应答。
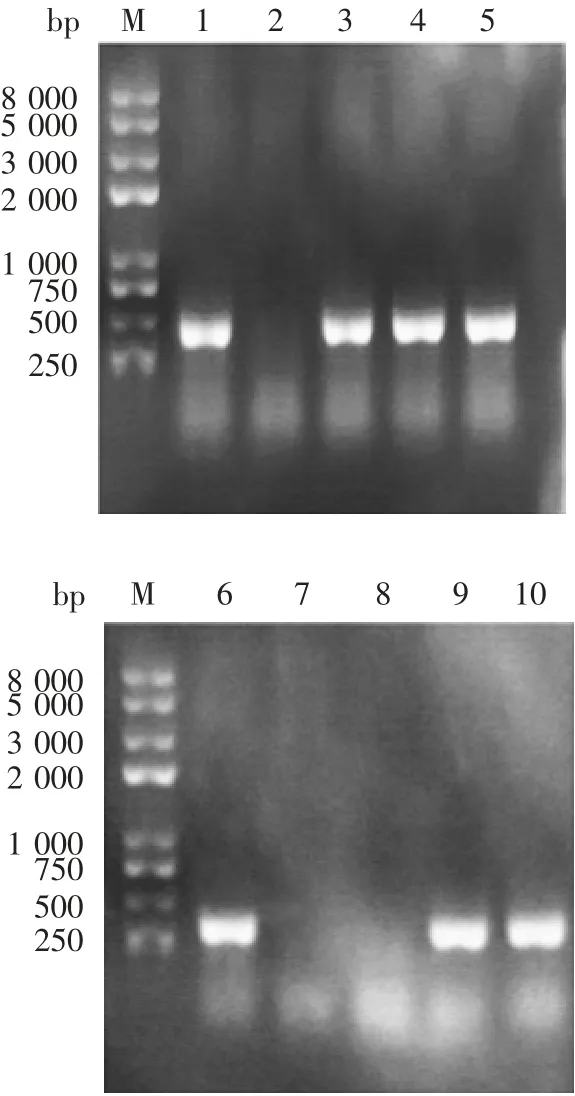
图2 重组表达质粒的PCR验证Fig.2 Verification of recombinant plasmid by PCR

图3 重组蛋白的SDS-PAGE(A)及Western blot(B)鉴定Fig.3 SDS-PAGE(A)and Western blot(B)profiles of recombinant proteins

图4 纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE profile of purified recombinant proteins

图5 ELISA检测各组免疫小鼠血清中的抗体滴度Fig.5 Determination of serum antibody titers of mice in various groups by ELISA
2.6 血清体外杀菌活性StxB-Fha1877-2250和FHA1877-2250组初始浓度的血清几乎可达到80%的杀菌效果,但当血清稀释至80倍后,杀菌效果明显下降,两组血清的杀菌效果差异无统计学意义(F=1.435,P=0.1850),但StxB-Fha1877-2250组的血清杀菌效率比FHA1877-2250组略好。见图6。
2.7 动物攻毒保护效果 攻毒18 h后,小鼠出现活动减少、精神萎靡等症状;24 h后,3组小鼠开始死亡;72 h后,对照组小鼠全部死亡,而FHA1877-2250组小鼠在4 d内有6只死亡,StxB-Fha1877-2250组小鼠有4只死亡,其余小鼠在经历萎靡不振后慢慢恢复健康。StxB-Fha1877-2250和FHA1877-2250组小鼠小鼠存活率与对照组相比,差异均有统计学意义(P分别为0.000 5和0.004 0);StxB-Fha1877-2250组与FHA1877-2250组相比,差异无统计学意义(P=0.363 5)。见图7。表明融合蛋白StxB-Fha1877-2250具有较好的潜在保护效果,有效保护率为60%。

图6 不同稀释度血清补体杀菌活性Fig.6 Complement bactericidal activity of serum at different dilutions

图7 攻毒后各组小鼠的存活情况Fig.7 Survival of immunized mice after challenge
3 讨论
通过疫苗接种获得的免疫不是终生的,其保护效果在4~10年内趋于减弱,使现今百日咳的发病率重新升高。因此,开发新一代疫苗需进一步研究百日咳博德特菌的发病机制和疫苗的免疫效果[7]。亚单位疫苗免疫原性低是普遍存在的问题,进入机体后无法产生充分刺激,对免疫系统激活能力差,可采用多种疫苗提送系统(如胞外囊泡[8]、自组装蛋白纳米颗粒[9]、病毒样颗粒[10]等)促进抗原更高效地被抗原提呈细胞识别与递送,激发T细胞依赖的免疫应答,相关研究也在进行中。
作为百日咳博德特菌的主要外膜蛋白,FHA不仅丰度较高,同时也是现今百日咳无细胞疫苗(acelluar pertussis vaccine,apv)的主要组成成分。本实验将StxB片段构建至FHA1877-2250N-端进行融合表达,纯化的StxB-Fha1877-2250蛋白免疫动物后用Bp146菌株攻击对其免疫效果进行评价。结果显示,FHA1877-2250组小鼠的保护率达40%,即单一的FHA1877-2250抗原能够刺激机体产生一定的免疫保护,与ASGARIANOMRAN等[5]报道一致;在此基础上,融合了StxB的StxB-Fha1877-2250组保护率又有所提高,达60%。虽然在之后的体外杀菌试验中两组并无明显差异,但通过间接ELISA检测的StxB-Fha1877-2250抗体效价最高可达1∶3 200,证实StxB与FHA1877-2250融合有助于提高单抗原的免疫原性和免疫保护性。
通常,关于StxB蛋白制备的信息很少,且多数报道与StxB融合蛋白有关[11]。这种小尺寸蛋白质在原核宿主微生物(包括大肠埃希菌)中包含3个二硫键,因此其作为包涵体以非活性和不溶性蛋白产生。当在大肠埃希菌中过表达时,由于包涵体的形成,在随后的进一步处理中最终获得的StxB数量可能会受到限制。另外,大肠埃希菌自然产生高度免疫原性的内毒素,也会限制这种材料的应用。虽然目前已开发了不产生内毒素的大肠埃希菌系统[12-13],但还需更多验证来确定它们是否适用于生产StxB片段。总的来说,生物技术生产StxB片段或由StxB片段和具有特定功能的蛋白质组成更复杂的融合蛋白在技术上是可行的[14]。
总之,基于StxB的药物递送系统具有将小分子和大分子药物递送至细胞内的载体潜力。多抗原组合或融合表达有利于研发多样性的亚单位疫苗,是开发广谱疫苗的研究思路。因此,筛选结构更为保守、免疫原性更好的抗原与适合的载体进行融合或组合,将对百日咳亚单位疫苗的研究带来帮助。本实验以百日咳FHA1877-2250蛋白为研究对象,成功构建了原核表达质粒,并经纯化复性获得百日咳StxBFha1877-2250融合蛋白。通过动物试验、间接ELISA及体外杀菌试验证实,StxB-Fha1877-2250蛋白具有更良好的免疫原性和反应原性,可作为具有潜力的百日咳亚单位疫苗之一。

