基于高通量测序的陶融型大曲微生物群落结构分析
陈蒙恩,赵 聪,韩素娜,周丹凤,李建民,张 劲,黄润娜,王晓毅,邓 杰,胡晓龙
(1.河南仰韶酒业有限公司,河南 三门峡 472400;2.三门峡市科学技术情报研究所,河南 三门峡 472400;3.三门峡市第二中学,河南 三门峡 472400;4.四川轻化工大学 酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;5.郑州轻工业大学食品与生物工程学院,河南 郑州 450000)
大曲是一种富含微生物菌群、菌系及复合曲香的微生态制品,具有糖化、发酵、生香等功能[1],其质量优劣直接影响到白酒的品质和风味特征[2-4]。由于大曲制作为开放式,其微生物类群十分丰富,包括霉菌、细菌及酵母菌等,这些微生物能够产生各种酶和风味物质,因此,微生物群落是决定大曲品质的核心因素之一[5-8]。
以往对大曲微生物的研究多采用传统分离培养方法,但该方法分离到的微生物在种类和数量上有限[9],通常会遗漏很多微生物种类,其中甚至可能有关键性功能微生物[10-11]。相比之下,高通量测序技术作为新一代测序方法,具有数据产出通量高、分析全面、灵敏、快速等特点,可方便快捷地对样品中复杂的微生物菌群结构进行分析[9,12],且高通量测序检测到的是样品中所有的DNA序列,包括微生物死亡后存留的DNA片段[13],能够更加客观地反映样品中微生物群落结构的真实性。
目前,利用高通量技术对大曲中微生物群落结构的研究已有相关报道[14-15],但对陶融型大曲微生物群落结构的研究尚鲜见报道。陶融型大曲是指在仰韶地域自然环境、生产原料、酿造工艺等因素的前提下,制造的陶融型白酒专用大曲[16-17]。陶融型大曲以小麦、大麦、豌豆为原料,经自然接种、陶屋培养发酵而成。本研究利用高通量测序技术及生物信息学方法,对陶融型大曲微生物群落结构的多样性进行研究,得出陶融型大曲中主要微生物构成,同时与大曲相关的理化指标进行相关性分析,旨在为解析陶融型大曲的糖化生香机理及筛选优良酿造功能微生物提供坚实的理论依据;同时,为进一步改良陶融型大曲的制作工艺及明晰大曲与优质陶融型白酒之间的关系提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 大曲样品
选取河南某公司定期跟踪的5 房成品陶融型大曲(5 房陶融型大曲为同一时间入房,入房时间为5月份,所取样的大曲在安曲培养阶段事先用红布条进行标记,在翻曲、并房、打拢、贮存阶段扔将其放置至指定位置,以便其能够代表整房陶融型大曲),大曲的贮存时间为120 d,每房曲均采用四点中心法进行取样,样品粉碎后过40 目筛,四分法浓缩至150 g,装于无菌袋内,4 ℃贮存备用。
1.1.2 试剂
DNA Ladder 2000、DL 2000TMDNA Marker 宝生物工程(大连)有限公司;Soil DNA Kit提取试剂盒 美国Omega公司;蛋白酶K、溶菌酶 美国Sigma公司;AxyPrep DNA凝胶回收试剂盒 美国Axygen公司。
1.2 仪器与设备
SW-CJ-VS2型超净工作台 无锡易纯净化设备有限公司;高速冷冻离心机 上海卢湘仪离心机仪器有限公司;NanoDrop2000微量分光光度计 美国赛默飞公司;C1000 Touch聚合酶链式反应(polymerase chain reaction,PCR)仪、Mini-subcell水平电泳仪、Chemi DocXRS+凝胶成像分析系统 美国Bio-Rad公司;MX-S型可调式混匀仪 美国SCILOGEX公司;QuantiFluor™-ST蓝色荧光定量系统 美国Promega公司。
1.3 方法
1.3.1 大曲相关理化指标检测
对贮存120 d的5 房大曲理化指标进行检测[1],检测指标包括水分、酸度、淀粉、还原糖、铵态氮、糖化力、发酵力、液化力、酯化力、蛋白酶活力,最终结果取5 房平均值。
1.3.2 大曲微生物总DNA提取及PCR扩增回收
采用Soil DNA Kit对大曲微生物总基因组DNA进行提取,提取方法按照试剂公司提供的实验操作指南进行。利用NanoDrop2000微量分光光度计对提取的微生物DNA浓度及纯度进行检测,将检测合格的DNA提取物置于-20 ℃备用。
PCR采用TransGen AP221-02、TransStart FastPfuDNA Polymerase,20 μL反应体系:5×FastPfuBuffer 4 μL,2.5 mmol/L dNTPs 2 μL;Forward Primer(5 μmol/L)0.8 μL;Reverse Primer(5 μmol/L)0.8 μL;FastPfuPolymerase 0.4 μL;BSA 0.2 μL;Template DNA 10 ng;补ddH2O至20 μL。PCR参数:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,28 个循环后,72 ℃延伸10 min,10 ℃保持至停止。全部样品按照正式实验条件进行,每个样品3 个重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。
1.3.3 PCR产物荧光定量
参照电泳初步定量结果,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统进行检测定量,之后按照每个样品的测序量要求,进行相应比例的混合。
1.3.4 高通量测序与数据分析
建库与测序在上海凌恩生物科技有限公司完成。高通量测序针对细菌16S rRNA基因515F_907R区域、真菌ITS1F_ITS2R区序列,设计带barcode[18]的特异引物,测序平台为Illumina MiSeq。通过双末端测序(PE sequencing)[19],将基因序列进行初级筛选,剔除测序质量较差的数据。通过barcode找对应编号样品,去掉引物,再把质量差的序列剔除。通过提取优化序列中的非重复序列,降低分析中间过程冗余计算量(http://drive5.com/usearch/manual/dereplication.html);去除没有重复的单序列(http://drive5.com/usearch/manual/singletons.html);按照97%相似性对非重复序列(不含单序列)进行可操作分类单元(operational taxonomic units,OTU)聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。
1.4 数据处理[20]
数据采用SPSS 19.0软件和Origin 9.0进行统计分析、绘图和相关性分析,P<0.05,差异显著。
2 结果与分析
2.1 大曲理化指标分析
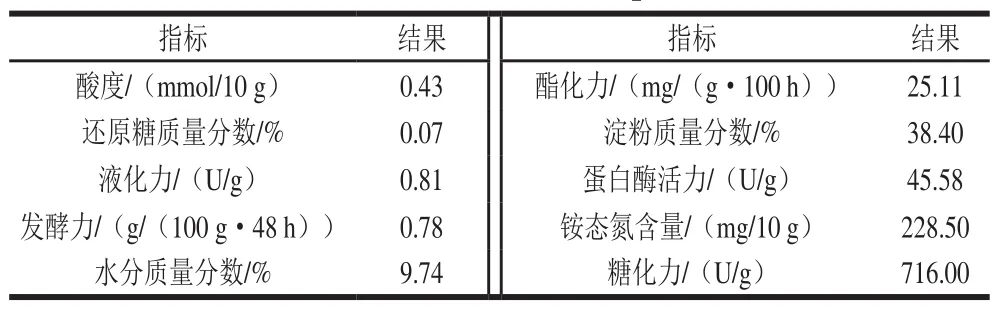
表1 贮存120 d大曲理化指标Table 1 Physicochemical indexes of Daqu stored for 120 days
对贮存120 d大曲的理化指标进行检测,结果见表1。糖化力保持在700 U/g以上,液化力在0.8 U/g左右,发酵力(CO2质量计)在0.8 g/(100 g·48 h)左右,蛋白酶活力在40 U/g以上,酯化力在20 mg/(g·100 h)以上,各理化指标均满足轻工行业对优质大曲质量要求的标准(QB/T 4259—2011《浓香大曲》)。
2.2 大曲样品PCR产物定量
对5 房陶融型大曲中微生物的总DNA进行提取,用凝胶电泳和微量分光光度计对基因组的质量进行检测,结果见表2、图1。
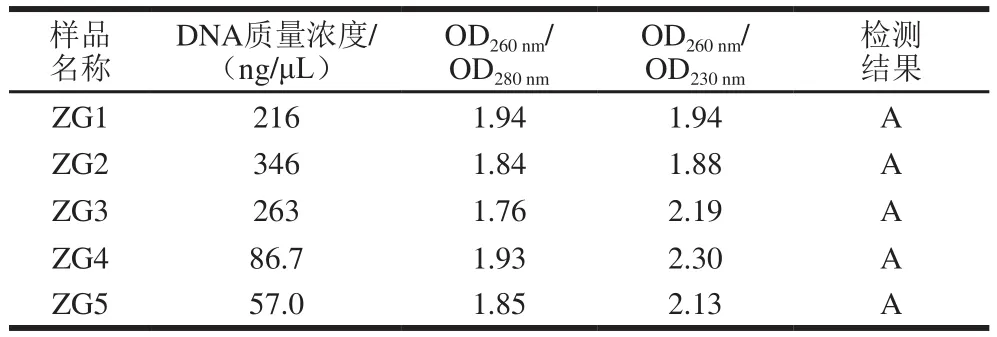
表2 不同DNA纯度检测结果Table 2 Purity of total DNA extracted from five Daqu samples

图1 5 房大曲凝胶电泳图Fig. 1 Agarose gel electrophoresis profiles of total DNA extracted from five Daqu samples
由表2可知,5 个样品DNA的OD260nm/OD230nm都在2.0左右,说明纯度较高。Illumina PE250测序对DNA质量要求:样品量≥500 ng,DNA质量浓度≥5 ng/μL。以上DNA样品均符合上机要求,可以用来做后续PCR扩增以及高通量测序。
2.3 高通量原始数据获取及统计学分析[21-22]
通过Illumina PE250高通量测序筛选获取有效基因组序列信息,测序数据统计见表3。经过分析统计,5 房大曲样品共获得细菌有效序列182 662 条,平均长度在380 bp左右,测序长度主要分布在351~400 bp(97.92%)之间,与设计引物扩增长度接近,由此判断测序结果较好。共获得真菌有效序列192 686 条,平均长度为280 bp,测序长度集中分布在251~300 bp,与设计引物扩增序列长度为300 bp左右较接近,说明本次测序结果较合理,保证了足够的测序数量,可以满足后续的数据分析。
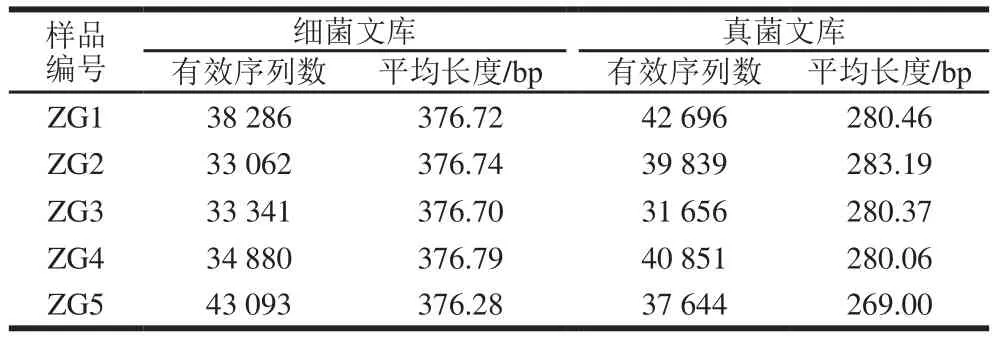
表3 文库测序情况数据统计Table 3 Statistics of bacterial and fungal genomic sequences
2.4 大曲微生物OTU分类

图2 大曲文库内OTU的Venn图Fig. 2 Venn diagrams showing unique and shared bacterial and fungal OTUs between clone libraries for five Daqu samples
稀释曲线可以比较测序数据量不同的样品中物种的丰富度,当曲线趋向平缓时,更多的数据量只会产生少量新的OTU,反之则表明继续测序还可能产生较多新的OTU[15]。Venn图可用于统计多个样品中共有和独有的OTU数,可以比较直观地表现样品OTU数组成相似性及重叠情况,对不同样品之间共有及独有的OTU数进行叠加,得出OTU分布的Venn图[23-25],见图2。结果表明:5 房陶融型大曲中共获得细菌OTU数为83 个,其中共同拥有的OTU数为45 个,占OTU总数的54%;共获得真菌OTU数为34 个,其中共同拥有的OTU数为19 个,占OTU总数的56%。图2中,ZG5号样品独有的OTU占细菌物种总数的7%,占真菌物种总数的6%,其他4 个样品结果基本一致,说明制曲工艺相对稳定;ZG5号样品可能是在培养过程中由于某种原因所造成,需要进一步进行相关研究。
2.5 Shannon指数和Rank指数分析
为研究取样量能否代表原样品物种丰富度,对样品个数和物种种类作稀释分布曲线[26-27],从而评估所构建文库的覆盖率是否达到饱和(图3)。以97%的序列相似度水平作为OTU的界定,通过分析样品的OTU数及分布情况,反映样品中所含种群的多样性及丰富度;通过Shannon指数[28]反映样品中微生物多样性;Rank-Abundance[29]解释样品物种丰度和物种均匀度(图4、5);物种累计曲线见图6。
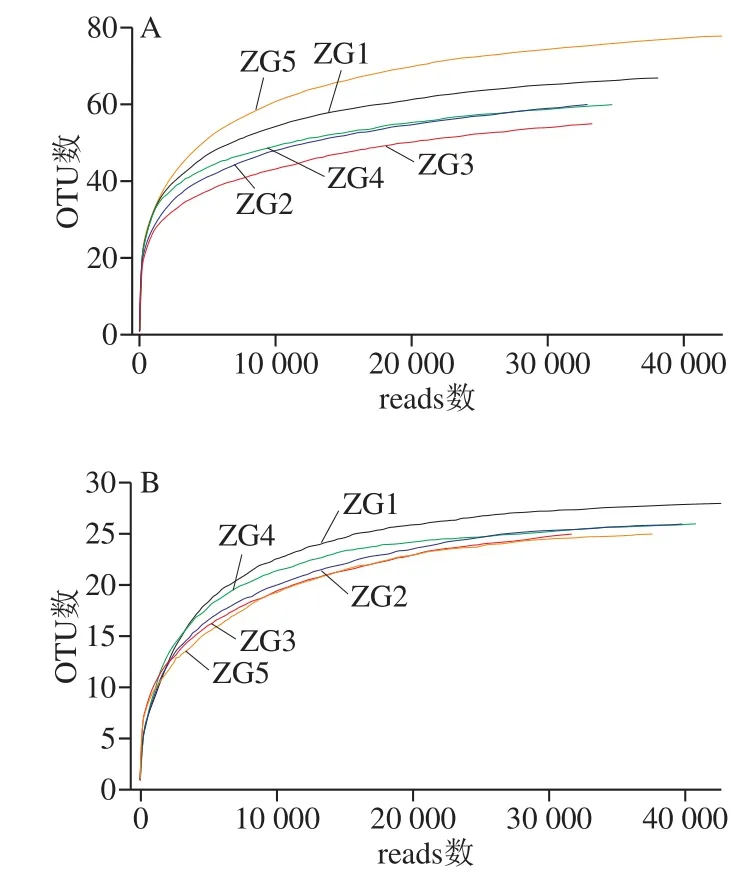
图3 样品稀释性曲线Fig. 3 Rarefaction curves
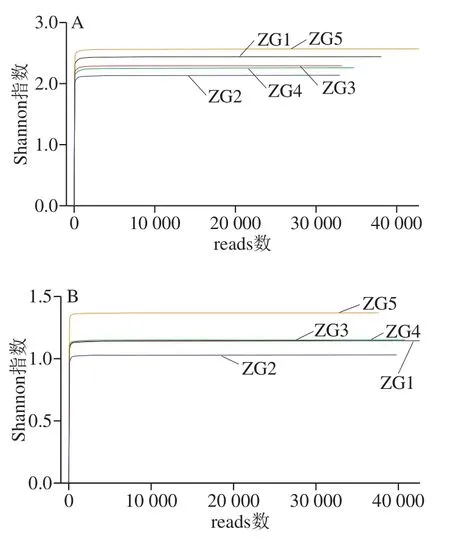
图4 样品Shannon曲线Fig. 4 Shannon Wiener curves
根据图3、4结果可得,各曲样的稀释性曲线和Shannon曲线都随测序深度的增加呈现先增加后趋于平缓的趋势,这表明测序数据量合理,测序深度能够反映出样品中绝大多数微生物的物种信息。图3中细菌文库内OTU数表现为ZG5>ZG1>ZG4>ZG2>ZG3;真菌文库的OTU数表现为ZG1>ZG4>ZG2>ZG3>ZG5,除第5房外,其他4 房与细菌文库基本一致。图4使用97%相似度的OTU,且曲线趋向平坦时,说明测序数据量足够大,完全可以反映样品中绝大多数的微生物信息。从Rank-Abundance曲线(图5)可以看出,细菌微生物多样性丰度及均匀度均高于真菌。
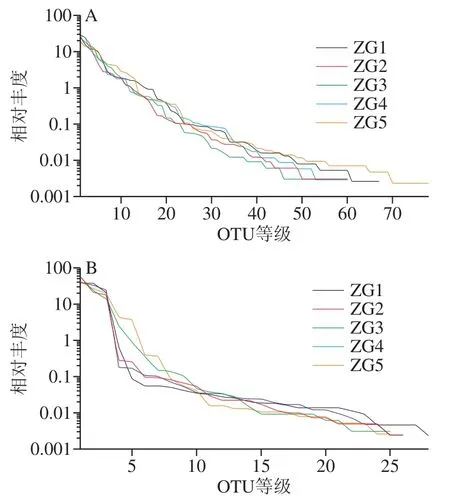
图5 OTU等级丰度曲线Fig. 5 OTU Rank-abundance curves

图6 物种累计曲线Fig. 6 Species accumulation curves
从图6可知,在一定范围内,随着样品量的加大,细菌曲线表现为急剧上升,表示群落中有大量物种被发现,之后趋于平缓,说明在之后的OTU抽样中物种并没有随样品量的增加而显著增多;真菌曲线一直处于平缓上升趋势,说明随着OTU抽样的进行,虽然不断有物种被发现,但物质种类不多。从两组曲线的总体变化趋势可知,在抽样过程中,样品总量满足实验所需,抽样充分,可以进行数据分析。
2.6 陶融型大曲群落结构组成

图7 样品聚类树与柱状图组合分析Fig. 7 Similarity in bacterial and fungal community compositions at phylum level between five Daqu samples
运用统计学的分析方法进行分类[28,30],图7结果显示,从获得的182 662 条大曲细菌优质序列中可以归类到9 个门,分别为:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、未归类的细菌(Bacteria_unclassified)、unclassified、梭杆菌门(Fusobacteria)、拟杆菌门(Bacteroidetes)、栖热链球菌门(Deinococcus-Thermus)。其中厚壁菌门、变形菌门、放线菌门和蓝藻门占比较大,分别为79.15%、15.30%、4.05%和1.42%,厚壁菌门为大曲中绝对的优势微生物,这是由于厚壁菌门主要由芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)等微生物组成[31],具有很强的环境适应性,能够在相对极端的条件保持生长代谢;放线菌广泛分布于土壤环境、海洋环境、植物体及其他极端自然生态环境中,同时和厚壁菌门相似,也具有极强的耐受性[32]。从获得的192 686 条大曲真菌优质序列中可以归类到3 个门,分别为子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)。其中子囊菌门真菌占比最大,达99.19%,接合菌门和担子菌门分别为0.80%和0.01%。

图8 属水平群落结构组分图Fig. 8 Bacterial and fungal community compositions at genus level in five Daqu samples
在属水平上细菌共得到54 个属,将相对丰度低于1%的合并为一类(others),由图8所示,5 个曲样中相对丰度较高的为厚壁菌门下的乳杆菌属(Lactobacillus,46.25%)、魏斯氏菌属(Weissella,13.21%)、泛菌属(Pantoea,8.02%)、明串珠菌属(Leuconostoc,7.92%)、Kroppenstedtia(5.21%)、片球菌属(Pediococcus,2.93%)、芽孢杆菌属(Bacillus,2.48%)、Enterobacteriaceae_unclassified(2.45%),放线菌门下的糖多孢菌属(Saccharopolyspora,3.23%),变形菌门下的Mitochondria_norank(1.96%)、伯克霍尔德菌属(Burkholderia,1.39%),蓝藻门下的Cyanobacteria_norank(1.43%)。5 个曲样的优势菌属主要分布在乳杆菌属、魏斯氏菌属、泛菌属、明串珠菌属、Kroppenstedtia、糖多孢菌属、片球菌属和芽孢杆菌属。
在属水平上5 个曲样中真菌的OTU可归为18 个属。真菌群落丰度不如细菌群落,是因为大曲在培养过程中顶火温度超过50 ℃,致使大部分真菌死亡,只有少部分耐热和嗜热真菌得以存活[33-34]。5 个曲样中的优势菌属为unidentified(43.06%)、嗜热真菌属(Thermomyces,27.27%)、嗜热子囊菌属(Thermoascus,26.41%)、曲霉属(Aspergillus,1.98%)、根毛霉属(Rhizomucor,0.65%);酵母在5 个曲样中相对丰度均不高,如威克汉姆酵母(Wickerhamomyces)、哈萨克斯坦酵母(Kazachstania)等虽有鉴定出但其相对丰度均小于1%。通过高通量测序对陶融型大曲的真菌群落多样性进行分析,结果表明,制曲温度对真菌群落结构的组成具有重要影响,后期可通过调节制曲温度对陶融型大曲的群落结构进行调控。
2.7 微生物与理化指标的相关性分析
通过对5 房大曲的微生物群落结构解析可知,在5 房大曲中细菌和真菌的优势菌属基本相同,但是各类优势均属的相对丰度又存在一定差异性,通过冗余分析(redundancy analysis,RDA)确定样品中群落结构与理化指标的关系。细菌群落结构和理化指标进行RDA(图9A),PC1为83.3%,PC2为10.9%,贡献值最大的理化指标是还原糖,其次是铵态氮,再次是蛋白酶活力和液化力;真菌群落结构和理化指标进行RDA(图9B),PC1为77.3%,PC2为22.4%,贡献值最大的理化指标是液化力,其次是糖化力,再次是发酵力和还原糖。
图9 结果显示,液化力、还原糖和酯化力与Kroppenstedtia和Enterobacteriaceae_unclassified有较强的正相关,与乳杆菌属负相关较强;铵态氮与魏斯氏菌属和明串珠菌属正相关,而蛋白酶活力与这2 个菌负相关;蛋白酶活力与泛菌属、伯克霍尔德菌属、Cyanobacteria_norank等正相关,而铵态氮与这些菌负相关;发酵力、糖化力和液化力与根毛霉属和根霉属(Rhizopus)正相关,与嗜热子囊菌属负相关;还原糖与曲霉属和嗜热真菌属正相关,与威克汉姆酵母负相关。

表4 微生物因子与理化因子相关性Table 4 Correlations between microbes in Daqu and its physicochemical parameters
从微生物和理化的相关性分析可以看出(表4),乳杆菌属含量与酸度呈正比,与液化力、糖化力和酯化力等呈反比,这说明大曲中的乳杆菌属含量过高会导致大曲的酸度增加,而发酵性能下降,大曲的香味有酸臭,导致大曲的质量下降;Kroppenstedtia的菌落呈现白色,其含量与液化力和酯化力呈正比,与酸度呈反比,先前的研究报道该类对大曲生香有一定作用,能够提升曲的性能;根毛霉属能够提升大曲的糖化能力,嗜热真菌属能提升大曲的液化能力,这些菌株均有利于提升曲的发酵性能。通过对大曲中的微生物和理化进行相关性分析,可以找到大曲中优势微生物和理化的关系,结合传统感官对大曲的认识,能够找到感官指标与微生物形态呈现的关系,如果通过进一步研究,将个别优势微生物作为大曲评判的指标,结合原有评价体系,能够形成一套对大曲更加合理的评价标准。
3 结 论
本研究利用高通量测序技术,从分类学角度系统研究了陶融型大曲中细菌和真菌的多样性,确定了陶融型大曲中主要微生物的菌落构成。结果表明,大曲中共检测到细菌OTU数为83,真菌OTU数为34,细菌的物种多样性远高于真菌。大曲微生物相对丰度统计表明,在细菌多样性中,大曲的优势菌属主要为乳杆菌属、魏斯氏菌属、泛菌属、明串珠菌属四大类,4 种菌属共占大曲细菌多样性的75.40%,同时还检测到了Kroppenstedtia、糖多孢菌属、片球菌属、芽孢杆菌属等优势菌属;在真菌多样性中,大曲的优势菌属主要为unidentified、嗜热真菌属、嗜热子囊菌属三大类,3 种菌属共占大曲真菌多样性的96.74%,同时还检测到了曲霉属、根霉属、威克汉姆酵母属、哈萨克斯坦酵母属等。
大曲生产过程复杂,在开放的制曲环境中,原料、器具、空气、水等均是大曲微生物的主要来源。陶融型大曲以陶屋为发酵容器,独特的制曲工艺及独有的地域菌群环境形成了陶融型大曲特有的菌落构成。因此,对陶融型大曲进行系统研究,将有助于解析出陶融型白酒“甜醹柔润”的原因,同时也为今后制定陶融型大曲的质控标准及优化制曲工艺等提供了理论依据。

