明胶与海藻酸钠的静电复合机制及热动力学分析
陈海华,于 芮,王雨生,2,*
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.青岛农业大学学报编辑部,山东 青岛 266109)
蛋白质与多糖是生物体系的主要组成成分,也是食品中的主要营养成分,2 种大分子常同时存在于食品体系中,是食品品质特性的主要贡献者,其相互作用可以影响食品的质构性质、流变性质及结构和稳定性等[1]。近年来,生物大分子间复合凝聚过程的研究逐渐成为热点,利用大分子间的相互作用可以制备新型生物材料,用于食品智能包装、界面稳定、脂肪替代等[2-3],或者制备纳米颗粒、微胶囊等[4]。因此,阐明蛋白和多糖之间的相互作用机制、影响因素,研究并掌控两者的反应条件、进程,对改善食品品质及微观结构、开发新食品原料和加工方法都有非常重要的意义。
明胶(gelatin,GEL)是从动物皮肤、骨、肌膜等组织中提取的,具有与蛋白质大分子相类似的特性,常温下呈三股螺旋结构,被公认为一种营养价值较高的亲水胶体[5],已有较多研究将GEL与多糖如阿拉伯胶[3]、壳聚糖[6]等相互作用制备微胶囊、膜等新材料,可被广泛用作乳制品、糖果、冷冻食品等的添加剂。海藻酸钠(sodium alginate,AG)是一种安全的天然阴离子线性多糖,1938年已被收入美国药典,被广泛应用于食品、制药和化妆品行业[7]。AG与多糖间存在广泛的相互作用,刘欢等[8]利用羧甲基壳聚糖与AG制备了微球以包埋柠檬醛精油;杜雨等[4]则利用大分子多糖的相互作用制备了一种高分子材料——AG/魔芋葡甘聚糖-菊糖纤维膜;研究发现,AG与淀粉间也存在相互作用,可以抑制玉米淀粉的长期老化[9-11]。越来越多的学者已关注到AG与蛋白之间的相互作用,赵磊等[12]利用大豆分离蛋白与AG制备了可包埋番茄红素的新型壁材;董宇豪等[2]利用AG与鱼GEL制备了一种复合可食膜;Razzak等[7]则研究了鱼GEL与AG的相互作用机制。有学者利用GEL与AG制备了一种稳定的pH值敏感型水凝胶,说明GEL与AG具有良好的相容性[5],具有较好的应用前景,但目前研究中,GEL与AG的大分子复合过程较多地进行了加热处理,常温下两者在水溶液中的相互作用研究较少,其复合机制、影响因素及产物需要进一步明确。
因此,本研究配制不同质量浓度和质量比、不同pH值的GEL与AG溶液,在室温下通过浊度滴定、Zeta电位测定、亚甲基蓝(methylene blue,MB)光谱等手段,阐明GEL与AG相互作用基本特征,通过盐离子、尿素的添加进一步研究其作用机制影响因素,并利用等温滴定微量热仪(isothermal titration calorimetry,ITC)对两者结合过程进行热动力学分析,以期揭示常温下水溶液中GEL与AG的相互作用规律,为GEL-AG基生物材料的开发,及其在食品、医药领域的拓展应用提供理论依据。
1 材料与方法
1.1 材料与试剂
GEL(相对分子质量20 000) 天津市北辰方正试剂厂;AG(相对分子质量82 500) 青岛明月海藻有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
MicroCal PEAQ-ITC等温滴定微量热仪(isothermal titration calorimetry,ITC) 英国马尔文仪器有限公司;UV2000紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;ZEN 3690动态光散射仪 英国马尔文仪器有限公司;HJ-6多头磁力加热搅拌器 常州国华电器有限公司。
1.3 方法
1.3.1 GEL-AG体系制备
用分析天平准确称取适量GEL粉末溶于去离子水中,配制1 g/L的GEL溶液,55 ℃、1 000 r/min磁力搅拌5 h后,置于4 ℃冰箱中过夜,使蛋白质分子完全水化,待用。准确称取适量AG粉末溶于去离子水,配制1 g/L的AG溶液,1 000 r/min室温磁力搅拌过夜,待用。分别向GEL和AG溶液中加入0.2 g/L的叠氮化钠,防止细菌生长。根据目标浓度分别量取一定体积GEL溶液和AG溶液并混合,室温、1 000 r/min磁力搅拌1 h,得到宏观均匀溶液。
固定体系总质量浓度CT=1 g/L,改变GEL与AG的质量比r(10∶0、9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9、0∶10),探究r对GEL和AG分子相互作用的影响。
固定体系r=7∶3,分别改变CT(0.25、0.5、1、2 g/L)、添加适量NaCl(0、0.02、0.05、0.10、0.20 mol/L)、添加适量尿素(200 mol/L),依次探究CT、离子强度、非静电相互作用对GEL和AG分子结合过程的影响。
1.3.2 浊度滴定
参考Razzak等[13]的方法并稍作修改。使用紫外-可见分光光度计测定体系浊度,测定波长为600 nm,比色皿厚度为1 cm,同时使用pH计对体系的pH值进行跟踪。用去离子水将分光光度计的透光率(T)校准为100%,样品的浊度(%)表示为1-T。先用NaOH调节溶液的pH值至7.0±0.2,然后用HCl溶液对体系由中性向酸性进行滴定。体系pH值每变化0.1~0.2,取样测定其浊度,同时记录对应的pH值。为保证整个体系混合均匀,滴定过程在磁力搅拌器上进行。测定浊度前,所取样品进行5 s的涡旋处理。
1.3.3 Zeta电位的测定
使用动态光散射仪测定体系的Zeta电位,测定温度为25 ℃。Zeta电位由仪器自带软件通过Helmholtz-Smoluchowski方程计算,重复3 次,取平均值。
1.3.4 MB法测定可溶性GEL-AG复合物
阳离子染料MB与多糖存在静电相互作用,其水溶液在664 nm和615 nm波长处分别有最大吸收峰和肩峰,MB与多糖的静电相互作用会降低最大峰强度而升高肩峰强度。根据峰强度之比R664/615的变化,可以确定溶液中游离和复合MB浓度的变化[7]。
根据Rousi等[3]的方法并稍作修改。首先,用紫外-可见分光光度计全程扫描5 mg/L的MB溶液,测得MB在664 nm和615 nm波长处峰强度。然后于25 ℃制备MB-AG体系,含MB 5 mg/L,但含AG质量浓度不同(0.1~6.0 g/L),分别测定不同AG质量浓度MB-AG体系的R664/615,以确定R664/615最小时(此时MB-AG复合物含量最高)的AG浓度。配制该质量浓度的AG溶液,添加MB质量浓度为5 mg/L,并添加不同质量浓度(0~3.0 g/L)GEL溶液,制备一系列MB-GEL-AG混合液,调整混合液pH值分别为6.0和8.0,测量混合液R664/615。
1.3.5 等温滴定微量热分析
根据Lan等[14]的方法并稍作修改。首先按照1.3.1节方法分别制备GEL(10.0 g/L)与AG(0.33 g/L)溶液,AG溶液中同时添加NaCl浓度分别为0、0.02、0.05、0.10、0.20 mol/L。GEL和AG溶液分别置于ITC的40 μL注射针和200 μL反应池内,设置温度为25 ℃,连续向AG溶液中注射19 次GEL溶液,其中第1次注射0.5 μL,并将其从最终结果中扣除,之后每次注射1 μL,每次注射持续2 s,间隔100 s,搅拌速率为500 r/min。采用“单点结合”模型对数据拟合,计算物质的量比N、结合常数K、反应过程的焓变ΔH和熵变ΔS,采用方程ΔG=ΔH-TΔS计算吉布斯自由能的变化ΔG。
1.4 统计分析
2 结果与分析
2.1 环境pH值及GEL与AG质量比r对其相互作用的影响
如图1a所示,溶液pH值从6.0降至3.5过程中,纯GEL溶液或纯AG溶液均保持澄清,浊度接近于0;当pH值低于3.5时,浊度略有升高。这可能是由于酸诱导GEL蛋白质产生聚沉,以及低pH值条件下AG分子被质子化或电荷中和而发生聚集[15]。
蛋白质与多糖体系的浊度受pH值及r值影响很大。图1a中,GEL和AG按不同质量比混合后,pH值从6.0降至5.0过程中,体系均保持澄清,浊度接近于0;当pH值降至pHc时,浊度开始升高,说明带正电的GEL分子与带负电的AG分子开始相互结合,形成不溶性复合物[7,16];继续降低pH值至pHopt时,体系中出现大量肉眼可见聚集体颗粒,此时体系浊度最大,说明GEL与AG在pHopt条件下发生了强烈的相互作用,形成了GEL-AG静电复合物[14];溶液pH值低于pHopt后,聚集体快速沉淀,继续降低pH值,体系变得澄清,浊度迅速降低。比较图1a中不同r的浊度曲线可以看出,r=7∶3的体系pHopt较高,在pH 4.5时浊度开始升高,pH值在2.5~3.5范围内,体系均保持较高的浊度,此时pH值的改变对GEL-AG复合物沉降的影响相对较小,利于形成稳定的悬浊液而进行Zeta电位测试等实验,是最合适的配比。对于r=8∶2或r=9∶1的体系,虽然在pHopt时浊度很高,但继续降低pH值后,浊度下降过快,在pH值低于3.0时溶液已澄清;而r=3∶7的体系,pH值降低过程中,体系浊度逐渐增大,但没有快速沉淀过程,无对应的pHopt。
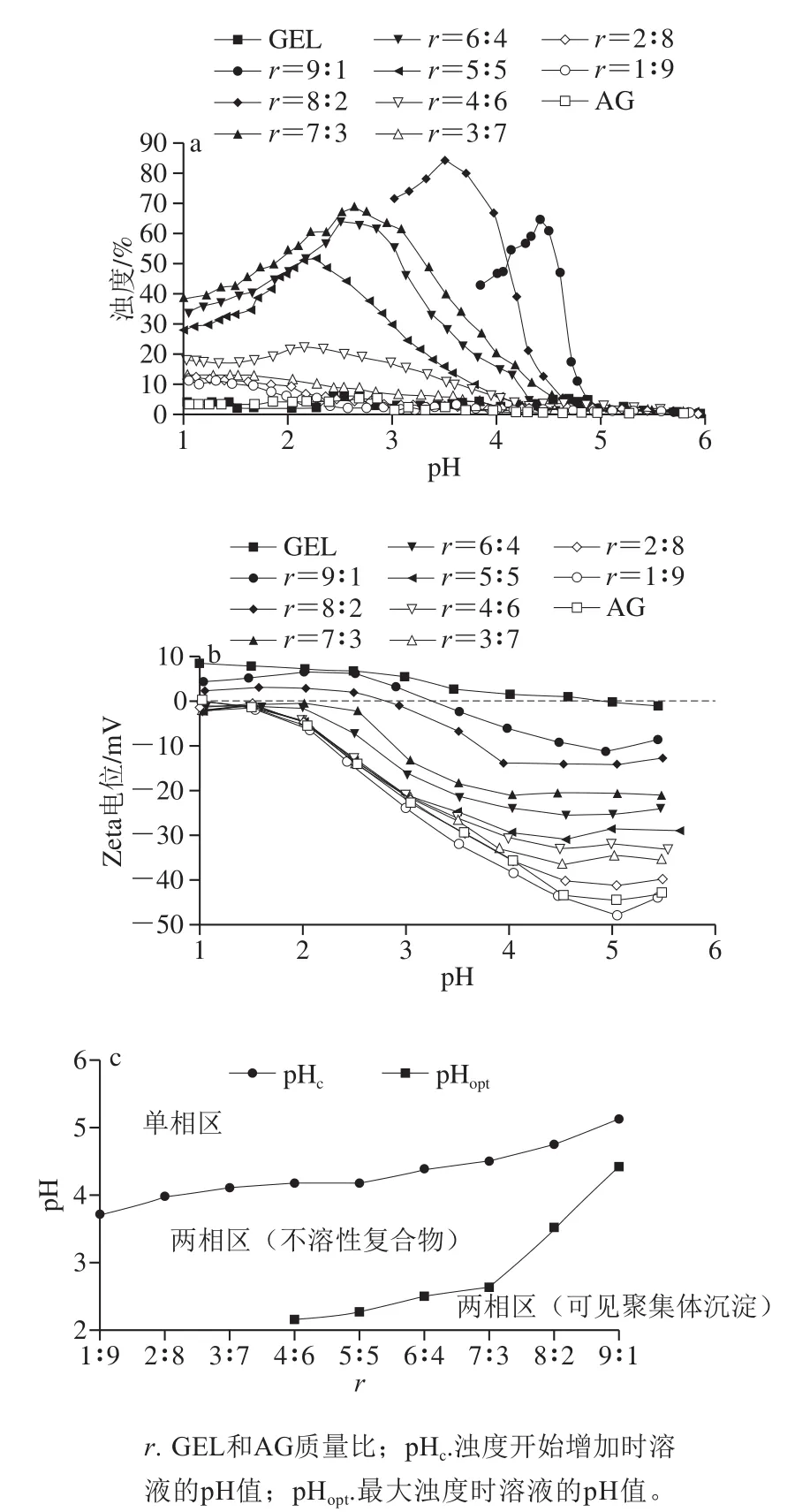
图1 GEL-AG体系的浊度(a)、Zeta电位(b)及状态图(c)Fig. 1 Turbidity (a), zeta potential (b), and phase diagram (c) of GEL-AG system
Zeta电位可反映粒子表面电荷量,电荷量较大(Zeta电位绝对值较大)时,溶液中同种粒子间表现为较强的静电斥力,形成均匀溶液而不聚沉;电荷量较小,Zeta电位趋向于等电点时,粒子容易聚集。由图1b可知,随着pH值的降低,纯GEL溶液的Zeta电位从-1.08 mV增加到8.44 mV,GEL分子上的羧基逐渐被质子化而带正电荷。当pH 4.92时,纯GEL溶液的Zeta电位为0(GEL的等电点),pH值低于4.92时,GEL带正电荷,这与Yang Yadong等[16]报道的结果一致。随着pH值的降低,纯AG溶液的Zeta电位从-43.06 mV增加到-1.51 mV,说明AG分子在pH值变化过程中始终具有很强的电负性,这一趋势与Razzak等[7]的研究结果一致,甘露糖残基和古洛糖酸残基的存在使AG呈现较强的电负性。
对于GEL和AG按照不同质量比配制的体系,在相同pH值条件下,其Zeta电位介于纯GEL溶液与纯AG溶液之间,且随着r的升高而升高(图1b),这可能是GEL与AG分子间的电荷补偿效应所致,说明GEL与AG在水溶液中的结合与静电吸引有关。此外,对于r>7∶3的GEL-AG体系,在低pH值条件下,其Zeta电位为正,说明体系中存在过量的带正电荷的GEL分子,未能与AG分子结合。GEL-AG体系浊度和Zeta电位随pH值的变化趋势与相反电荷离子的静电相互作用规律相似,因此GEL与AG分子间以静电相互作用为主[17]。
根据图1a中GEL与AG质量比r及体系pHc、pHopt绘制了体系状态图1c。由图1a、c可知,对于r<4∶6的体系,降低pH值,浊度没有明显变化,浊度曲线均未出现明显拐点,即始终不能生成大量GEL-AG静电复合物。随着r的升高,体系的pHc和pHopt均显著升高,r=9∶1时,pHopt升高至4.42。这表明,提高体系中GEL的比例,便可以在较高pH值条件下获得GEL-AG静电复合物[13]。这主要是由于r的升高提供了更多的可与AG作用的电正性GEL分子,促进了GEL-AG不溶性复合物的形成,从而在较高pH值下形成浊度曲线的拐点[7]。
根据体系状态,图1c可分为3 个区域,分别为单相区、不溶性复合物区和可见聚集体沉淀区。在单相区,溶液的pH值位于pHc和5.5之间,体系透明,主要由单分子GEL、AG和可溶性GEL-AG复合物组成。在该pH值条件下,GEL的去质子化作用较弱[14,18],难以与AG通过静电引力形成不溶性复合物。溶液的pH值在pHopt和pHc之间时,GEL因pH值的降低而带有更多正电荷,GEL与AG的静电相互作用强烈,迅速形成大量不溶性复合物。根据图1b,此时GEL-AG复合物间存在较强的电荷排斥作用,电荷斥力使GEL-AG能稳定于溶液中,浑浊而不沉淀,因此浊度迅速升高。对于溶液pH低于pHopt的区域,根据图1b,GEL-AG复合物Zeta电位绝对值接近于0,互相排斥作用大幅降低[14],不溶性复合物快速聚集产生大量沉淀,体系迅速澄清,浊度降低。这可能是由于阴离子多糖AG骨架坚硬,电荷密度高,与带正电荷的GEL相互作用强烈,产生大量抗衡离子,导致GEL-AG复合物去溶剂化,形成宏观相分离并沉淀。据报道,GEL与阿拉伯胶[3]、豌豆蛋白与甜菜果胶[14]、牛奶蛋白与黄芪胶/波斯胶[19]等蛋白质-多糖体系在低于pHopt时也会产生大量沉淀。
2.2 GEL和AG总质量浓度CT对其相互作用的影响
蛋白质-多糖体系中,2 种大分子因静电而相互作用,但只有当CT达到一定程度时,两者才可能通过静电引力形成复合物[13]。图2为不同CT的GEL-AG体系(r=7∶3)在酸滴定过程中的浊度,体系的pHc、pHopt见表1。由图2可知,在相同pH值条件下,CT越高,体系浊度越大,这可能是因为提高CT后,GEL和AG分子质量浓度升高,大分子间相互作用机会增多,生成更多的GEL-AG不溶性静电复合物[7]。由表1可知,提高CT,体系的pHc和pHopt均升高,CT从0.25 g/L提高至2.00 g/L时,pHc从3.5上升到5.2,pHopt从2.4上升到3.3。这表明提高CT,体系可以在较高的pH值条件下生成不溶性静电复合物。Razzak等[7]也有相似的报道。而CT较低时,GEL需要依靠低pH值环境产生更多正电荷以增强GEL与AG分子间相互作用,才能形成复合物或沉淀。Sarika等[20]在研究GEL与阿拉伯胶静电复合时发现,提高CT可以提高体系的pHc。

图2 酸滴定过程中不同CT的 GEL-AG体系溶液的浊度(r=7∶3)Fig. 2 Turbidity of GEL-AG system at different CT during acid titration (GEL-to-AG ratio = 7:3)
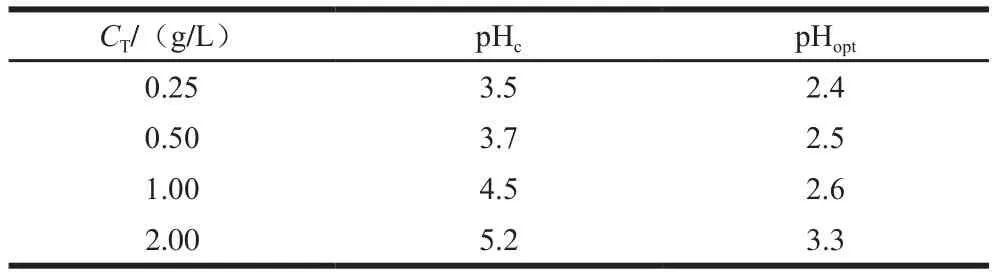
表1 不同CT的GEL-AG体系溶液的pHc和pHoptTable 1 pHc and pHoptof GEL-AG system at different CT
2.3 盐离子和尿素对GEL与AG相互作用的影响
根据图3和表2,NaCl浓度对GEL-AG体系的浊度有明显的影响。未添加NaCl时,体系的最大浊度为69.3%,添加0.02 mol/L的NaCl并没有明显改变体系的最大浊度,但体系的pHc和pHopt明显升高。NaCl浓度大于0.02 mol/L时,随着NaCl浓度的升高,体系的最大浊度显著降低,pHc和pHopt也随之降低。NaCl浓度达到0.20 mol/L时,体系浊度很低,降低pH值对GEL-AG体系浊度影响并不显著,不能形成对应的pHc和pHopt。NaCl对蛋白-多糖体系的影响趋势与已有研究结果一致[21]。这说明适当浓度的NaCl(<0.02 mol/L)可以促进GEL与AG作用,有利于在较高pH值环境下形成GEL-AG静电复合物,而过高浓度的NaCl(>0.02 mol/L)则抑制GEL-AG静电复合物的形成。这可能是由于GEL大分子同时含有正电基团和负电基团,加入的盐离子较少时,GEL大分子的部分负电基团被Na+屏蔽,德拜长度减小,导致GEL负电基团与AG分子间的长程排斥力减弱[22],表现为GEL正电基团与AG的相互吸引作用加强,有助于不溶性复合物的形成。然而,随着NaCl浓度的继续升高,盐离子对GEL正负基团均产生屏蔽作用,生物大分子德拜长度进一步减小,导致GEL与AG分子间的短程吸引也被屏蔽[20,23],难以通过静电吸引形成不溶性复合物。此外,高浓度的盐离子还会引起GEL溶解度降低,也不利于不溶性复合物的形成和聚集。

图3 酸滴定过程中不同NaCl浓度下GEL-AG体系的浊度Fig. 3 Turbidity of GEL-AG system at different NaCl concentrations during acid titration

表2 不同NaCl浓度GEL-AG体系的pHc和pHoptTable 2 pHc and pHoptof GEL-AG system at different NaCl concentrations
尿素作为一种具有竞争性的氢键形成剂,能够破坏分子间的氢键和疏水相互作用[13]。本实验参考Razzak等[7]的方法,在体系中添加尿素,考察r=7∶3的GEL-AG体系在酸滴定过程中的浊度变化,以研究氢键、疏水等非静电相互作用对GEL和AG相互作用的影响。如图4所示,添加尿素前后,体系的最大浊度分别为69.3%和71.5%,并未发生明显变化,即尿素对GEL-AG不溶性复合物的形成没有明显影响。这说明GEL和AG分子间的作用力与氢键、疏水等非静电相互作用无关。但添加尿素后,体系浊度曲线向高pH值方向偏移,pHopt从2.6上升到3.2,这可能是因为尿素改变了蛋白质及多糖分子周围的水相结构,增加了疏水性氨基酸的溶解度[24],从而促进了静电作用较早(较高pH值)的发生。
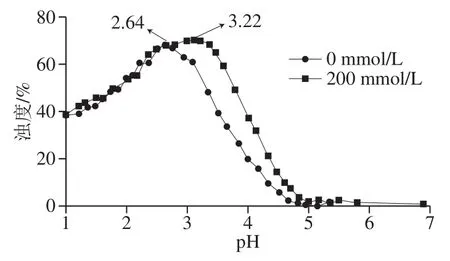
图4 酸滴定过程中尿素对混合溶液浊度的影响Fig. 4 Effect of urea on the turbidity of GEL-AG system during acid titration
2.4 可溶性GEL-AG复合物的测定结果
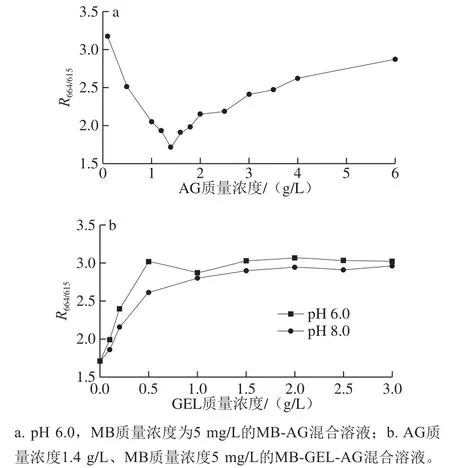
图5 混合溶液在664 nm和615 nm波长处吸光度比Fig. 5 Ratio of absorbance at 664 nm to that at 615 nm of the mixture solutions
由图5a可知,pH值为6.0时,在不同质量浓度的AG溶液中添加5 mg/L的MB溶液,R664/615随着AG质量浓度的升高呈先降低后升高的趋势。R664/615的降低说明MB单体减少[7],这很可能是带正电的MB分子与带负电的AG分子发生了静电相互作用,减少了游离状态的MB。当AG质量浓度为1.4 g/L时,R664/615最小,表明此时MB单体浓度最低,形成的MB-AG静电复合物最多。AG质量浓度超过1.4 g/L时,R664/615上升,这可能是由于过量的AG分子间形成网络结构导致吸光度变化[16]。
图5b中,固定AG质量浓度为1.4 g/L,MB质量浓度为5 mg/L,GEL质量浓度从0 g/L逐渐增加至3.0 g/L。在pH 6.0或pH 8.0的条件下,体系的R664/615均随着GEL质量浓度的增加而迅速升高,当GEL质量浓度超过2.0 g/L时保持稳定。R664/615增加表明体系中游离的MB质量浓度升高,这可能是由于GEL和MB分子存在竞争关系,两者均可与AG分子发生静电相互作用,这种竞争作用迫使MB-AG静电复合物解离为MB分子和AG分子[13],AG与GEL形成GEL-AG静电复合物,导致体系中游离MB浓度升高,吸光度升高。但根据图1a,当pH>5.0时,GEL-AG体系浊度很低,并未生成GEL-AG不溶性复合物,说明该条件下形成了GEL-AG可溶性复合物。根据Zeta电位测定结果(图1b),pH>5.0时,GEL和AG两种大分子均带负电荷,之所以能够形成GEL-AG可溶性复合物,可能是由于GEL分子中带正电基团对AG存在静电吸引作用,将AG分子定位于GEL分子上而形成复合物[19]。Dong Die等[25]也据此解释了pH 5.6时,均呈电负性的大豆蛋白和阿拉伯胶之间存在静电相互作用的现象。Razzak[13]和Yang Yadong[16]等也证实,在高于GEL等电点时,呈电负性的鱼皮GEL可以分别与透明质酸、阿拉伯胶形成可溶性静电复合物。以上分析说明,在高于GEL等电点时,无论在酸性条件(pH 6.0)还是碱性条件(pH 8.0)下,均可形成GEL-AG可溶性复合物。
2.5 等温滴定曲线及热动力学分析
利用等温滴定微量热技术可以直接测定复合物形成过程中的热量变化[14]。将一定质量浓度的GEL溶液每隔一定时间逐滴注射入AG溶液中,通过测定滴定过程中热量的变化探究带相反电荷的GEL与AG分子的相互作用(图6)。图6a中每个峰代表注射1 次后体系的热量变化,带正电荷的GEL分子滴入带负电的AG溶液中,通过静电作用迅速与AG分子结合,能量为负表示结合过程放出一定热量。因此GEL与AG分子的结合是一个放热过程,这有利于体系能量的降低,促进反应的进行。蛋白质与多糖的结合过程较多的表现为放热过程[25]。随着注射的进行,GEL分子含量升高,峰面积逐渐减小,在第11次滴定后变化不再明显,这表明GEL与AG结合反应过程逐渐结束,之后的小稳态峰为注射过程的稀释热引起。
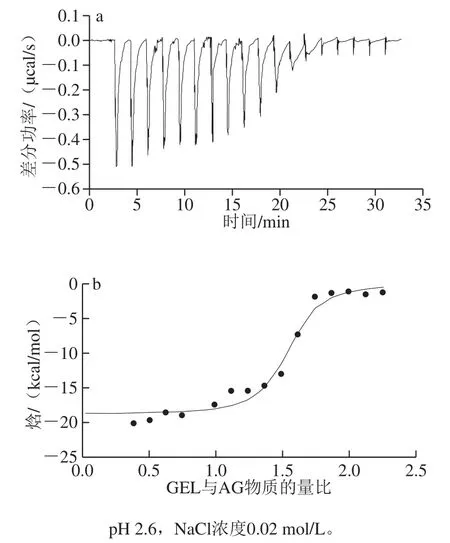
图6 GEL等温滴定AG的ITC热谱线(a)和等温结合曲线(b)Fig. 6 Thermogram (a) and binding isotherm (b) during the titration of AG with GEL
由表3可知,在没有添加NaCl时,GEL与AG物质的量比N=1.22,即每1 mol AG分子结合1.22 mol GEL分子,GEL与AG有很高的结合常数(K=2.39×106L/mol),说明GEL与AG的结合反应强烈,吉布斯自由能减少表明反应可自发进行,焓变ΔH为-18.8 kcal/mol,进一步说明该过程为焓驱动下的放热反应。而熵的减少可能是由于GEL分子的侧链阻碍了GEL与AG的静电作用[26]。

表3 不同离子强度下GEL-AG结合热动力学参数Table 3 Thermodynamic parameters of interactions between GEL and AG at different ionic strengths
由表3可知,加入不同浓度的NaCl,体系吉布斯自由能均减少,说明GEL与AG的结合反应始终可以自发进行。与未添加NaCl的过程相比,NaCl浓度为0.02 mol/L时,N升高至1.63,结合常数K升高至3.03×106L/mol,焓变ΔH由-18.80 kcal/mol变为-21.30 kcal/mol,说明0.02 mol/L的NaCl促进了GEL与AG的结合,结合过程释放了更多的热量。这可能是由于较低的盐离子浓度筛选出更多的结合位点,提高了物质的量比N,从而促进GEL和AG结合[27]。但随着NaCl浓度由0.02 mol/L逐渐升高至0.20 mol/L,N从1.63显著降低至0.24,每1 mol AG分子仅仅结合了0.24 mol GEL分子,结合常数K也显著降低,说明较高的盐离子浓度显著降低了GEL与AG的结合能力。这与浊度滴定实验结果一致。随着NaCl浓度的提高,焓变ΔH和熵变ΔS逐渐由负转正,说明结合过程由放热逐渐转变为吸热,体系的熵逐渐升高,即结合过程逐渐由焓驱动转变为熵驱动[28]。较高盐离子浓度抑制GEL与AG的结合可能与盐离子的静电屏蔽效应有关,静电屏蔽减少了GEL和AG的结合位点[29],限制了GEL与AG的静电作用。Xiong Wenfei等[27]报道,0.4 mol/L的盐离子可以抑制卵白蛋白和羧甲基纤维素间的静电引力和反向离子释放。另外,较高的NaCl浓度会引起蛋白质构象自由度的变化,促进了氢键的作用,从而引起熵增加[30],导致结合过程逐渐转变为熵驱动。
3 结 论
通过浊度滴定、ITC滴定、Zeta电位测定等实验,研究了常温下GEL与AG的相互作用影响因素及作用机制,探明了如下几条作用规律:1)GEL与AG的结合以静电相互作用为主,氢键和疏水相互作用较弱。结合过程是焓驱动自发进行的放热过程,结合常数很大,结合能力很强。2)NaCl的加入对两者的相互作用影响明显,NaCl浓度低于0.02 mol/L时,促进静电复合物的形成;NaCl浓度高于0.02 mol/L时,限制了GEL与AG的静电作用;继续提高NaCl浓度,结合过程逐渐由放热转变为吸热。3)提高GEL和AG质量比r或总质量浓度CT,或者降低环境pH值,均可显著促进两者的相互作用,形成不溶性复合物,但较高pH值下易形成可溶性复合物。r=7∶3的体系具有较高的pHopt,可形成较为稳定的复合物悬浊液。本研究所得规律可为新型GEL-AG基生物材料的开发及其在食品、医药等领域应用提供理论依据。

