miR-1292-5p对肝癌SNU-449细胞自噬与增殖及细胞周期影响
江卓,唐杰,刘彩林,于永敏,高岭
(1 郑州市第六人民医院检验科,河南 郑州 450000; 2 郑州大学第一附属医院检验科)
肝癌是世界范围内常见的恶性肿瘤,肝癌治疗虽取得明显进步,但病人生活质量仍然较差[1]。研究发现,肝癌恶性进展与基因差异表达有关,这些基因参与调控肝癌细胞的生物学行为,可成为肿瘤治疗的潜在分子靶点[2]。因此,研究影响肝癌进展的分子机制可为靶向治疗提供分子靶点。miRNA可影响肿瘤进展,认为调控miRNA表达可能是有效抑制肿瘤恶性发生发展的途径之一[3-4]。研究发现miR-1292-5p在胃癌中低表达,上调miR-1292-5p可抑制胃癌细胞恶性生长,表明miR-1292-5p可能是一种肿瘤抑制因子[5]。然而,miR-1292-5p在肝癌中作用及机制尚未见报道。Akt/PI3K信号通路与多种肿瘤进展有关,Akt/PI3K信号通路过度激活可影响肿瘤细胞的恶性表型[6-8]。本次实验首先探讨miR-1292-5p在肝癌细胞和正常肝细胞中的表达差异,然后首次研究上调miR-1292-5p对肝癌细胞增殖、自噬、周期和凋亡等影响,为靶向基因治疗肝癌提供可能方向。
1 材料与方法
1.1 实验材料
肝癌HuH7、HCC9204和SNU-449细胞均购自广州赛库生物技术有限公司;正常肝L-02细胞购自通派(上海)生物科技有限公司;C-Caspase-3抗体、Beclin1抗体均购自Cell Signaling Technology;miRNA第一链cDNA合成试剂盒、SYBR Premix Ex Taq miRNA kit购自大连TAKARA;p-Akt抗体、p-PI3K抗体和Cyclin D1抗体购自美国BD公司;miR-1292-5p mimics、mimics control购自北京科忠智生物技术开发有限公司;ATG5抗体、PI3K抗体和P21抗体购自上海碧云天生物技术有限公司;Akt抗体购自美国Abcam。
1.2 实验方法
1.2.1实时荧光定量PCR(qRT-PCR)检测肝癌细胞中miR-1292-5p表达 在肝癌HuH7、HCC9204、SNU-449细胞和正常肝L-02细胞中添加Trizol试剂,分别提取各组细胞总RNA,以无RNA酶水将RNA溶解,以-20 ℃保存备用。以miRNA第一链cDNA合成试剂盒反转录,体系含有:10 μL的2×miRNA L-RT Solution mix、200 ng的miRNA、1.5 μL的miRNA L-RT Enzyme mix以及1 μL的Stem-loop primer,最后添加RNase-free water至20 μL。混合后,放在16 ℃温浴30 min,37 ℃温浴30 min,85 ℃反应5 min,cDNA以-20 ℃保存备用。用SYBR Premix Ex Taq miRNA kit进行实时定量PCR,PCR体系中含有:1 μL的 Forward Primer、1 μL的Reverse Primer、12.5 μL的SYBR Premix Ex TaqⅡ、1 μL的cDNA,最后添加ddH2O至25 μL。PCR的反应程序设置为:95 ℃、30 s,95 ℃、5 s,60 ℃、30 s,55 ℃、30 s,共45个循环。内参照为U6,按照2-△△Ct法计算miR-1292-5p表达变化。引物序列见表1。
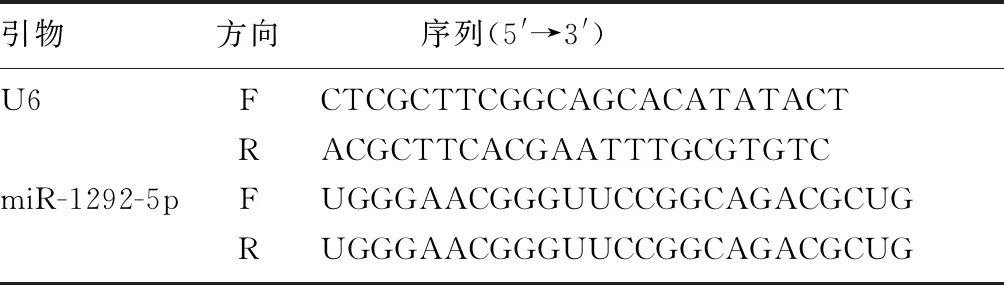
表1 PCR扩增所用引物及其序列
1.2.2细胞分组及处理 在肝癌SNU-449细胞中分别转染miR-1292-5p mimics、mimics control,记为miR-1292-5p组和miR-NC组,细胞转染步骤参照转染试剂Lipofectamine 2000说明书进行。把没有转染的细胞设置为Control组。Control(A组)、miR-NC(B组)、miR-1292-5p(C组)细胞培养48 h之后,按照1.2.1中qRT-PCR方法测定miR-1292-5p表达。
1.2.3CCK-8测定细胞增殖 Control、miR-NC、miR-1292-5p组细胞培养48 h后,每孔分别加入15 μL的CCK-8,于37 ℃条件下结合4 h。检测490 nm波长处每个孔的OD值,以Control组细胞存活率为100%,分析miR-NC、miR-1292-5p组细胞存活率变化。
1.2.4PI单染法测定细胞周期 Control、miR-NC、miR-1292-5p组细胞培养48 h之后,加入4 ℃预冷后的PBS液洗涤2次。在细胞内加入体积分数0.75的乙醇,将细胞固定1 h。以9 400 r/min离心10 min,弃上清溶液,再添加PBS溶液重悬,加入PI染液混合,上流式细胞仪测定细胞周期。
1.2.5Annexin V-FITC/PI双染法测定细胞凋亡Control、miR-NC、miR-1292-5p组细胞培养48 h之后,收集各组细胞用冰预冷后的PBS溶液悬浮2次,最后将细胞悬浮在500 μL的Binding Buffer溶液中,再添加10 μL的PI以及Annexin V-FITC,在室温中孵育结合15 min,用流式细胞仪检测细胞凋亡变化。
1.2.6蛋白质印迹方法测定C-Caspase-3、Beclin1、ATG5、P21、Cyclin D1、p-Akt、Akt、PI3K、p-PI3K蛋白表达 Control、miR-NC、miR-1292-5p组细胞培养48 h之后,收集细胞,加入细胞裂解溶液,提取总蛋白,按照BCA方法检测蛋白浓度。在蛋白内加入1/4体积的5×Loading Buffer溶液,于100 ℃反应5 min。分别制备100 g/L的分离胶及体积分数0.05的浓缩胶,每个泳道内加入30 μg的蛋白样品,浓缩胶内电压为80 V,分离胶内电压为120 V,等到溴酚蓝染料点样到分离胶的底部以后,终止电泳。将分离胶切下,在4 ℃条件下以170 mA的电流转膜。电转以后的PVDF膜放在制备好的封闭液(其中含有体积分数0.05的牛血清清蛋白)内,在室温环境中结合1 h,然后将PVDF膜放在稀释以后的一抗孵育液内,于4 ℃条件下过夜,然后将PVDF膜放在二抗稀释液中,在室温中结合1 h。以ECL方法发光,Image Lab分析条带的OD值,以β-actin作为参照,分析目的蛋白表达水平。二抗按照1∶4 000稀释,C-Caspase-3、Beclin1、ATG5、P21、Cyclin D1、p-Akt、Akt、PI3K、p-PI3K等一抗分别按照1∶400、1∶800、1∶800、1∶1 000、1∶1 000、1∶600、1∶1 000、1∶1 000、1∶600稀释。
1.2.7Akt/PI3K信号激活剂对上调miR-1292-5p的肝癌细胞增殖、周期、凋亡和自噬影响检测 取转染miR-1292-5p mimics后的肝癌SNU-449细胞,用含有Akt/PI3K信号激活剂IGF-1(50 μg/L)的细胞培养液处理培养,记为miR-1292-5p+IGF-1组(D组),以miR-1292-5p组为对照(C组),以CCK-8方法检测细胞增殖(步骤同1.2.3),PI单染法检测细胞周期(步骤同1.2.4),Annexin V-FITC/PI双染法检测细胞凋亡(步骤同1.2.5),蛋白质印迹检测C-Caspase-3、Beclin1、ATG5、P21、Cyclin D1、p-Akt、Akt、PI3K、p-PI3K蛋白表达(步骤同1.2.6)。
1.3 统计学分析

2 结 果
2.1 miR-1292-5p在肝癌细胞中的表达
L-02、HuH7、HCC9204、SNU-449细胞中miR-1292-5p表达量分别为1.00±0.11、0.36±0.02、0.47±0.05和0.20±0.04,肝癌HuH7、HCC9204、SNU-449细胞中miR-1292-5p表达水平低于正常肝L-02细胞(F=260.440,q=13.159~20.505,P<0.05);肝癌SNU-449细胞中miR-1292-5p表达水平低于肝癌HuH7、HCC9204细胞(q=10.733、12.650,P<0.05)。选用表达水平最低的 SNU-449细胞进行后续实验。
2.2 miR-1292-5p上调对肝癌SUN-449细胞生物学行为影响
结果表明,与miR-NC组比,miR-1292-5p组肝癌SNU-449细胞中miR-1292-5p表达水平升高,细胞存活率降低,G0/G1期比例升高,细胞凋亡率升高,C-Caspase-3、P21蛋白表达水平均升高,Cyclin D1、Beclin1、ATG5蛋白表达水平明显降低(F=27.553~611.793,q=7.116~24.042,P<0.05)。miR-1292-5p mimics可上调肝癌SNU-449细胞中miR-1292-5p表达水平,抑制其细胞增殖和自噬,阻滞细胞周期,诱导细胞凋亡。见图1和表2。
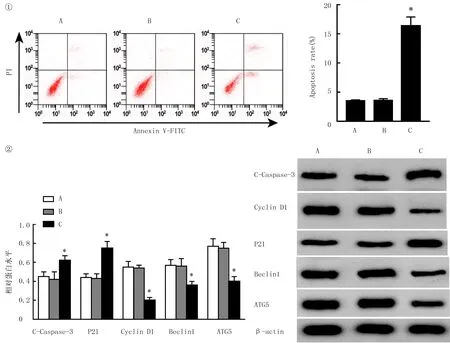
①流式细胞术检测细胞凋亡;②Western blot检测C-Caspase-3、Beclin1、ATG5、P21、Cyclin D1蛋白表达。A:Control组,B:miR-NC组,C:miR-1292-5p组。
表2 miR-1292-5p上调对肝癌细胞生物学行为和相关蛋白水平影响
2.3 miR-1292-5p上调对肝癌细胞中Akt/PI3K信号通路相关蛋白影响
结果表明,与miR-NC组比,miR-1292-5p组肝癌SNU-449细胞中p-Akt、p-PI3K蛋白表达水平降低(F=42.043、60.545,q=10.307、7.603,P<0.05)。提示miR-1292-5p mimics可以抑制肝癌SNU-449细胞中Akt/PI3K信号通路激活。见图2。
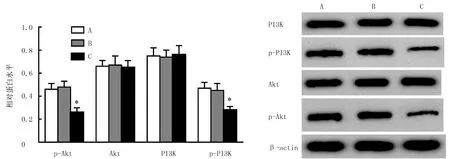
A:Control组,B:miR-NC组,C:miR-1292-5p组。
2.4 Akt/PI3K信号通路激活剂逆转上调miR-1292-5p对肝癌细胞生物学行为和相关蛋白影响
结果表明,与miR-1292-5p组比较,miR-1292-5p+IGF-1组肝癌SNU-449细胞存活率升高,G0/G1期细胞比例、凋亡率、细胞中C-Caspase-3与P21蛋白表达水平均降低,Beclin1、ATG5、Cyclin D1、p-Akt、p-PI3K蛋白表达水平升高,差异均有显著性(t=5.154~15.949,P<0.05)。提示Akt/PI3K信号通路激活剂可以逆转上调miR-1292-5p对肝癌SNU-449细胞增殖、自噬的抑制作用,促进细胞周期进展,抑制细胞凋亡。见图3和表3。
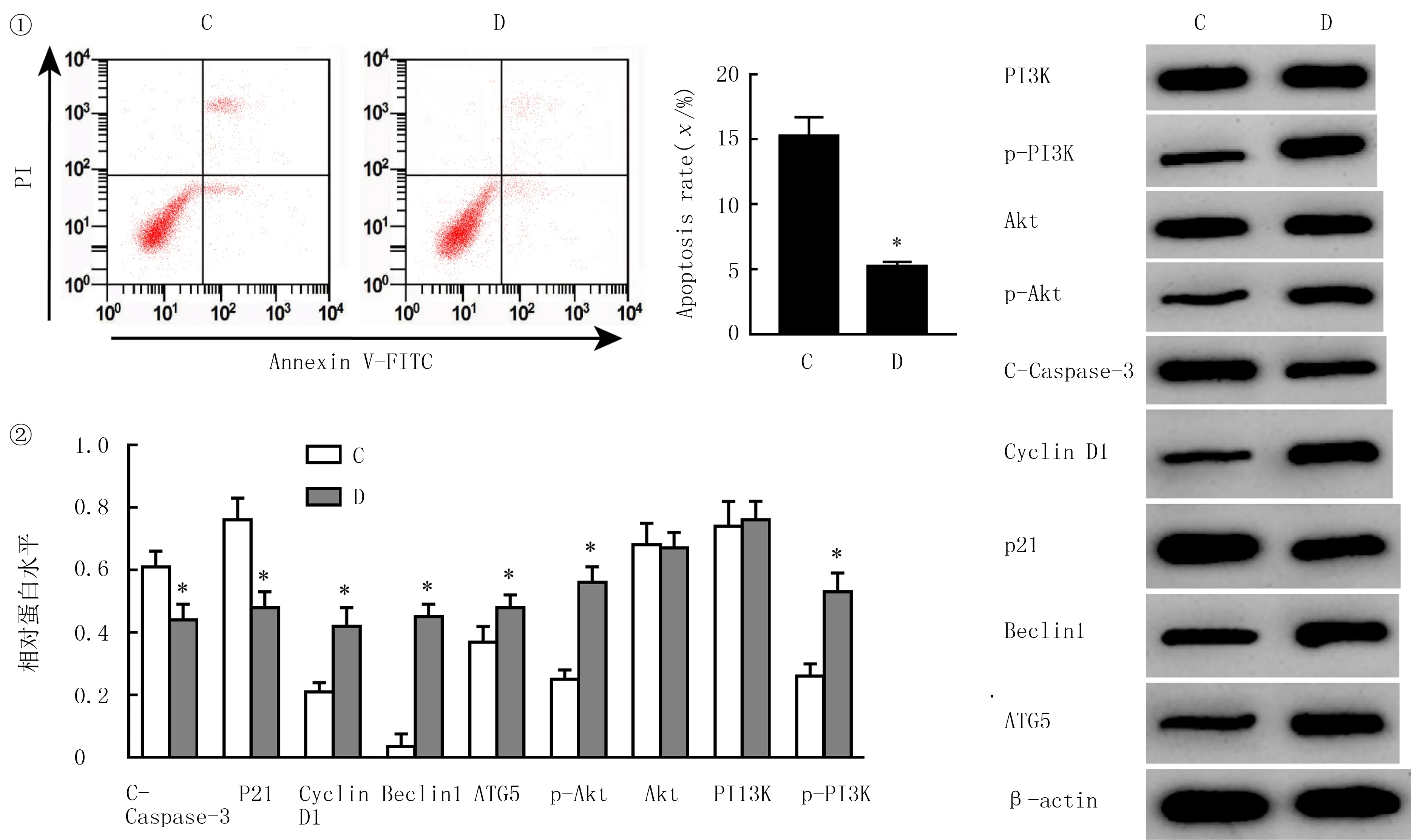
①流式细胞术检测细胞凋亡;②Western blot检测C-Caspase-3、Beclin1、ATG5、P21、Cyclin D1、p-Akt、Akt、PI3K、p-PI3K蛋白表达。C:miR-1292-5p组,D:miR-1292-5p+IGF-1组。
表3 Akt/PI3K信号通路激活剂逆转上调miR-1292-5p对肝癌细胞生物学行为影响
3 讨 论
miRNA已成为生命科学研究的重点和热点,miRNA参与调控多种疾病进展,可能成为疾病治疗的分子靶点[9-12]。miRNA表达改变与肿瘤细胞恶性程度有关,通过人为改变miRNA的表达能够改变肿瘤细胞的恶性表型[13]。已有研究表明,miR-1292-5p在胃癌中发挥类似抑癌基因作用[5]。本文结果显示,肝癌细胞中miR-1292-5p表达水平低于正常肝细胞,并且上调miR-1292-5p可降低肝癌细胞增殖能力,提示miR-1292-5p在肝癌进展中可能发挥抑癌作用,与其在胃癌中的结果相一致。
本实验结果还表明,上调miR-1292-5p后的肝癌细胞G0/G1期比例升高,细胞凋亡率升高,说明上调miR-1292-5p可阻滞肝癌细胞周期并诱导细胞凋亡。细胞周期分为分裂期和分裂间期,G0/G1期是细胞分裂间期中的关键调控点,其受到多种蛋白的作用[14]。Cyclin D1促进细胞从G1期向S期进展,Cyclin D1表达上调促进细胞周期进展[15]。P21是细胞周期的抑制因子,P21表达上调能够阻滞细胞周期[16]。Caspase蛋白家族是细胞凋亡的重要调节因子,Caspase-3是Caspase蛋白家族成员,位于细胞凋亡的下游,Caspase-3被活化后形成C-Caspase-3可不可逆地诱导细胞凋亡发生[17]。本实验表明,上调miR-1292-5p后的肝癌细胞中C-Caspase-3、P21表达上调,而Cyclin D1表达下调,提示上调miR-1292-5p可诱导肝癌细胞凋亡,阻滞细胞周期进展,这与细胞周期和凋亡检测结果一致。
细胞自噬是机体内环境稳态维持的重要途径。肿瘤进展与细胞自噬的关系目前还不十分明确,且存在较大争议,一部分人认为,自噬可以延缓肿瘤细胞凋亡;还有一部分人认为自噬能够诱导肿瘤细胞死亡[18]。Beclin1、ATG5均为自噬标志蛋白,其表达水平升高表明细胞自噬水平升高[19]。本实验结果显示,上调miR-1292-5p后的肝癌细胞Beclin1、ATG5蛋白表达水平明显降低,提示上调miR-1292-5p能够抑制肝癌细胞自噬。
Akt/PI3K是一个具有多种功能的信号转导通路,其参与调控肿瘤细胞增殖以及凋亡[20]。Akt/PI3K信号在自噬中的作用研究较多,但结果存在分歧[21]。有研究发现,IL-37通过抑制Akt/PI3K信号诱导肝癌细胞自噬[22]。而下调lncRNA HAGLROS通过抑制Akt/PI3K信号通路降低肝癌细胞自噬水平[22]。本实验结果显示,上调miR-1292-5p后的肝癌细胞中Akt/PI3K信号通路激活水平下降,并且Akt/PI3K信号激活剂可以逆转上调miR-1292-5p对肝癌细胞增殖和自噬抑制作用、凋亡抑制作用和周期阻滞作用,这说明上调miR-1292-5p可能通过抑制Akt/PI3K信号通路抑制肝癌细胞自噬。已有研究发现,miR-1292-5p抑制胃癌细胞生长与靶向调控DEK基因表达有关[5]。因此,我们推测,miR-1292-5p可能是通过靶向调控DEK的表达影响Akt/PI3K通路的激活。
综上所述,miR-1292-5p在肝癌中可能发挥抑制作用,其能够抑制肝癌细胞自噬、增殖,阻滞细胞周期,诱导细胞凋亡,机制可能与下调Akt/PI3K信号通路激活水平有关。本实验没有分析miR-1292-5p在肝癌组织中的表达及其表达改变与肝癌病人临床病理特征之间的关系,尚未对miR-1292-5p通过何种靶向机制影响Akt/PI3K通路进行详细探讨,以后会对上述部分进行深入探讨和补充。

