FER术联合UAB或UAE预处理治疗子宫瘢痕妊娠疗效及影响因素
邹吴春 刘守福 阳袁莉
四川省资阳市第一人民医院(641300)
剖宫产瘢痕部位妊娠(CSP)限于妊娠≤12周[1]。因为CSP可能导致难以控制的手术大出血、子宫破裂,严重者不得已采取子宫全切,很大程度地威胁了妇女的生命安全[2]。目前病灶切除是CSP的最佳治疗方案,但如何处理腹腔镜下病灶大出血成为手术医生难题。子宫动脉栓塞术(UAE)已广泛用于临床CSP的治疗,但对医疗机构设备、术者的要求较高,推广难度相对较大[3]。子宫动脉阻断术(UAB)可用于腹腔镜下子宫切除术,能显著减少术中出血[4]。本研究通过回顾性分析病灶切除修补术(FER)的CSP患者临床资料,比较UAE和UAB预处理效果及在CSP治疗中的临床价值,探讨临床疗效的影响因素,为临床治疗提供一定理论依据。
1 资料与方法
1.1 一般资料
回顾性收集2018年6月-2019年10月在本院诊治的II、III型CSP患者112例临床资料,根据不同手术方式分组。纳入标准:①根据《剖宫产术后子宫瘢痕妊娠诊治专家共识(2016)》明确诊断为II、III型CSP;②手术前均未行激素治疗;③患者及家属对手术均知情同意。排除标准:①合并心肺功能不全、肝肾功障碍等不能耐受手术;②合并恶性肿瘤;③无法明确排除异位妊娠。本研究经本院伦理委员会审批。
1.2 手术方法
所有患者入院后完善术前常规检查,排除手术禁忌。分别为UAE组行PER术联合UAE术;UAB组行FER术联合UAB术,术后两组患者均给予常规抗生素预防感染。①UAB:患者膀胱截石位,全身麻醉,常规消毒铺单。在脐部行一长1cm切口,腹壁打孔后置入腹腔镜,形成气腹,保持压力10~13mmHg,在下腹部两侧各行0.5cm切口,放置手术器械。腹腔镜下常规探查子宫、附件及盆腔。经阴道进去举宫器,以左侧子宫动脉举例,将子宫置于患者身体右侧,在宫底韧带上2cm处分离阔韧带后叶,游离输尿管,切开腹膜,分离至宫旁,使子宫动脉主干游离,使用7号丝线或者电凝结扎阻断子宫动脉血流。对侧子宫动脉处理同上。②UAE:患者平卧,常规消毒铺巾,局部麻醉。使用Seldinger技术行右侧股动脉穿刺,置入5F动脉鞘,选择进入双侧髂内动脉行血管造影,双侧子宫动脉明显增粗,迂曲紊乱。使用微导管分别选择双侧子宫动脉,采用明胶海绵进行栓塞。重复血管造影显示子宫动脉闭塞,未见主干及末梢显影。拔除导管鞘,进行加压包扎,操作结束。③FER:腹腔镜监视下行低压膨宫下探查宫腔,负压吸引宫腔中上段、下段后壁、病灶处的绒毛和蜕膜组织,透光试验再次确认病灶范围,撤腔镜后上台举宫器,推开膀胱返折腹膜,暴露病灶切除的具体范围,使用超声刀切除病灶后缝合,探查宫腔下段及宫颈血管重建情况,探查两侧输尿管正常后,留置引流管,结束手术。
1.3 观察指标
收集患者年龄、孕周数、孕囊体积、血β-HCG值、CSP类型、合并基础疾病、体质指数(BMI)等;记录术中出血量、术后第1d血β-HCG值、住院时间、住院费用和手术并发症情况,术后随访,记录术后月经复潮时间;评价治疗效果:治疗成功,病灶清除干净,术中出血量≤800ml,术后血清β-HCG水平显著持续下降,无需再行子宫全切或者次全切手术;治疗失败,术中出血量>800ml,或出现难以控制的持续性出血,需行子宫全切或次全切手术。
1.4 统计学分析
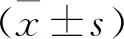
2 结果
2.1 一般资料比较
两组患者年龄、剖宫产次数、停经时间、术前血β-人绒毛膜促性腺激素(β-HCG)水平比较均无差异(P>0.05)。见表1。
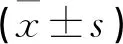
表1 两组患者一般资料比较
2.2 临床疗效比较
112例患者均完成UAE和UAB手术。UAE组56例妊娠终止顺利,治疗成功率93.3%,其中4例为外院清宫后出现难以控制的大出血入本院急诊行UAE治疗,患者术后24h均行腹腔镜下FER术,其余4例手术不成功(3例清宫过程中出血量>800ml,经止血后治愈,1例中转开腹行局部病灶切)。UAB组中50例妊娠终止顺利,无大出血情况发生,治疗成功率96.2%,1例清宫时出血量>800ml,经宫腔内纱布加压填塞、止血和宫缩药物应用等针对性治疗后治愈,1例由于出现无法控制的持续性出血而行补救性子宫手术。两组治疗成功率无差异(χ2=0.437,P=0.508)。
2.3 手术指标比较
两组术中出血量、术后第1d血β-HCG和月经复潮时间比较均无差异(P>0.05),住院时间和住院费用UAB组少于UAE组(P<0.05)。见表2。
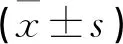
表2 两组手术指标比较
2.4 并发症情况比较
UAE组术后有5例发热,2例疼痛显著,1例出现静脉血栓形成,术后并发症发生率13.3%;UAB组术后有3例发热,并发症发生率5.7%,术后并发症发生率低于UAE组(P<0.05)。UAE组中有2例术后月经复潮时间长达3月余,月经量较前减少。
2.5 危险因素分析
112例治疗成功106例,6例失败。以手术是否成功作为因变量,以年龄、孕周数、CSP类型、术前β-HCG水平和超声孕囊体积等作为自变量,采用逐步法行logistic回归分析。结果显示,孕周数、CSP类型和超声孕囊体积是影响CSP治疗效果的独立危险因素。见表3。
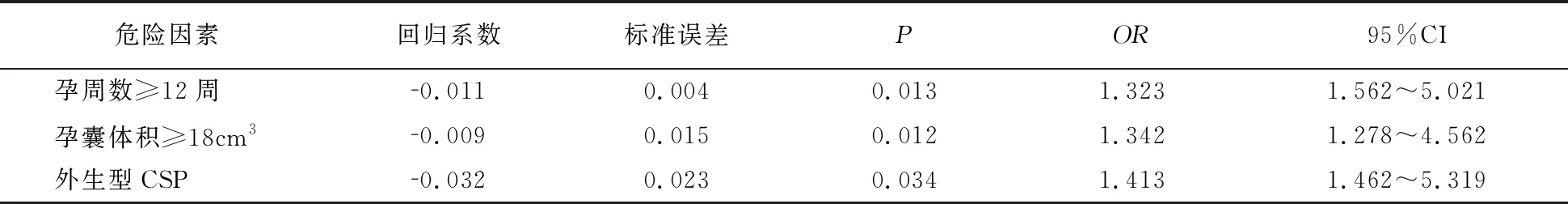
表3 影响CSP临床疗效的多因素分析
3 讨论
有研究报道CSP的发生率为1:1800~1:2216[5]。CSP因严重的出血风险、子宫破裂的危害越来越受到高度重视,研究发现CSP术后子宫瘢痕部位愈合障碍是直接诱因[6]。根据子宫前壁妊娠囊的生长方向和与膀胱间子宫肌层的厚度分为I~III型,因II、III型CSP容易出现大出血,临床应重视其规范诊治[7-8]。
II、III型CSP可选择开腹、腹腔镜、阴式等手术行妊娠物清除术和子宫瘢痕修补术,在紧急情况下为挽救生命或对无生育要求患者可选择子宫切除术[9]。联合UAE或UAB进行预处理,可以很大程度地减少手术出血量[10]。UAE是介入性治疗,在双侧子宫动脉上进行栓塞处理可以达到止血的目的,广泛用于产后大出血、子宫肌瘤、子宫腺肌病、CSP、子宫恶性肿瘤等治疗中[11]。但费用高,存在放射性损伤及栓塞失败等不良风险。腹腔镜下UAB可预防性减少子宫大出血风险,保护女性生殖功能,且并发症相对较少[12]。本研究112例行FER术CSP患者, 分别行UAE或UAB两种预处理方法效果显示,治疗成功率无明显差异,术中出血量、术后第1d血β-HCG和月经复潮时间也未见差异,而UAB组术后并发症更低,住院时间和住院费用减少,说明UAB治疗可缩短住院时间、减少住院费用,且更安全,在有效基础上减少了患者的经济负担,在非紧急情况下能替代UAE。
对治疗效果的影响因素进行分析发现,孕周数、CSP类型和超声孕囊体积是影响CSP治疗效果的独立危险因素,即孕周数越长、孕囊体积越大,妊娠部位的滋养血管丰富等均可加大出血风险,影响手术疗效,与有关研究结论相一致[13]。现有理论表明血清β-HCG水平越高,滋养细胞活性增加,表示存在更高的绒毛侵袭性,推测血清β-HCG水平可能是影响CSP疗效的危险因素之一。有研究发现术前血清β-HCG水平、外生型CSP是导致CSP治疗失败的危险因素[14-16]。但本研究分析显示β-HCG并非是影响CSP疗效的危险因素,考虑可能与样本量较少,通过治疗后β-HCG显著下降而影响了其权重有关。
综上所述,腹腔镜下子宫动脉暂时阻断术治疗CSP是一种有效、安全、并发症少且较为经济的病灶切除修补预处理方法,在非紧急情况下可替代UAE。孕周数、CSP类型和超生孕囊体积是影响CSP治疗效果的独立因素,在临床中应对这些影响因子制定针对性处理和治疗措施,以提高治疗效果。

