ZIF⁃8体系富集回收炼厂干气中C2H6+C2H4
张晓欣,华亚辉,董浩杰,李鹏辉,鞠 佳,封瑞江,张路南
(1.辽宁石油化工大学 石油化工学院,辽宁 抚顺113001;2.国家管网集团北方管道有限责任公司,河北 廊坊006500)
炼油工业作为一个能量密集型工业,耗能是导致炼油工业成本居高不下的第二大因素[1]。提高能量的利用率,减少资源的浪费,回收可利用的能源等研究受到全球众多研究者的关注。我国每年生产的炼厂干气超过3 000万t[2],炼厂干气的回收利用将会同时解决炼厂环保以及降低成本两大难题。炼厂干气通常含有C2H4、C2H6、CH4、N2及H2[3],而乙烯作为最重要的石油化学产品之一,已经被广泛的用于化学工业以及其他有机化合物的合成过程。预计到2050年,每年的乙烯需求量为37 600万t[4]。如果将炼厂干气中的轻烃组分加以利用,不仅为炼油工业节能环保提供了可行的解决方法,而且将会为化学工业提供大量的轻烃原料,解决市场轻烃需求缺口。
对于分离C2组分(C2H4及C2H6),传统的方法为低温蒸馏法[5],但是低温蒸馏法能量消耗量大,生产运行成本较高,为了节约成本,研究者们已经陆续尝 试 用 吸 收法[6]、吸附法[7⁃14]、水合法[15⁃18]回收混合气中的C2组分。M.M.Nejad等[8]运用过剩吉布斯能量模型模拟了SAPO⁃34对C2H4及C2H6的吸附平衡。A.P.Katsoulidis等[9]将间苯三酚和对苯二甲醛运用水热法合成介孔聚合有机骨架材料mesoPOFs,同时测量了其在273 K、0.1 MPa条件下对CH4、C2H6、CO2的吸附性能,并表示mesoPOFs对C2H6/CH4的分离因子可达到40。C.Altintas等[11]模拟了278种MOF材料对混合气C2H6/CH4的分离性能,证明一部分MOF材料(如ZIF⁃8、ZIF⁃90等)较沸石材料、聚合物膜材料对两种气体体系具有较强的吸附选择性以及气体穿透性能。S.Hosseinpour等[12]测量了C2H4、C2H6、CH4三 种 单 组 分 气体 在CaX床 层 的吸附穿透曲线,并测定了298~308 K条件下,CaX床层对混合气C2H4(15%)+C2H6(15%)+CH4(70%)的分离性能(以上均为摩尔分数,全文同),结果表明CaX对C2的分离性能最好,具备工业应用吸附分离C2组 分 的 潜 力。M.Salmas等[13]在288.15~308.15 K、0.1~3.0 MPa条件下,测量了C2H4、C2H6、CH4三种单组分气体在10X沸石固定床中的吸附穿透性能,结果表明最佳分离条件在308.15 K、0.1 MPa时,C2/CH4的分离因子可以达到15.6。G.M.Nam等[14]研 究 了293~313 K、0~2 MPa的 条 件 下,5A沸石对CH4、C2H4、C2H6、N2、H2五种单组分气体的吸附性能,并用Clausius⁃Clapeyron方程计算吸附焓。B.U.Choi等[15]运用静态容量法测量了在293.15~313.15 K、0~3 MPa条 件 下,活 性 炭 对CH4、C2H6、C2H4、N2、H2五种单 组 分气体的 吸 附性能,并计算了等容吸附热。近几年,研究者们也将水合分离法用于分离轻烃组分。Q.L.Ma等[16]测量了(CH4+C2H4)及(CH4+C2H6)两种混合气在是否存在THF的情况时,气⁃水合物相平衡数据,并证明Chen⁃Guo模型模拟与实验数据几乎一致。C.Y.Sun等[17]测量了在277.2~288.2 K,五组不同组成的CH4/C2H6混合气在含有摩尔分数6%四氢呋喃(THF,tetrahydrofuran)水溶液体系中水合物的生成条件,发现一定浓度四氢呋喃能够抑制乙烷水合物的生成,并且提高水合分离法对CH4/C2H6混合气的分离效率。X.B.Luo等[19]运用Chen⁃Guo模型模拟了水合⁃吸收法捕集不同组成CH4/C2H4原料气中C2H4,表明原料气中C2H4浓度较低时,水合⁃吸收法较吸收法在溶剂成本及能量损耗方面存在优势。
截止目前,研究者们已经运用吸收法、吸附法以及水合法对各单组分的储气性能、双组分气体(CH4+C2H6)的分离性能、三组分气体(C2H4+C2H6+CH4)中C2组分的分离性能进行了初步的研究,但是对于五组分气体体系的分离研究仍鲜有报道。本文将运用吸附分离法、吸附⁃水合分离法两种方法对模拟炼厂干气⁃五组分混合气(C2H4+C2H6+CH4+N2+H2)进行二级分离,回收其C2组分(即C2H6、C2H4),以期对回收炼厂干气中具有再利用价值的C2组分气体具有一定的理论指导意义。
1 实验部分
1.1 装置及材料
ZIF⁃8购 自Sigma⁃Aldrich公 司,SDS(Sodium Dodecyl Sulfate,十二烷基硫酸钠)购自国药集团化学试剂有限公司,原料气M1、M2购自北京氦谱北分气体工业有限公司,实验所用蒸馏水由实验室蒸馏制得。实验所用原料气相组成和平衡气相组成均由气相色谱HP7890分析所得,本文所用两种原料气M1、M2组成列于表1。实验装置如图1所示,实验装置详细说明见文献[20]。
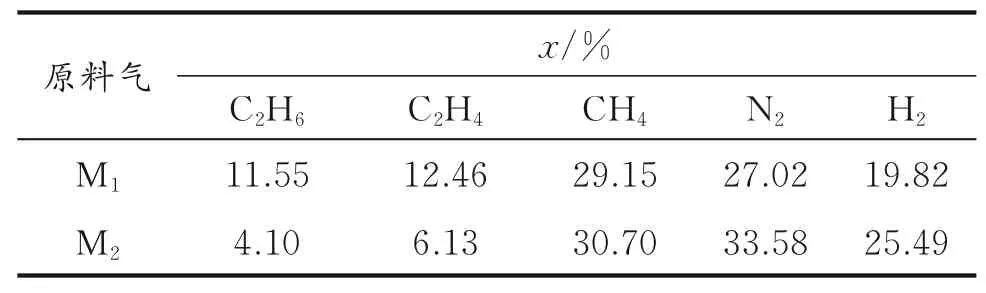
表1 原料气组成Table 1 Composition of feed gas

图1 实验装置Fig.1 Schematic diagram of the experimental apparatus
1.2 实验步骤及数据处理
测量ZIF⁃8的实验步骤如下:
(1)将宝石釜从装置上拆下,用蒸馏水洗干净,拭干。
(2)称取一定量的干ZIF⁃8或湿ZIF⁃8,并将其装到宝石釜中。
(3)将宝石釜安装好,并且将包含有平衡釜、宝石釜和连接两个釜之间的管线抽真空,随后关闭平衡釜和宝石釜之间的阀门。
(4)将连接平衡釜的管线及平衡釜抽真空,在平衡釜中充入一定量的原料气,将空气浴温度调到274.15 K。
(5)待温度稳定及平衡釜中压力达到平衡后,记录平衡釜初始压力p1;随后,打开平衡釜和宝石釜之间的阀门,将一定量的原料气充入到宝石釜中,关闭阀门。
(6)待宝石釜压力和平衡釜压力达到平衡,记录宝石釜压力pE和平衡釜压力p2;通过推动手推泵保持宝石釜内压力稳定,对宝石釜内平衡气相进行取样,并通过气相色谱HP7890分析平衡气相中气体组成。
实验数据处理过程如下:
下列计算过程及结果中zi、yi、xi分别代表进料气相、平衡气相及平衡吸附相中C2H6、C2H4、CH4、N2和H2的摩尔分数;yC2为平衡气相中C2H6及C2H4的摩尔分数之和;ρ为ZIF⁃8的骨架密度。

mw为含水的ZIF⁃8材料,m0为干ZIF⁃8材料,Xw为ZIF⁃8材料的含水率:

蓝宝石釜初始进气摩尔数n0和吸附平衡后气相摩尔数nE由式(3)计算:
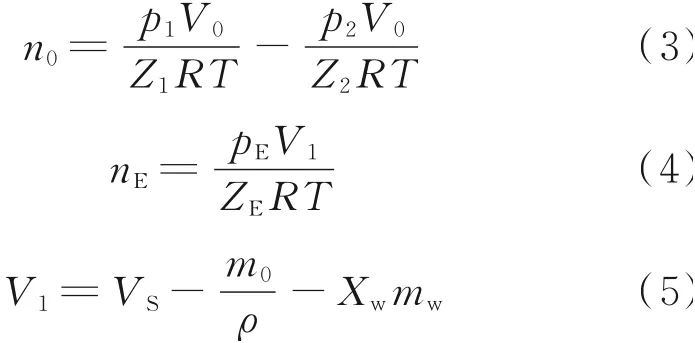
式(3)−(5)中,V0为平衡釜体积,VS为全透明蓝宝石釜的有效工作体积,V1为吸附平衡后蓝宝石釜上方的气相体积;Z1、Z2和ZE分别为平衡釜中初始气相压缩因子、吸附平衡后平衡釜中气相压缩因子和吸附平衡后宝石釜中气相压缩因子,由BWRS状态方程进行计算:

进入蓝宝石釜中C2H6、C2H4、CH4、N2和H2的物质的量ni分别为(i为C2H6、C2H4、CH4、N2和H2):

吸附平衡后气相中各组分的物质的量分别为(i为C2H6、C2H4、CH4、N2、H2):

ZIF⁃8分 别对C2H6、C2H4、CH4、N2和H2的吸附量Mi及对C2的吸附量MC2为:

ZIF⁃8对C2H6、C2H4、CH4、N2和H2的总吸附量M为:

2 结果与讨论
2.1 ZIF⁃8体系对混合气M1的一级分离
为了考察干ZIF⁃8及湿ZIF⁃8对含C2的混合气分离情况,在274.15 K下,针对不同气固比条件,干ZIF⁃8及湿ZIF⁃8对混合气M1的分离情况进行了一系列的实验研究,结果列于表2,且将其压力变化曲线绘于图2。其中,为了缩短湿ZIF⁃8运用吸附⁃水合法分离混合气达到平衡所需的时间,在湿ZIF⁃8的制备过程中加入质量分数为8×10−4g/g的SDS[21⁃23]。

表2 干ZIF⁃8及湿ZIF⁃8(Xw=29.98%)分离原料气M1的实验结果Table 2 Separation results of dry ZIF⁃8 and wet ZIF⁃8 with Xw=29.98% for separating M1

图2 干ZIF⁃8和湿ZIF⁃8(Xw=29.98%)分离M1的压力变化曲线Fig.2 Pressure curves of dry ZIF⁃8 and wet ZIF⁃8 with Xw=29.98% for separating M1
表2 实验数据显示,对于干ZIF⁃8体系,随着压力降低,平衡气相中yC2逐渐降低,且在pE=1.4 MPa时,yC2达到最低值6.70%;随着压力降低,ZIF⁃8对C2的 吸 附 量MC2逐渐 降 低,在pE=4.1 MPa时,MC2取得最大值3.5 mmol/g,在pE=1.4 MPa时,MC2取得最小值1.8 mmol/g,这是因为反应釜不同初压所对应的气固比不同,气固比越大,进入反应釜的气体体积量越大,干ZIF⁃8对气体的吸附量MC2越大,yC2降低的程度越小,yC2值越大;随着压力降低,对N2和H2的 吸 附 量MN2、MH2分 别 稳 定 在0.3、0.2 mmol/g左右,这是 因 为ZIF⁃8对N2及H2的 吸附能力 相 对 于ZIF⁃8对C2H6、C2H4、CH4的 吸 附 能 力 很小,吸附量随压力变化不大;ZIF⁃8的孔径为0.34 nm[24],其孔径大于H2的分子直径(0.27 nm),小于N2的分子直径(0.41 nm)[25⁃27],ZIF⁃8孔径对H2分子进出其孔结构的限制性较小,对N2的限制性较强,导致压力对吸附量的影响不大。
由表2还可以看出,与干ZIF⁃8体系不同,随着压力降低,湿ZIF⁃8(Xw=29.98%)体系分离结果中yC2的值波动较小,且压力降低时,MC2降低较干ZIF⁃8体系明显,其中在pE=2.4 MPa时,xC2达到10.00%,MC2为2.3 mmol/g;在pE=1.5 MPa时,xC2达到最小值9.90%,MC2为1.4 mmol/g。综合考虑,选取pE=2.4 MPa时,CH4、C2H6、C2H4、N2和H2的摩尔分数分别为29.70%、3.90%、6.10%、34.20%和26.10%,为第二级分离的原料气组成。
由图2可以看出,在pE大于等于3.2 MPa时,湿ZIF⁃8分离过程的压降要明显大于干ZIF⁃8的压降。此外,对比表2中数据,当p0=4.6 MPa时,湿ZIF⁃8(Xw=29.98%)体系pE=3.9 MPa(yC2=10.20%,MC2=3.9 mmol/g,M=7.1 mmol/g),而干ZIF⁃8体系pE=4.1 MPa(yC2=11.70%,MC2=3.5 mmol/g,M=5.5 mmol/g)。p0=3.6 MPa时,从平衡气相中C2分子数的减少以及吸附量的增加表明,当p0大于3.6 MPa时,湿ZIF⁃8体 系 运 用 吸 附⁃水 合 法 分 离C2气体,体现出吸附⁃水合法分离含C2组分混合气M1的优势。当p0小于2.6 MPa,湿ZIF⁃8体系 的yC2较干ZIF⁃8体系高,MC2及M较干ZIF⁃8体系小,这是因为此时体系压力较小,不足以形成水合物,采用吸附法分离气体,并且在ZIF⁃8骨架周围形成一层水分子膜,阻碍了C2吸附在ZIF⁃8孔道表面,导致yC2升高,MC2及M降低。
为了研究湿ZIF⁃8材料分离混合气M1后形态结构是否发生变化,将完成分离实验后回收的ZIF⁃8材料进行扫描电镜测试(SEM),并与原ZIF⁃8材料的扫描电镜图进行对比,结果见图3。

图3 ZIF⁃8材料扫描电镜Fig.3 SEM images for ZIF⁃8
从图3中可以看出,湿ZIF⁃8材料在经过分离⁃再生⁃分离过程后,与新鲜的ZIF⁃8材料在形貌和颗粒形态上没有发生明显的变化。
2.2 ZIF⁃8体系对混合气M1的二级分离
在不同初压时,分别利用干ZIF⁃8和湿ZIF⁃8(Xw=29.98%,含8×10−4g/g SDS)分离五组分混合气M1,在分离结果中,得出进行二级分离的原料是M2,其组成如表1所示。
针对干ZIF⁃8以及湿ZIF⁃8(Xw=29.98%)对原料气M2在274.15 K、不同初压时进行了研究,干ZIF⁃8和湿ZIF⁃8(Xw=29.98%)分离混合气M2的分离结果列于表3,压力变化曲线列于图4。

表3 干ZIF⁃8及湿ZIF⁃8(Xw=29.98%)分离原料气M2的实验结果Table 3 Separation results of dry ZIF⁃8 and wet ZIF⁃8 for separating M2

图4 干ZIF⁃8和湿ZIF⁃8(Xw=29.98%)分离M2的压力变化曲线Fig.4 Pressure curves of dry ZIF⁃8 and wet ZIF⁃8 with Xw=29.98% for separating M2
由表3可见,干ZIF⁃8体系随着压力降低,平衡气相中C2的组成yC2逐渐降低,在pE=1.5 MPa时,yC2取得最小值2.90%,M达到了3.1 mmol/g。湿ZIF⁃8(Xw=29.98%)体系,yC2先随着压力降低而逐渐的降低,但是在pE=2.4 MPa时,yC2出现了突然上升,这是因为当压力不足以使体系生成水合物时,ZIF⁃8表面的水分占据了吸附位,阻碍C2H6和C2H4的吸附,降低了ZIF⁃8材料对C2的吸附量,削弱了分离效果。对比表3中干ZIF⁃8体系与湿ZIF⁃8体系的分离结果,相同初压时,较干ZIF⁃8体系,湿ZIF⁃8体系的yC2较高,MC2及M值较小,这是因为原料气M2中C2的气相量只占10.23%,在P0小于4.70 MPa时,生成水合物对提高yC2、降低MC2及M造成的影响弱于ZIF⁃8表面水膜对分离效果的负面影响。
对于分离C2组成较低的原料气M2,从yC2的降低及M的提高可以看出,干ZIF⁃8体系较湿ZIF⁃8(Xw=29.98%)体系存在一定优势。从表3结果可以得出,对于干ZIF⁃8分离混合气M2,yC2可以由10.23%降低至2.90%。
由图4可以看出,干ZIF⁃8及湿ZIF⁃8达到平衡所需的时间均较短,且两者之间没有明显的压力降差值,表明含水率29.98%的湿ZIF⁃8对混合气M2的分离过程中没有水合物的生成,这是因为在混合气M2中C2的气相量只占10.23%,N2、H2含量较高,且两者生成水合物条件较高(H2水合物生成条件293 K,200 MPa[28];TBAC(四丁铵氯化物)体系N2生成水合物条件为289.68 K,4.56 MPa[25],导致混合气M2生成水合物的压力较高。
综上所述,运用吸附⁃水合法及吸附法两级分离五组分混合气M1,能够将混合气中C2摩尔分数由24.01%降低至2.90%,CH4+H2摩尔分数由48.97%提高到58.40%,回收炼厂气中大部分的C2H6和C2H4气体,提高原料气中CH4和H2的浓度。此外,通过两级分离回收的C2气体可通过升温解吸的方法进行后续处理,提高浓度后的原料气可作为清洁能源。
3 结论
针对干ZIF⁃8体系及湿ZIF⁃8体系分离混合气M1:C2H6(11.55%)+C2H4(12.46%)+CH4(29.15%)+N2(27.02%)+H2(19.82%)进行了一系列的实验研究,通过运用吸附⁃水合法及吸附法两级分离可以将原料气M1中C2的摩尔分数由24.01%降低至2.90%。此外,对于分离原料气M1,当初压p0大于3.6 MPa时,湿ZIF⁃8体系运用吸附⁃水合分离法,较干ZIF⁃8体系,yC2降低,MC2及M提高,体现出吸附⁃水合法具有一定的优势;对于分离C2摩尔分数较低的原料气M2,由于C2组成摩尔分数较低,水合法的优势没有体现出来,故对于C2组成摩尔分数较低的原料气,采用干ZIF⁃8体系吸附法分离较合适。

