RuHI(CO)(i⁃Pr⁃Imidazole)(PPh3)2催化甲醇水重整产氢
齐卫卫,秦 雷,周明东,郑智平
(1.辽宁石油化工大学 石油化工学院,辽宁 抚顺113001;2.南方科技大学 化学系,广东 深圳518055)
现代社会越来越依赖于化石燃料来满足不断增长的人口对能源的需求,每天约有2 000万t的煤、8 500万桶的石油(约1 200万t)和100亿m3的天然气方可满足人类约80%的能源需求[1]。如此大规模使用化石燃料,造成CO2不可避免的向大气中排放,每年的排放量超过350亿t(2015年)[2]。CO2排放使自然界的碳循环不堪重负,导致大气中CO2浓度迅速增加。目前,大多数科学家认为CO2以及其它温室气体的积累是造成全球变暖和相关气候变化现象的主要因素。另一方面,化石燃料储存量是有限的,它们是数百万年前形成的,无法在人类时间尺度上更新。因此,严格执行排放法规和开发绿色可持续能源已成为人类未来发展道路上需要解决的问题[3]。
目前,最具前景的可再生能源—太阳能和风能,不仅具有间歇性,而且还有很大的不稳定性,导致这些可再生能源仍不能成为人类活动的主要能源供给来源。电能等能量储存在化合物的化学键中是一种有效的能源存储方式,如存储在H2、甲烷和甲醇等化合物中。这些化合物便于存储和运输,不受时间和地域的限制,可以在需要的时候转化为电能、热能或者驱动需要的装置[4⁃6]。H2是结构最简单的化合物,可以通过电解水产生。氢能作为一种优良的、清洁的燃料,已被认为是一种能量存储介质。但是,氢气的密度低,要达到合格的能量密度,需要高压压缩(35 000~70 000 kPa或更高)或在非常低的温度(−253℃)下液化。H2也是高度易燃易爆的气体,能够扩散到许多常用的金属和材料中,使其具有潜在的脆性,影响到H2的安全运输和储存。为了克服这个问题,将H2以化学能的形式储存于液体有机氢载体中被认为是可行的选择。在已知的液体有机氢载体中,甲醇是一个强有力的竞争者。这是因为甲醇是一种简单的化合物,具有单位体积储氢量高、活化温度低、副产物少以及价廉易得等诸多优点,这显著简化了运输和处理过程。因此,甲醇作为一种能源载体得到了广泛的关注[7⁃16]。
多相催化剂催化甲醇重整过程通常需要高温(>200℃)和高压(2 500~5 000 kPa)的反应条件[17⁃21]。在高温下进行甲醇重整产氢会生成CO,导致燃料电池中的催化剂中毒,从而失去活性,这限制了它的潜在应用。因此,开发高效稳定的低温甲醇水重整均相催化剂,成为该领域发展的关键。近几年来,钌、铑和铱贵金属催化剂(见图1)在甲醇重整产氢研究领域得到了广泛的应用,并展现出了优异的催化效果[22⁃26]。这类催化剂催化效果相对较好,但许多膦配体都具有高成本、空气敏感和很难大规模合成的特点。
本文介绍了一种合成比较简单、成本较低和可以大量制备的钌配合物RuHI(CO)(i⁃Pr⁃Imidazole)(PPh3)2(简称C1,见图2),并用于均相催化甲醇⁃水溶液体系重整产氢。该方法在低温和常压下,通过一系列的条件优化实验来筛选最佳的反应条件进行制氢,探索其在甲醇重整产氢中的应用。

图1 部分已报道的贵金属催化剂Fig.1 Selected reported noble⁃metal catalysts

图2 C1配合物的分子结构Fig.2 The molecular structure of the C1 complex
1 实验部分
1.1 试剂与仪器
试剂:乙醇、甲苯(分析纯)、甲醛(质量分数93%,含质量分数7%的甲醇稳定剂),上海阿拉丁生化科技股份有限公司;氢氧化钾、氢氧化钠、三苯基膦、氢氧化锂、氢氧化铯,分析纯,市售;乙二醇甲醚(质量分数99%),萨恩化学技术(上海)有限公司;水合三氯化钌、二碘甲烷(质量分数99%),Sigma⁃Aldrich西格玛奥德里奇(上海)贸易有限公司;GC甲醇(质量分数99.9%),北京伊诺凯科技有限公司;正己烷(分析纯),上海泰坦科技股份有限公司;三乙胺(质量分数99.9%),深圳市昌泰化工科技有限公司;1⁃异丙基咪唑(分析纯),上海易恩化学技术有限公司;丙酮(分析纯),深圳化试科技有限公司。
仪器:TLE204E/02电子天平,梅特勒⁃拖利多上海有限公司;Vario EL元素分析,德国CarloErba公司;Bruker D8 Venture X⁃射线单晶衍射、Vertex80傅里叶红外光谱仪,德国Bruker公司;2XZ⁃4BD真空泵,上海真空泵有限公司;Agilent/7820A气相色谱仪,安捷伦仪器有限公司;VSPS⁃7溶剂纯化系统,威格气体纯化科技股份有限公司。
1.2 催化剂的制备
三(三苯基膦)羰基氢氯化钌(II)的合成步骤:在氩气氛围保护下,向1 000 mL的圆底三颈瓶中加入三 苯 基 膦(7.91 g,30 mmol)和 乙 二 醇 甲 醚(300 mL),将该混合溶液加热至回流,然后快速加入水合三氯化钌(1.32 g,5 mmol)、甲醛(43 mL)和乙二醇甲醚(100 mL)溶液,将该溶液加热回流6 h,然后冷却至室温。过滤得到粉色沉淀,依次用乙醇、水、正己烷洗涤,然后真空干燥,产率为89%。
亚甲基双(N⁃异丙基)咪唑二碘化物L1的合成步骤:在氩气氛围保护下,向500 mL干燥的Schlenk圆底烧瓶中依次加入N⁃异丙基咪唑(11.47 g,102.5 mmol)和二碘甲烷(13.62 g,50 mmol)溶解在甲苯(200 mL)溶液中,并加热回流44 h。过滤得到白色沉淀,并用甲苯和丙酮重结晶两次,得到白色粉末L1,产率为75.3 %。
配合物C1的合成步骤:向15 mL反应釜中依次加 入L1(0.25 g,0.5 mmol)、RuHCl(CO)(PPh3)3(0.47 g,0.5 mmol)和NEt3(0.11 g,1.0 mmol)溶解在CH3OH(8 mL)中,然后将15 mL特氟隆反应釜密封在不锈钢反应釜容器中,并在130℃加热3 d。以5℃/h的速度将温度冷却至室温,得到灰白色片状晶体C1,产率为80.6 %。C1的表征:红外σ(CO)为1 900 cm−1,元 素 分 析C43H41IN2OP2Ru,理 论 值(质量分数):C 57.92%,H 4.63%,N 3.1%;测量值(质量分数):C 57.84%,H 4.36%,N 3.01%,单晶结果如图2所示。
1.3 配合物C1的晶体结构表征
得到的晶体转移至玻璃片,在显微镜下选取规则表面光滑的晶体,滴入Paratone⁃N油,固定在样品台塑料环上,置于Bruker D8 Venture的单晶衍射仪上,100 K下,用经石墨单色化的波长为0.071 nm的Mo⁃Kɑ射线,结合φ和ω角,计算收集策略。使用Bruker APEX⁃II CCD进行数据收集、数据还原、晶胞参数精修和吸收校正,结果见表1−3。用Olex2程序解析晶体结构,利用全矩阵最小二乘法对晶体结构进行精修。配合物中所有非氢原子都进行了各向异性的校正,与碳原子相连的氢原子根据结构化学原理,进行合适的理论加氢,进一步将氢原子固定在碳原子上,对氢原子进行修正。催化剂C1的CCDC号为1998468,可以从剑桥晶体学数据库(网址www.ccdc.cam.ac.uk/conts/retrieving.html)免费获得。

表1 配合物C1的晶体数据和结构精修参数Table 1 Crystal data and structural refinement parameters of complex C1
1.4 分析测试方法
在合成催化剂C1后,通过甲醇重整产氢实验来检验其催化性能。在氩气氛围下,通过调控碱的种类、反应温度和甲醇/水配比等多种因素来筛选最佳的反应条件。实验步骤如下:首先,将一定比例混合的甲醇/水溶液和一定量的碱加入100 mL干燥并带有两个颈口的Schlenk圆底烧瓶中,除氧30 min,然后将反应物在无氧的条件下加热至一定温度或者回流状态至稳定,将一定量的催化剂加入整个反应体系。通过将反应装置与气体体积测量装置相连接,实时检测生成气体的体积变化。同时,通过气体进样针抽取少量的气体,用气相色谱仪检测气体的组成。此外,甲醇重整反应过程中产生的气体中可能含有少量的CO和CH4,其中CO不利于在实际燃料电池中使用,容易使燃料电池中的催化剂“中毒”而失效。
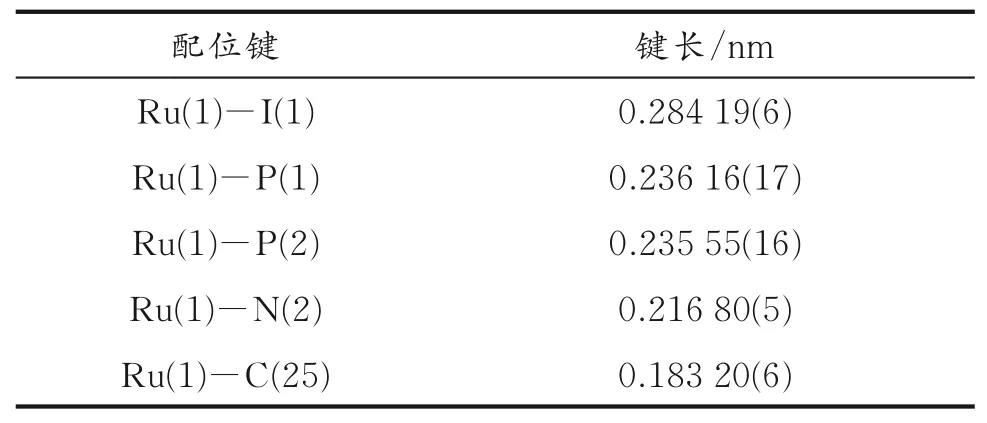
表2 配合物C1的部分键长Table 2 Selected bond lengths of complex C1

表3 配合物C1的部分键角Table 3 Selected bond angles of complex C1
利用产生的H2体积,可以计算反应中的转化数TON(Turnover number),其中每一个H2分子代表一个转化数。将实验收集到的气体体积Vobs减去不加催化剂在同样条件下的体积变化Vblank(溶剂蒸气等气体引起的体积变化),可以得到经过校正的真实 的H2体 积Vcor=Vobs−Vblank,计 算 得 到 相 应 的TON,如式(1)所示:

其中,Vobs是通过量气管测得的气体体积,L;Vblank是空白对照实验的体积变化,L;Vm,H2,25℃是H2的摩尔体 积,L/mol;ncat为 催 化 剂 的 物 质 的 量,mol。H2的摩尔体积Vm,H2,25℃可以通过范德瓦尔斯方程(Van der Waals Equation)计算得到,如式(2)所示:

对 于H2而 言,R=8.314 5 m3Pa/(mol·K),T=298.15 K,p=101 325 Pa,a=2.49×10−10Pa·m3/mol2,b=26.7×10−6m3/mol。
通过计算不同的反应时间得到的TON,可得到相应的转换频率TOF(Turnover Frequency)。TOF的含义为单位时间内单个活性位点的转化数,TOF衡量的是一个催化剂催化反应的速率,表示的是催化剂的本征活性。
2 结果与讨论
大量文献研究表明[22⁃26],钌配合物均相催化甲醇重整产氢的反应条件(碱的种类、甲醇与水的配比、反应温度等)对产氢的TON影响很大。因此,需通过实验筛选出最优的反应条件,并对产生的气体成分及产量进行分析,反应方程式如式(3)所示:

2.1 碱的筛选
对于均相催化甲醇重整产氢反应,加入碱一方面可以吸收反应中产生的CO2,收集到纯净的H2;另一方面,加入碱对催化体系的反应活性有较大的影响。实验选用MeOH和H2O(体积比9∶1,总体积为10 mL)为反应底物,在120℃反应4 h,通过实验筛选催化剂C1均相催化甲醇重整产氢效果最佳的碱种类和用量,结果见表4。
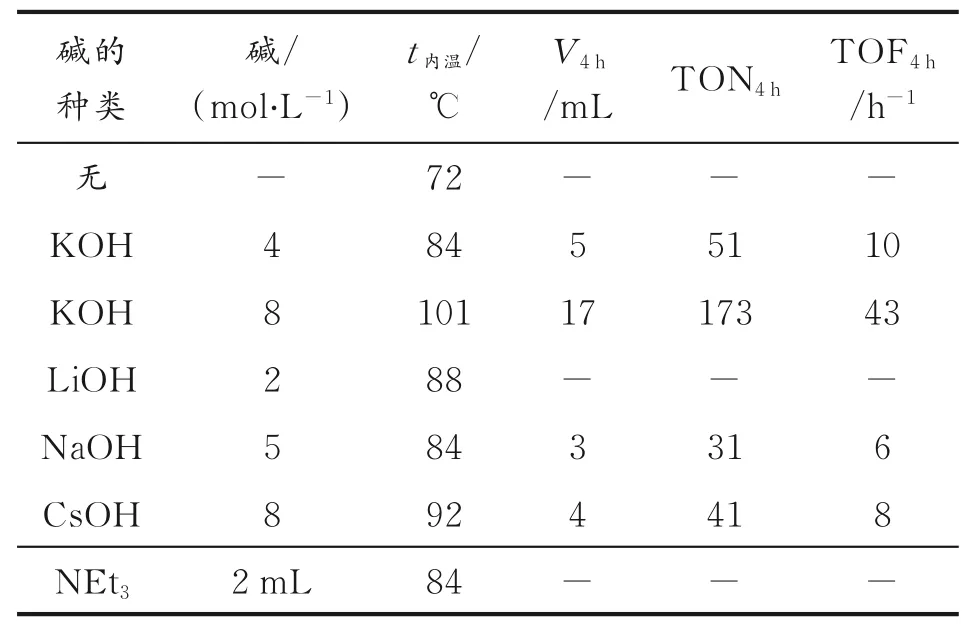
表4 碱对反应的影响Table 4 The effect of base on the reaction
从表4可以看出,在不加碱的情况下没有H2产生。加入不同的碱催化产氢的体积不同,加入LiOH和NEt3没有H2产生,加入NaOH和CsOHH2,产生H2的体积较低,加入KOH后产生的H2体积最大,同时发现8 mol/L的KOH产氢效果最佳。
2.2 反应温度的确定
通过表4发现不同种类碱的内部反应温度不同,8 mol/L的KOH反应温度最高,因此对反应温度进行了筛选。实验在V(MeOH)/V(H2O)=9∶1,8 mol/L的KOH下反应4 h,通过实验筛选了对催化剂C1均相催化甲醇重整产氢效果最佳的温度,结果见表5。
从表5可以看出,反应温度为120℃时,产生H2的体积最大,但是根据GC数据分析表明,当温度太高时,产生的气体中含有CO,长期反应会使催化剂中毒失效,因此筛选较佳反应温度为110℃。

表5 温度对反应的影响Table 5 The influence of temperature on reaction
2.3 V(MeOH)/V(H2O)的确定
在8 mol/L的KOH和110℃下反应4 h,通过实验筛选对催化剂C1均相催化甲醇重整产氢效果最佳的V(MeOH)/V(H2O),结果见表6。

表6 V(MeOH)/V(H2O)对反应的影响Table 6 The influence of V(MeOH)/V(H2O)on the reaction
从表6可以看出,反应物为纯甲醇时,产生H2的体积最大,反应3 h后,产生H2的速率逐渐降低,在十几个小时以后停止反应。因此选取V(MeOH)/V(H2O)=9∶1和V(MeOH)/V(H2O)=19∶1分 别 进行了长期的反应。其中,V(MeOH)/V(H2O)=19∶1时反应8 d后停止反应,而V(MeOH)/V(H2O)=9∶1时反应14 d后停止反应,因此选择V(MeOH)/V(H2O)=9∶1为较佳比例,结果见表7。
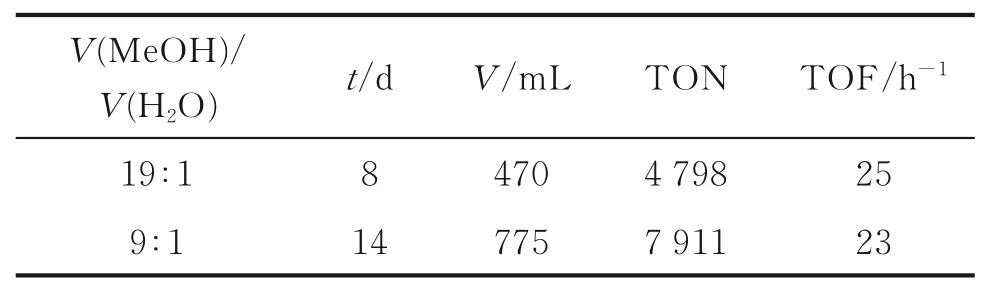
表7 长期反应结果Table 7 Long⁃term performance
2.4 催化机理分析
通过实验数据分析,提出了可能的反应机理(见图3)。催化剂C1在强碱的作用下失去一分子三苯基膦和一分子碘,形成具有空位点的配合物A,配合物A通过β脱氢和失去一分子甲醛,形成真正的活性物种配合物B,配合物B与溶液反应生成过渡态配合物C,其中一分子甲醇作为辅助溶剂,形成较为稳定的六元环。过渡态配合物C通过迁移,形成配合物D,配合物D快速失去一分子甲醇和一分子H2,形成具有空位点配合物E,配合物E通过β脱氢,形成了配合物B,这样就形成了一个可循环的催化反应体系。

图3 可能的反应机理Fig.3 Possible reaction mechanism
3 结论
经过一系列的实验筛选,最终确定了反应温度为110℃,8 mol/L的KOH和V(MeOH)/V(H2O)=9∶1为最优条件,在最优条件下对催化剂C1进行了长期催化性能检测,发现在14 d后,反应的TON达到了7 911。通过与均相催化甲醇重整产氢的实验对比,本实验的催化剂C1合成步骤简单而且合成产率较高。另一方面,此实验不需要添加配体和助催化剂,不仅降低反应成本,也有利于后期实验机理的研究。综上所述,此研究对实现甲醇重整产氢工业化生产提供了新的思路。

