慢性乙型肝炎的治疗现状
陈学福,张东敬,罗晓丹,陈 仁
广东省人民医院(广东省医学科学院) 感染科,广州 510080
防治HBV感染已成为全球公共卫生问题[1]。目前我国一般人群HBsAg流行率为5%~6%,慢性HBV感染者约7000万例,其中慢性乙型肝炎(CHB)患者为2000万~3000万例,每年约有30万人死于HBV感染相关疾病[2]。慢性HBV感染的防控工作任重道远。
1 CHB的疾病进展
HBV感染的自然史主要取决于病毒和宿主相互作用,其中HBV感染时的年龄是影响慢性化的主要因素之一,我国HBV感染者多为围产期或婴幼儿时期感染。未经抗病毒治疗CHB患者的肝硬化年发生率为2%~10%。代偿期肝硬化进展为失代偿期的年发生率为3%~5%,失代偿期肝硬化5年生存率为14%~35%。非肝硬化HBV感染者的HCC年发生率为0.5%~1.0%。肝硬化患者肝细胞癌(HCC)年发生率为3%~6%。较低的HBsAg水平常反映宿主对HBV复制和感染具有较好的免疫控制能力。研究[3]显示,即使HBeAg阴性、HBV DNA低水平,不论B或C基因型,HBsAg水平较高(≥1000 IU/ml)者发生HCC的风险仍较高。在全球范围内,HBV感染是发生HCC的主要原因。我国肝硬化和HCC患者中,由HBV感染引起的比例分别为77%和86%[4]。如不采取必要措施,预估2030年中国将有1000万人死于慢性肝炎。从HBV感染的流行率、疾病进展风险以及WHO 2030年全球消除慢性乙型肝炎的目标[1-3],慢性乙型肝炎治疗的紧迫性势在必行。
2 CHB的治疗目标
最大限度地长期抑制HBV复制[4-6],减轻肝细胞炎症坏死及肝纤维组织增生,延缓和减少肝衰竭、肝硬化失代偿、HCC及其他并发症的发生,改善患者生命质量,延长其生存时间。对于部分适合条件的患者,应追求临床治愈。
针对慢性乙型肝炎的治疗目标,依据血清HBV DNA、ALT水平和肝脏疾病严重程度,同时需结合年龄、家族史和伴随疾病等因素,综合评估患者疾病进展风险,决定启动抗病毒治疗时机[4-6];动态评估这些指标比单次检测更有临床意义。
3 CHB治疗的现状
对于慢性HBV感染,抗病毒治疗是关键。只要有适应证,就应进行规范的抗病毒治疗。已批准上市的两大类HBV治疗药物即IFNα和核苷(酸)类似物(NAs)(表1)。IFNα作用于宿主,与1型IFN受体结合,激活免疫调节,诱导抗病毒蛋白的表达。NAs作用于病毒,与天然核苷结构相似,与天然核苷竞争逆转录酶的结合位点,抑制HBV多聚酶的逆转录活性,从而抑制HBV DNA的合成。按照上市时间,NAs有拉米夫定(LAM)、阿德福韦酯(ADV)、恩替卡韦(ETV)、替比夫定(LDT)、富马酸替诺福韦酯(TDF)、富马酸丙酚替诺福韦(TAF)。中国《慢性乙型肝炎防治指南(2019年版)》[3]建议初治患者应首选强效低耐药NAs(ETV、 TDF、TAF)治疗。不建议ADV和LAM用于HBV感染者的抗病毒治疗。LDT可改善估算肾小球滤过率(eGFR),但总体耐药率仍偏高。LDT在阻断母婴传播中具有良好的效果和安全性。正在应用非首选药物治疗的患者,建议换用强效低耐药药物,以进一步降低耐药风险。应用ADV者,建议换用ETV、TDF 或TAF;应用LAM或LDT者,建议换用TDF、TAF或ETV;曾有LAM或LDT耐药者,换用TDF或TAF;曾有ADV耐药者换用ETV、TDF或TAF;联合ADV和LAM/LDT治疗者,换用TDF或TAF。
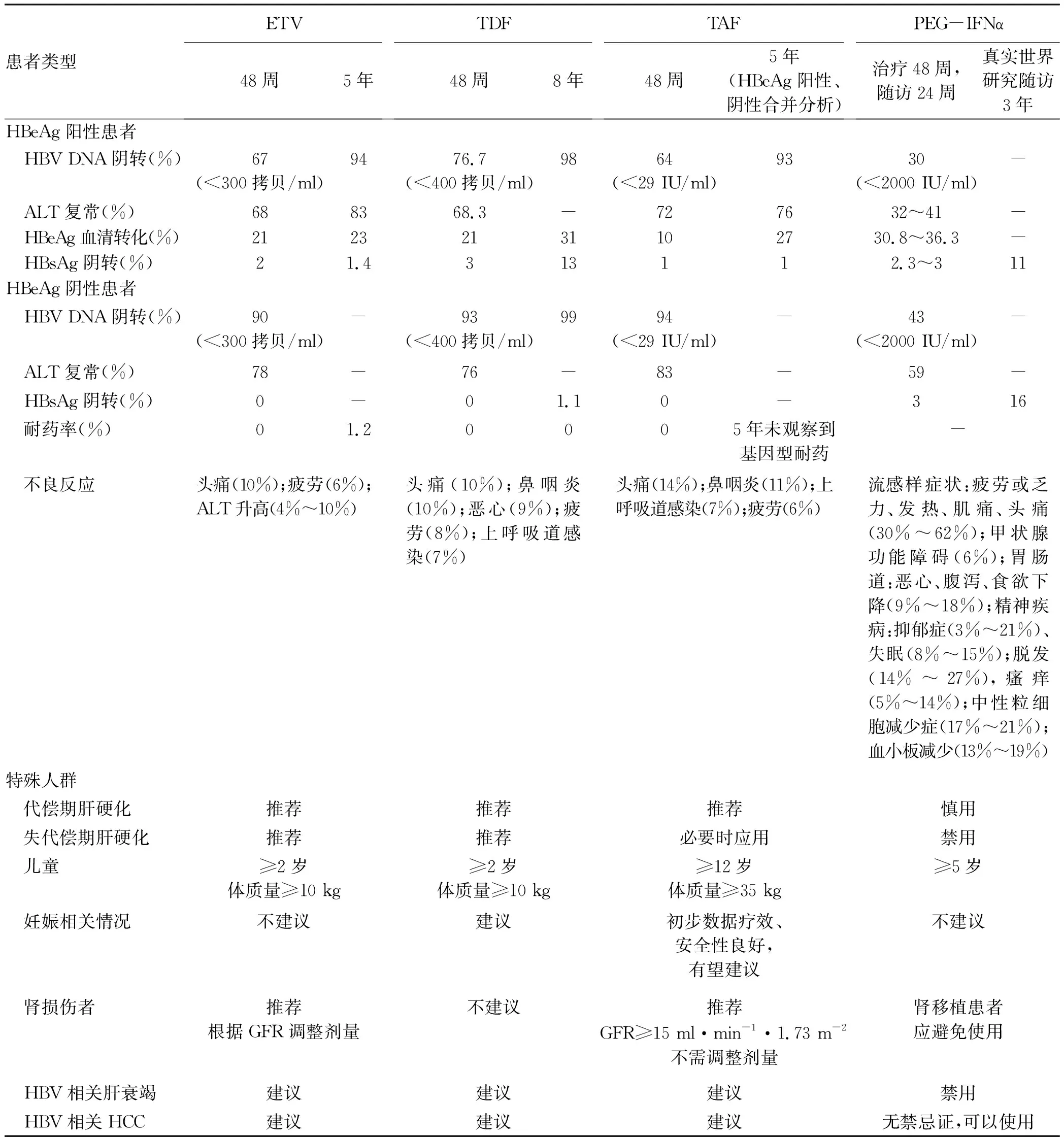
表1 现有抗病毒药物总览
3.1 强效低耐药NAs
3.1.1 ETV 2005年中国上市,大量研究[7-9]数据显示,采用ETV治疗可强效抑制病毒复制,改善肝脏炎症,安全性较好,ETV 10年REALM研究[10]显示长期治疗可改善乙型肝炎肝硬化患者的组织学病变,显著降低肝硬化并发症和HCC的发生率,降低肝脏相关和全因死亡率。在初治CHB患者中,ETV治疗5年的累积耐药发生率为1.2%;在拉米夫定耐药的CHB患者中,ETV治疗5年的累积耐药发生率升至51%。ETV可治疗年龄≥2岁,且体质量≥10 kg的CHB儿童,根据体质量决定治疗剂量,若年龄≥2岁,且体质量≥30 kg的CHB儿童,则按成人剂量[4]。
3.1.2 TDF 2013年中国上市,应用TDF治疗CHB患者的多中心临床研究[11]结果显示,可强效抑制病毒复制,耐药发生率低。采用TDF治疗8年的研究[12]数据显示,未发现TDF相关的耐药。TDF长期治疗显著改善肝组织学,降低HCC发生率。多项TDF治疗NAs经治患者48~168周的研究[13-14]显示,TDF用于LAM耐药、ADV耐药、ETV耐药或多药耐药患者的治疗,均可获得70%~98%的病毒学应答,且随着治疗时间的延长,病毒学应答率逐渐升高。TDF在育龄期CHB患者以及阻断母婴传播具有良好的效果和安全性。2020年WHO发布的妊娠期抗病毒治疗预防乙型肝炎母婴传播的指南[15],建议对HBV DNA>5.3 log IU/ml或HBeAg阳性者孕妇,在妊娠28周开始TDF抗病毒治疗。TDF可治疗年龄≥2岁,且体质量≥17 kg的CHB儿童,根据体质量决定治疗剂量[4]。
3.1.3 TAF 2018年中国上市,TAF在CHB长期抗病毒治疗的有效性和安全性数据来源于两项全球多中心的3期、随机、双盲、活性对照试验。2020年AASLD[16]公布其5年随访数据:CHB患者按2∶1比例随机分组接受TAF或者TDF双盲治疗,96或144周后再接受TAF开放标签治疗至第5年。866例接受TAF治疗,180例接受TDF 96周开放标签、TAF 144周治疗,202例接受TDF 144周开放标签、TAF 96周治疗,5年的研究结果显示:三组病毒学应答率(HBV DNA<29 IU/ml)分别为93%、92%、96%;ALT复常率分别为76%、74%、76%;HBeAg血清学转换率分别为27%、21%、23%。FibroTestTM结果显示,大多数患者的肝纤维化情况维持稳定或有所改善,肝纤维化分期评级较基线下降≥1级的比例分别为60%、61%、45%。5年分析报告的随访240周期间,未观察到基因型耐药(表型耐药结果待定),TAF治疗相关耐药的发生率为0。在安全性方面TDF转换为TAF后可观察到eGFR及尿β2微球蛋白:尿肌酐值(β2M∶Cr)均较换用TAF前有所上升,提示TAF较好的肾脏安全性。在骨密度方便,TDF经治患者换用TAF后,髋/脊柱骨密度平均百分比增加,提示换用TAF可能改善TDF治疗导致的骨流失。欧洲一项随机对照研究[17]中,将TDF治疗48周以上且 HBV DNA持续低于检测下限的CHB患者,随机分为TAF组或继续TDF组,继续治疗48周时,两组各仅有1例患者HBV DNA>20 IU/ml(发生率均<1%);但是,TAF组的骨密度、骨代谢指标及肾小球和肾小管功能指标均优于TDF组,证明TAF能够保持TDF的高效抗病毒活性,但改善了骨、肾安全性。一项多中心回顾性分析[18]及一项多中心前瞻性观察研究[19]发现,在妊娠后期使用TAF治疗HBeAg阳性、HBV DNA>2×105IU/ml孕妇,新生儿出生后常规接受主动和被动免疫,结果显示新生儿均无HBV感染、无出生缺陷和先天性畸形,初步证实了TAF用于阻断母婴传播的有效性和安全性。
3.2 干扰素α(IFNα) 我国已批准PEG-IFNα和IFNα治疗CHB。临床上基本使用PEG-IFNα治疗。PEG-IFNα初治单药治疗多项多中心随机对照临床试验[20-21]显示,HBeAg阳性CHB患者采用PEG-IFNα-2a或国产PEG-IFNα-2b治疗48周,停药随访24周,HBeAg血清学转换率为30.75%~36.3%, HBsAg转换率为2.3%~3%,停药3年HBsAg清除率为11%。PEG-IFNα-2a治疗HBeAg阴性慢性HBV感染者(60%为亚洲人)48周,停药随访24周,HBsAg消失率在停药随访24周、3年、5年时分别为3%、8.7%和12%。在一项以欧洲和亚洲(包括我国)为主的国际多中心、真实世界观察性研究[22]中,曾经接受IFN治疗的CHB患者,844例HBeAg阳性和872例HBeAg阴性随访3年时,HBsAg阴转率为2%和5%;HBeAg阳性者中,治疗12周时HBsAg<1500 IU/ml,则随访3年时HBsAg阴转率为11%;HBeAg阴性者中,治疗12周时HBsAg下降≥10%,则随访3年时HBsAg阴转率为16%。一项对238例经IFN治疗HBsAg阴转者的长期观察[23](中位随访时间为160周)发现,共有18例复发,26、52、78、104周和597周的HBsAg累积复发率分别为 0.84%、 6.29%、 6.88%、8.18%和9.66%, 与性别、年龄和IFN类型以及是否联合NAs均无明显相关性。
PEG-IFNα联合NAs治疗可使部分NAs经治CHB患者获得临床治愈。治疗前HBsAg低水平(<1500 IU/ml)及治疗中HBsAg快速下降(12周或24周时HBsAg<200 IU/ml或下降>1 Iog10IU/ml)的患者,联合治疗后HBsAg阴转的发生率较高[24-26]。但联合治疗的基线条件、最佳疗程和持久应答率等尚需进一步研究。2005年PEG-IFNα在中国上市,专家先后4次更新了《聚乙二醇干扰素α治疗慢性乙型肝炎专家共识》[21],为临床医生科学、合理、正确认识和应用IFN治疗CHB提供参考。PEG-IFNα进一步降低HBV相关HCC的发生率,随访单独应用PEG-IFNα或ETV治疗的CHB患者5年发现,采用PEG-IFNα治疗的患者5年内均未发生HCC;而采用ETV治疗者在随访第4、5年时分别有2例、1例发生HCC,与模型预测发生率差异无统计学意义(P=0.36)[27]。 另一项682例应用NAs、430例应用PEG-IFNα单独或联合NAs治疗的回顾性研究[28]显示,在中位随访时间5.41年时共31例发生HCC,接受PEG-IFNα治疗患者的10年累计HCC发生率明显低于NAs治疗患者(2.7% vs 8.0%,P<0.001)。PEG-IFNα在降低HBV相关HCC发生率方面的作用值得进一步深入研究。
4 CHB治疗的管理
CHB抗病毒治疗期间的监测非常重要,通过监测相关指标评估患者治疗的依从性、治疗的长期疗效、药物不良反应、NAs耐药发生、疾病进展以及HCC的发生[4]。监测的指标包括生化学指标:肝肾功能、电解质、心肌酶学、血脂等;病毒学和血清学标志物:HBV DNA定量和HBsAg、HBeAg、抗-HBe等;肿瘤指标:甲胎蛋白、异常凝血酶原;肝脏影像学:肝脏硬度值测定、B超或CT或MR等。根据病情及使用药物需要,检测血常规、甲状腺指标、肾小管功能、免疫指标等。管理慢性CHB还须关注患者的情绪、心理状态、基础疾病、家族史以及少见或罕见的不良反应等。
5 存在问题和展望
慢性HBV理想的治疗目标是功能性治愈即HBsAg持续检测不到,伴或不伴HBsAg血清学转换,因为HBsAg消失意味着患者对HBV产生了免疫力,预后良好[4]。而目前慢性HBV的治疗方法存在一定局限性,NAs需要长期治疗,HBsAg和HBeAg血清学清除率低,停药后复发率高;PEG-IFNα需注射给药、不良反应较多、耐受性较差,失代偿期肝硬化禁用,代偿期肝硬化慎用,因而适应人群范围较窄,除优势人群外其有效率较低,因而总体成本效果比也不高。现有的CHB治疗方法的局限性导致慢性HBV感染的检测和治疗的接受率较低。随着对HBV病毒学和免疫发病机制的不断深入及发展,研发以功能性治愈为目标的新型药物,并评价其与现有药物的协同、联合等作用,帮助CHB患者早日彻底清除血清HBsAg,实现功能性治愈,是未来HBV治疗和发展的重要方向。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献说明;陈学福参与文章设计及撰写;张东敬参与文献检索及分析;罗晓丹参与起草文章的部分内容和文献检索;陈仁参与修改文章的关键内容。

