牛卵巢卵泡Smad9 表达模式的研究
郭翔宇,贾凯琪,韩 琦,马晓燕,党文庆,王 锴,李雅婷,李鹏飞,吕丽华*
(1.山西农业大学动物科学学院,山西太谷 030801;2.山西农业大学生命科学学院,山西太谷 030801)
哺乳动物卵巢卵泡从早期腔前卵泡到成熟卵泡的发育受不同内源性因素的调节,其中,BMP/Smad 信号通路在其发育的不同阶段发挥了不可替代的作用[1-8]。Smads 蛋白(Smad1-9)在TGF-β家族的转录调节过程中起重要作用[9-11],细胞外的BMPs 配体激活细胞上的I 型和II 型受体,并激活Smads 蛋白将细胞外信号传递到细胞核中,并且每一个Smads 蛋白在信号传递过程中起不同的作用[12-13]。按功能作用不同,Smads 分为受体激活型R-Smads(Smad1/2/3/5/8/9)、共调节型Co-Smad(Smad4)和抑制型I-Smads(Smad6/7)三大类,其中,Smad1/5/8/9 调节BMPs 信号转导[14]。Tsukamoto 等[15]研究表明,虽 然Smad9 与Smad1 和Smad5 具有高度相似的结构,但Smad9 降低BMP 活性,抑制了Smads 的转录活性。Katakawa 等[16]研究也表明,Smad8/9在mRNA 水平上通过BMP 途径调控,是一个独特的R-Smad;Xu 等[17]研究发现,Smad9 蛋白参与鹅卵泡发育的启动,并通过外显子1 和内含子2 的同义突变改变鹅的产卵量;Yu 等[18]通过体内和体外试验表明,Smad9 参与鹅卵泡的发育。因此,Smad9 在BMP/Smad 信号通路的调节中起至关重要的作用。张小辉[19]通过生物信息学分析表明,牛Smad9基因在不同的组织中广泛表达,但尚未在牛卵巢卵泡中具体研究其表达和定位。本研究通过免疫组化对Smad9 进行免疫定位,并检测Smad9基因和Smad9 蛋白在牛小、中、大卵泡颗粒细胞中的表达,为Smad9基因和Smad9 蛋白在牛卵巢卵泡中的功能研究奠定基础。
1 材料与方法
1.1 实验材料 从山西省吕梁市文水县屠宰场采集健康且发情周期处于第II、IV 阶段的成年母牛卵巢[20]。
1.2 实验试剂 RNAiso Plus、反转录试剂盒、TB GreenTMPremix Ex TaqTMII(日本,TaKaRa);增强型RIPA 裂解液、蛋白酶抑制剂(PMSF)、封闭蛋白干粉、4%多聚甲醛、SDS-PAGE 凝胶制备试剂盒、硝酸纤维素薄膜(NC 膜)、苏木素(武汉,博士德生物工程有限公司);SP Rabbit HRP Kit(DAB)、蛋白上样缓冲液(5X)(北京,康为世纪生物科技有限公司);M5 Prestained Protein Ladder with 45 ku(10~180 ku)(北京,聚合美生物科技有限公司);Rabbit Anti-SMAD9 antibody (bs-4253R)(北京,博奥森生物技术有限公司);β-actin polyclonal antibody(美国,BioWorld)、IRDye800CW Goat anti-Rabbit(美国,LI-COR);无水乙醇、二甲苯、异丙醇、氯仿等分析纯试剂为国产试剂;引物均来自上海生工生物工程股份有限公司。
1.3 实验方法
1.3.1 分离牛小、中、大卵泡并收集颗粒细胞 成年母牛屠杀后,用灭菌4℃杜氏磷酸缓冲液(DPBS)清洗卵巢2 次,去除血液,分离卵泡,并按照相关文献[21-24]将收集到的卵泡分为小(2 mm ≤直径≤4 mm)、中(4 mm<直径<8 mm)、大(直径≥8 mm)3 类,再次用DPBS冲洗卵泡,去除卵泡表面的组织块,分别放入装有PBS的3 个表面皿中,用注射器扎破卵泡,将卵泡剪开,用刮刀刮取卵泡内壁颗粒细胞,收集含有颗粒细胞的PBS于15 mL 管内,800×g 离心5 min,留沉淀,保存于-80℃备用。
1.3.2 牛卵巢卵泡免疫组织化学 将分离得到的不同直径的卵泡浸于盛有4%多聚甲醛的50 mL 离心管中,4℃过夜。脱水包埋于石蜡中,制成6 μm 的石蜡切片,在3% H2O2中浸泡10 min,再使用柠檬酸钠缓冲溶液进行抗原热修复。Smad9 抗体以1:100 的比例进行稀释,一抗孵育过夜,在37℃温箱中复温30 min,PBS 洗涤2 次,3 min/次,二抗孵育10 min,PBS 洗涤2 次,3 min/次,配置DAB 显色液,进行DAB 染色,达到最佳染色效果后,自来水冲洗,终止显色。用苏木精对切片复染后,将切片脱水,中性树脂封片,用生物显微镜观察并进行拍照。
1.3.3 RT-qPCR 按照RNAiso Plus 说明书要求,向样品中添加RNAiso Plus,依据Trizol 法获得每组颗粒细胞的RNA。用核酸测定仪测定每组RNA 浓度,将RNA反转录成cDNA。引物序列见表1,根据GenBank 中收录的牛(Bos taurus)Smad9基因(NM_001076928.1)mRNA 序列设计引物,选用RPLP0作为qPCR 试验的内参基因。按照荧光定量试剂盒说明,反应体系10 μL:Sense Primer 0.4 μL(0.4 μmol/L),Anti-sense Primer 0.4 μL(0.4 μmol/L),TB Green Premix Ex Taq II(2X)5 μL,去RNA 酶H2O 3.2 μL,cDNA 模 板1 μL(100 ng)。反应条件:95℃ 30 s;95℃ 5 s,60℃ 30 s,循环45 次;95℃ 15 s,60℃ 1 min,95℃ 5 s。每个样做3 个检测重复。
1.3.4 Western Blotting 将增强型RIPA 裂解液(含1%PMSF)向收集小、中、大卵泡颗粒细胞的1.5 mL离心管中各加200 μL,30 min 后4℃离心,通过BCA法测定蛋白浓度。以4:1 的比例将蛋白与蛋白上样缓冲液(5')混匀,100℃变性10 min。通过非还原的10%SDS/PAGE 凝胶分离蛋白,并将蛋白转移到NC 膜上,其中,电泳条件:80 V 30 min;120 V 80 min;转膜条件:100 V 90 min。然后将NC 膜用5% 脱脂奶粉溶液孵育1 h。之后用TBST 洗3 次,5 min/次,然后将Rabbit Anti-SMAD9 antibody 与TBST 以1:500 稀释,4℃孵育过夜(12~16 h),用TBST 洗3 次,8 min/次,避光孵育二抗(1:18 000)1 h。用TBST 洗3 次,8 min/次,再将NC 膜浸于TBS 中5 min。将NC 膜置于Odyssey CLx 中依次曝光。
1.4 统计分析 qPCR 数据运用2-ΔΔCT法进行分析,内参基因为RPLP0基因。Western blotting 数据用Image J和Image Studio Ver 进行分析,内参蛋白为β-actin。数据重复3 次,且均经SPSS 22.0(IBM SPSS Statistics 22.0)进行单因素方差分析,数据用平均值±标准差表示,P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果
2.1 Smad9 在牛小、中、大卵泡中的定位分析 使用Smad9 抗体对牛卵巢切片进行免疫染色(400'),结果如图1 所示,对照组无特异性免疫染色,实验组Smad9在颗粒细胞层和膜细胞层中有免疫反应。实验组Smad9在小卵泡和中卵泡颗粒细胞层中有明显的免疫反应,呈颜色较深的棕褐色,而在大卵泡颗粒细胞层中免疫反应弱,呈颜色较浅的棕黄色;与颗粒细胞层相比,Smad9在小卵泡和大卵泡膜细胞层中免疫反应较弱,呈颜色较浅的棕黄色,而中卵泡与小卵泡、大卵泡相比免疫反应较强,呈棕褐色。

图1 牛卵泡Smad9 的表达(400×)
2.2Smad9在牛小、中、大卵泡颗粒细胞中的mRNA表达 如图2 所示,小卵泡和中卵泡GC 中Smad9mRNA 转录本相对丰度低于大卵泡GC(P<0.01),而中卵泡的GC 内Smad9mRNA 转录本相对丰度低于小卵泡(P<0.05)。
2.3 Smad9 在牛小、中、大卵泡颗粒细胞中的蛋白表达如图3 所示,以β-actin 为内参,小、中、大卵泡的颗粒细胞中Smad9 蛋白表达量有差异。大卵泡颗粒细胞中Smad9 蛋白含量约为小卵泡的1.4 倍(P<0.01),约为中卵泡的1.5 倍(P<0.01),而中卵泡GC 中Smad9蛋白含量是小卵泡的0.9 倍(P<0.05)。
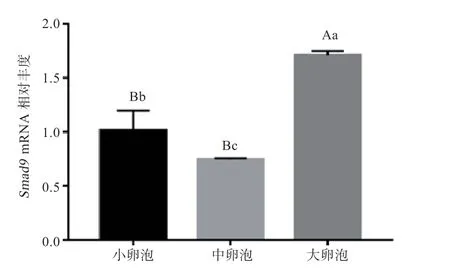
图2 小、中、大卵泡中Smad9mRNA 相对丰度(n=3)

图3 小、中、大卵泡中Smad9 蛋白相对表达量(n=3)
3 讨 论
牛属于单胎哺乳动物,卵泡发育过程包括卵泡的募集、选择、优势化以及闭锁和成熟卵泡的排卵过程[25]。卵泡募集过程中,每个卵泡发育波有4~10 个直径约为4 mm 的卵泡进行募集[26]。募集完成后,只有1~2 个卵泡被选择变为优势卵泡,其他卵泡变为从属卵泡[27],此时优势卵泡约为8 mm,其他卵泡受激素影响将闭锁退化。牛卵泡在进行募集过程中卵泡的大小为2~4 mm,卵泡选择过程中卵泡的大小为4~8 mm,卵泡的优势化后卵泡的直径大于8 mm,即小卵泡(2 mm ≤直径≤4 mm)、中卵泡(4 mm<直径<8 mm)、大卵泡(直径≥8 mm)[24],牛卵泡的发育过程受多种内源性因素调控,其中BMP/Smad 信号通路起关键作用。
在BMP/Smad 信号通路中,Smad9 是重要的转录调节因子,在不同组织中广泛分布,同时调节多种类型细胞的生长发育[16,19],Tsukamoto 等[15]研究表明Smad9 是一种新型转录调节因子,Smad8/9 在BMP/Smad 信号通路中有显性负调节作用。Yu 等[18]通过分离鹅的不同大小卵泡进行免疫组化试验,首次揭示了Smad9 在不同发育阶段卵泡的颗粒细胞层中特异性表达。同时,余道伦[28]研究表明,Smad9 仅在小鼠卵泡的颗粒细胞层中表达。本研究通过免疫组化试验显示,Smad9 在牛小、中、大卵泡的颗粒细胞和膜细胞层中有表达。Smad9 在不同物种的定位不同表明其具有物种特异性。Yu 等[18]研究表明,在鹅不同大小的卵泡中Smad9 的蛋白质和mRNA 表达有差异,揭示了Smad9蛋白和mRNA 表达的时空模式。本研究结果显示,在基因和蛋白水平上Smad9 表达存在差异,大卵泡的颗粒细胞中Smad9 的相对表达量与小卵泡、中卵泡差异极显著,而小卵泡的颗粒细胞中Smad9 的相对表达量与中卵泡存在显著差异,提示Smad9 可能调节卵泡的募集、选择与优势化过程。Xu 等[17]研究发现,Smad9具有高度保守的结构域,Smad9与鹅卵泡的生长发育密切相关,并且Smad9mRNA 和Smad9 蛋白质的表达影响雌二醇的分泌、LHR的表达以及颗粒细胞的增殖。余道伦等[28]在使用RNA 干扰技术干扰Smad8 后,发现小鼠卵泡的颗粒细胞分泌雌二醇的能力减弱,并且LHRmRNA 表达水平下降,颗粒细胞的增殖明显减弱。王和建等[29]通过小鼠腹腔注射BMP4,诱导Smad9 的表达增加,促进有腔卵泡的数目增多。Zhang 等[30]研究表明,Smad9 与雌二醇的分泌和LHR 的转录呈正相关,并影响颗粒细胞增殖。由此得出,Smad9 影响颗粒细胞的增殖和类固醇激素的分泌,从而影响卵泡的发育。本研究中Smad9 在牛小、中、大卵泡的颗粒细胞中表达存在差异,推测Smad9 可能调节牛卵泡的募集、选择和优势化过程。因此,下一步将进行Smad9 的功能研究,为改善母牛繁殖能力提供新思路。
4 结论
本实验结果显示,牛卵泡的颗粒细胞层中有Smad9表达,不同直径卵泡的颗粒细胞中Smad9 的表达量不同,Smad9 大卵泡中的表达量极显著高于小卵泡和中卵泡。因此,Smad9 可能参与有腔卵泡的发育过程。

