血清CA199、CA125 与CEA 联合检测在胰腺癌病情诊断与预后评估中的指导作用
邓珠连
(雷州市人民医院,广东 雷州 524200)
0 引言
胰腺癌属于一种恶性程度很高的肿瘤疾病,由于病灶位置较深,被消化道器官大面积遮盖,不能及时发现具体病变位置,对患者的临床诊断和治疗造成较大的困难[1]。近年来,随着社会经济的发展,人们的饮食结构和饮食习惯得到了极大的改变,不良的生活习惯导致胰腺癌分发病率和死亡率增加,临床统计发现胰腺癌患者的5 年生存率仅为10%,严重影响患者的生存质量和生活质量[2]。随着生化技术的发展与改进,国内外研究发现血清糖蛋白抗原199(Clucoprotein antigen 199,CA199)、糖蛋白抗原125(Clucoprotein antigen 125,CA125)与癌胚抗原(Carcinoembryonic antigen,CEA)可用于诊断胰腺癌[3]。基于此,本文选取我院2018 年1 月至2020 年6 月收治的60 例胰腺癌患者与60 例健康体检者患者进行分析,总结血清肿瘤标志物的监测方法,试探讨其对胰腺癌的应用价值,为临床相关研究提供参考依据,现报告如下。
1 资料与方法
1.1 一般资料
共计60 例胰腺癌患者,均选自我院2018 年1月至2020 年6 月期间,60 例患者列为研究组,另选择60 例健康体检者列为对照组。研究组中男40例,女20 例;患者所处年龄范围为36~72 岁,平均(53.84±3.16)岁;疾病情况:无淋巴结转移患者47 例,淋巴结转移、脏器转移患者13 例;疾病类型:导管细胞癌50 例,胰泡细胞癌10 例;疾病分期:Ⅰ期患者有13 例,Ⅱ期患者有29 例,Ⅲ期患者有18 例。对照组中男38 例,女22 例;患者所处年龄段为20~78 岁,平均(54.16±3.82)岁。对比分析两组患者的性别、年龄,具有可比性(P>0.05)。
纳入标准:①研究组患者经病理学检查、螺旋CT、MRI 等检查确诊为胰腺癌;②120 例患者及患者家属同意加入研究并签字;③本次研究符合我院医学伦理会标准,并经过委员会同意;④患者的精神正常,能够与医护人员进行沟通。
排除标准:①合并其他恶性肿瘤的患者;②患者的心肝肾等器官存在严重的器质性病变;③精神或语言功能异常,无法进行简单交流的患者;④一般资料缺失的患者;⑤患者的依从性极差,无法配合完成研究;⑥患者合并血液系统疾病或全身感染。
1.2 方法
两组患者均接受血清CA199、CA125 与CEA 联合检测,具体检测流程为:①标本采集方法:提前告知患者抽血时间以及注意事项,叮嘱患者保持空腹,在无菌环境下采用静脉抽血的方法抽取4mL 外周静脉血液作为检查标本,将其放置在普通干燥管中静置,标本收集完成后将其进行离心分离,分离时间为10min,离心速度为每分钟3000r,取血清后放入温度为-20℃的冰箱中保存备用。②血清肿瘤标志物的检测方法,采用化学发光免疫分析仪检测血清糖蛋白抗原199(CA199)、糖蛋白抗原125(CA125)与癌胚抗原(CEA),本次研究所使用的全自动化学发光免疫分析仪来自于SIEMENS,型号为ADVIA Centaur XP。严格按照说明书进行操作,保证每一个步骤的规范性,确保检测结果的正确性,防止发生错误操作影响实验结果,检测得出数据后进行记录并比较所得结果。
1.3 观察指标
(1)比较两组患者血清CA199、CA125 与CEA的检测结果。血清CA199 的正常范围为0~40U/mL;血清CA125 的参考范围为0~35U/mL;血清CEA 的正常范围为0~5ng/mL[3]。判断标准:检测结果高于正常范围则评定为阳性,检测结果低于正常范围则评定为阴性(正常)[5]。
(2)统计单独检测与联合检测的诊断价值。
(3)对60 例胰腺癌患者开展随访,统计生存期。
1.4 统计学方法
2 结果
2.1 对比分析两组患者血清肿瘤标志物指标检测结果的差异
从表1 的结果能够看出,在血清CA199、CA125与CEA 上,研究组明显高于对照组,两组比较有差异(P<0.05)。
表1 对比分析两组患者血清肿瘤标志物指标检测结果的差异()

表1 对比分析两组患者血清肿瘤标志物指标检测结果的差异()
2.2 对比分析研究组患者单独检测与联合检测的差异
从表2 的结果能够看出,在诊出率上,血清CA199+CA125+CEA 联合检测明显高于单纯血清CA199检测、血清CA125 检测、血清CEA 检测(P<0.05)。
2.3 比较研究组患者术前单独检测与联合检测对生存期的影响
对60 例胰腺癌患者进行随访,发现患者的生存期为2~36 个月。从表3 的结果能够看出,在中位生存时间上,血清CA199+CA125+CEA 联合检测明显长于单纯血清CA199 检测、血清CA125 检测、血清CEA 检测(P<0.05);单纯血清CA199 检测、血清CA125 检测、血清CEA 检测之间比较差异不明显(P>0.05)。

表2 对比分析研究组患者单独检测与联合检测的差异[n(%)]
表3 对比分析研究组患者术前单独检测与联合检测对生存期的影响()
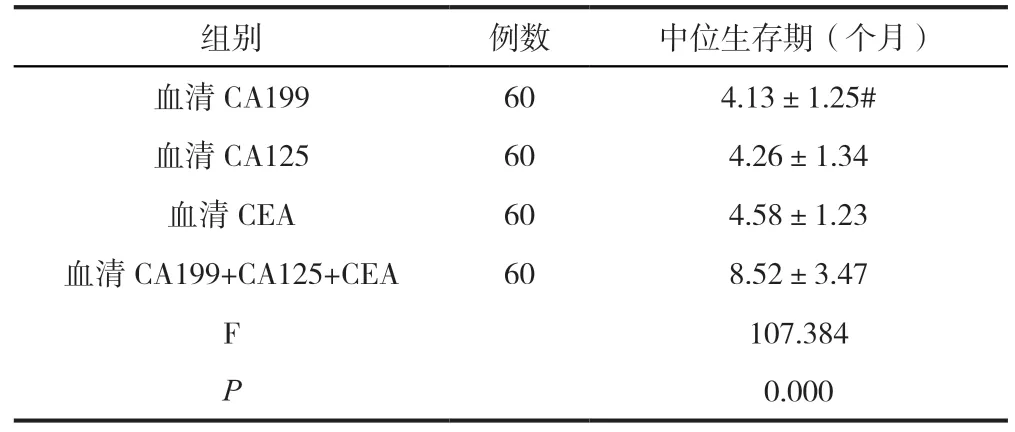
表3 对比分析研究组患者术前单独检测与联合检测对生存期的影响()
注:#表示与血清CA125、血清CEA 相比较,P>0.05。
3 讨论
胰腺癌是临床上比较常见的恶性肿瘤疾病,其病灶组织主要位于腺管上皮细胞,90%以上的胰腺癌属于管腺癌,具有较高的发病率和死亡率,胰腺癌是所有恶性肿瘤疾病中5 年生存率最低[6]。胰腺恶性肿瘤主要来自于胰腺外分泌腺、内分泌腺或非上皮组织,其中95%为胰腺癌[7]。胰腺癌在临床上多表现为上腹不适、腹泻、食欲减退、腹痛、黄疸等,给患者的生活质量与生存质量带来极大的不良影响[8]。胰腺癌的预后效果最差,具有较高的发病率和死亡率。胰腺癌早期没有典型的临床特征,早期诊断正确率较低,对患者的生命安全造成严重威胁。因此,临床加强对胰腺癌的诊断是非常重要的,能够快速确定疾病类型,做好对症治疗,提高患者5年存活率。
作为实验室检测手段之一,血清CA199 在成年人体内的浓度较低,是临床公认的评估胰腺癌的肿瘤标志物,也属于一种非特异性肿瘤相关抗原,目前已广泛用于肿瘤疾病的临床诊断中[9]。CA199 是一种类黏蛋白与糖蛋白成分的肿瘤标志物,具有较好的光谱性,正常值范围:<40U/mL[10]。血清CA199 在肿瘤患者体内浓度会上升,且在胰腺癌患者中上升情况更明显。CA19-9 对于胰腺癌、胆管癌、结直肠癌具有较高的敏感度,特别是对于胰腺癌晚期患者,其体内CA19-9 在血液中的含量可高达40×104U/mL,诊断阳性率也高达74.9%[11]。在胃癌、结直肠癌、肝癌患者中,其CA19-9 阳性诊断率也约有50%~65%,确该肿瘤标志物和肿瘤的预后有着避免关系[12]。部分肝炎、黄疸、胰腺炎以及胆汁淤积导致的胆管炎患者也可能出现CA19-9 水平升高的现象。虽然血清CA199 在胰腺癌的诊断中作用重大,但是不能将血清CA199 作为胰腺癌与胰腺良性疾病的鉴别诊断指标[13]。
综上所述,血清CA199、CA125 与CEA 水平在胰腺癌中均上升,可作为胰腺癌的诊断指标,能够充分反映患者胰腺功能受损情况,为患者病情和预后的判断提供了科学依据,临床应用价值明显,值得进一步推广和应用。

