氧缺陷三氧化钨纳米线阵列高效电催化合成氨
曹茂启,龙成梅,孙赛兰,徐 平,吴大旺
(黔南民族师范学院化学化工学院,贵州都匀558000)
氨对食品、化工和能源有着重大影响[1-3],有效激活惰性 N2合成氨具有重要的意义[4]。 用氮气生产氨是化学领域引人瞩目的重要课题之一。 由于N2分子最低未占分子轨道(LUMO)与最高占据分子轨道(HOMO) 的能级差高达 10.82 eV,N2分子很难被高效活化[5]。 20 世纪初,哈伯-博施研发了一种由大气中的氮制氨的方法(哈伯-博施法),从而有效提高了合成氨产量。 虽然哈伯-博施法合成氨(N2+H2⇌NH3)是一个热力学上的放热过程,但为了使这个反应向有利于氨的方向进行, 需要高达400~500 ℃的反应温度和 10~30 MPa 的压力。 哈伯-博施法合成氨的过程能耗较大, 同时还会产生大量的温室气体CO2。 因此,氮合成氨的过程需要向高性能、低成本和环保的方向创新发展, 这对基础科学和工程领域都提出了严峻的挑战[6]。
近年来,常温、常压下电催化合成氨引起了人们强烈的研究兴趣,并取得了较大的进展[7],这不仅适用于目前的肥料工业, 而且也适用于先进的能源系统[8]。 液氨有着高达 4.32(kW·h)/L 的能量密度和便利的运输性,是一种理想的能源载体。利用清洁能源(风能、太阳能、水能等)产生的电能在常温、常压条件下将N2在水溶液中高效电化学还原合成氨具有重要的现实和理论意义[9]。与能耗较高的传统哈伯-博施工艺相比,这种电化学N2还原合成氨工艺具有可持续性的优点。然而,由于N≡N 键很强的惰性,其与固态催化剂之间的结合较弱, 导致电化学合成氨的效率普遍偏低。因此,合成高效的催化剂来增强N2的吸附和活化、 从而提高电催化N2还原合成氨效率迫在眉睫[10]。
在晶体结构中引入缺陷来调节材料的化学和物理性能是一种提高材料电催化性能的有效策略[11-12]。 通过在金属化合物上制造阴离子缺陷调节相邻金属原子的电子结构以及相应的反应物和中间体的能垒可以有效提高N2电催化还原合成氨活性。由于氧缺陷在金属氧化物中的生成能较低, 氧缺陷的金属氧化物是目前报道较多的阴离子空位缺陷工程催化剂材料,对电催化还原N2合成氨表现出优异的性能。
本文采用Ar+等离子体轰击策略在WO3的纳米线阵列上产生丰富的氧缺陷,氧缺陷WO3的纳米线阵列(V-WO3)电催化活化N≡N 键,从而在环境条件下实现了高效的直接氨合成。 氧元素的X 射线光电子能谱测试表明,V-WO3催化剂具有丰富的氧缺陷, 氧缺陷是导致N2高效电催化转化为NH3的原因。
1 实验部分
1.1 试剂与仪器
试剂:Na2WO4·2H2O、H2C2O4(尿素)、(NH4)2SO4,均为分析纯,阿拉丁试剂有限公司提供;丙酮、乙醇,均为分析纯,国药试剂有限公司提供;盐酸,国药试剂有限公司提供。 导电碳布(W0S1009,台湾碳能)。
仪器:SP-H550 型磁力搅拌器、HR 系列水热反应釜;LRH-150 型恒温箱;KSL-1100X-S 1L 型箱式电阻炉;PECVD-Y12IIH-3Z/G 型等离子体气相沉积系统。
1.2 WO3 及V-WO3 纳米线阵列的合成方法
V-WO3纳米线阵列通过二步法合成,如图1 所示。 由于碳布具有良好的导电性和易于反应物快速扩散的三维多孔结构,因此被选择作为生长基底。
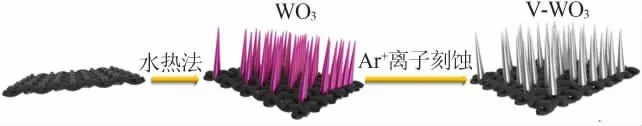
图1 V-WO3 纳米线阵列的合成示意图Fig.1 Synthesis diagram of V-WO3 nanowire arrays
1.2.1 WO3 纳米线阵列的合成
将 25 mmol Na2WO4·2H2O 均匀溶解到 200 mL去离子水中,逐滴加入3 mol/L 的HCl 溶液至pH 为1.2,此时溶液颜色由无色变为淡黄色,再依次加入70 mmol H2C2O4、10 g(NH4)2SO4,搅拌使其充分溶解。取上述溶液40 mL 加入到50 mL 的聚四氟乙烯水热反应釜中,将一块大小为2 cm×4 cm 且已在丙酮、去离子水和乙醇中分别超声处理后的碳布, 垂直放入装有40 mL 溶液的聚四氟乙烯水热反应釜中。 最后将聚四氟乙烯水热反应釜密封后放入180 ℃烘箱中16 h。 水热反应釜温度降至室温后,取出导电碳布至80 ℃烘箱中干燥12 h。 干燥后的碳布在箱式电阻炉中450 ℃煅烧2 h 即可得到均匀生长在碳布上的WO3纳米线阵列,原位生长可以使制备的电极与碳布密切接触。
1.2.2 V-WO3 纳米线阵列的合成
以氩气为载气, 在等离子体气相沉积系统(PECVD-Y12IIH-3Z/G)中处理 WO3纳米线阵列,等离子体气相沉积系统的压力通过一个连接的真空泵控制在30 Pa 左右、采用的功率为100 W、处理时间为100 s。 等离子体气相沉积系统中产生丰富的Ar+对WO3纳米线阵列进行刻蚀,即可得到氧缺陷的V-WO3纳米线阵列。
1.3 结构表征
采用RINT-2000 型粉末X 射线衍射仪测量得到WO3及V-WO3纳米线阵列的晶体结构;采用FEI Sirion-200 型扫描电镜观察WO3及V-WO3纳米线阵列的形貌结构;采用Escalab MKⅡ型X 射线光电子能谱仪测量获得WO3及V-WO3纳米线阵列的微观电子结构信息。
1.4 电化学性能测试
通常情况下,氮气(纯度为99.99%)的还原是在室温下用Nafion 211 膜分离的H 型电解池中进行。在电催化合成氨实验前,Nafion 211 膜分别在H2O2(质量分数为5%)水溶液和超纯水中80 ℃加热1 h。所有电化学表征均在CHI 760E 电化学工作站的三电极系统中完成。 生长在碳布上的WO3及V-WO3纳米线阵列作为工作电极,Hg/HgO 电极作为参比电极,石墨棒作为对电极。 利用方程(1)将所有电势转换为相对可逆氢电极(RHE)的数值,经过多次循环后极化曲线为稳态曲线。电催化合成氨在N2饱和的0.1 mol/L 的 KOH 溶液中进行,测量前用 N2净化30 min。 实验过程中,在适当的位置将纯N2连续输入阴极室。 分别在-0.1、-0.2、-0.3、-0.4、-0.5 V 的恒压下进行电催化合成氨反应,测试时间为2 h。
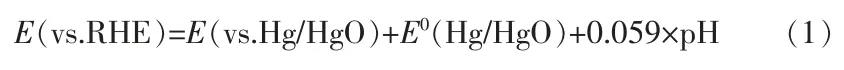
1.5 NH3 的定量分析测试及法拉第效率的计算
用奈氏试剂法对电催化合成的氨进行定量测试, 利用波长420 nm 的吸光度测定合成氨的浓度,用不同浓度的标准氯化铵溶液进行浓度-吸光度曲线的校准。
电催化合成氨的法拉第效率被定义为用于合成氨的电量除以电解过程中通过电极的总电量。 假设生成一个NH3分子需要3 个电子,可以计算出法拉第效率:
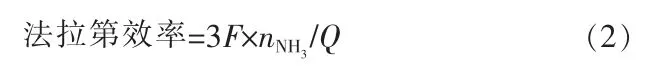
式中,F 为法拉第常数;Q 为电催化还原过程中消耗的总电子数。
2 结果与讨论
图2 为碳布、WO3及V-WO3纳米线阵列的XRD谱图。 由图2a 可见,26°的主峰为典型的碳布峰位置,Highscore 晶体结构分析软件发现 WO3及V-WO3主要峰位置中并没有出现典型的碳布峰位置, 证明了本研究合成的WO3及V-WO3纳米线阵列均匀地覆盖在了碳布上, 致使碳布的峰位置未被检测到。 由图2b 可见,WO3及 V-WO3的衍射峰与WO3标准卡片(JCPDS 01-085-2460)衍射峰基本一致,通过对比其峰位置发现Ar+的刻蚀并没有明显改变V-WO3纳米线阵列的晶体结构。(3c~3d) 纳米线阵列扫描电镜照片。 从图3 可以看出,碳布上均匀覆盖了一层纳米线阵列。 经过Ar+刻蚀处理后,虽然V-WO3依然保持了纳米线阵列的形态结构,但表面相比WO3粗糙了一些,这是由于Ar+刻蚀的原因。
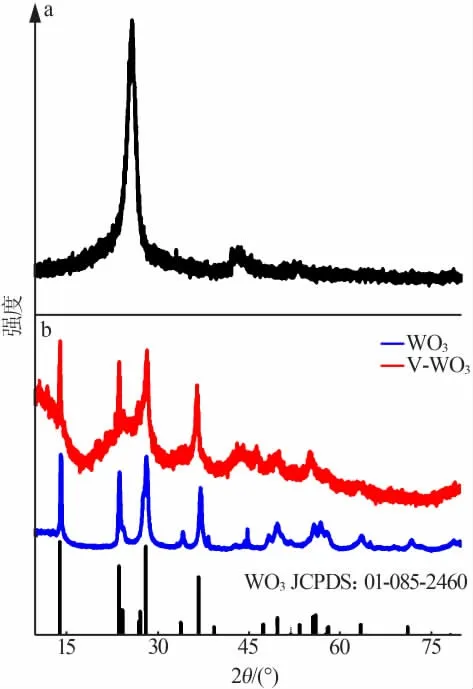
图2 碳布(a)和 WO3、V-WO3(b)纳米线阵列的 XRD 谱图Fig.2 XRD of carbon cloth(a)and WO3,V-WO3 nanowire arrays(b)
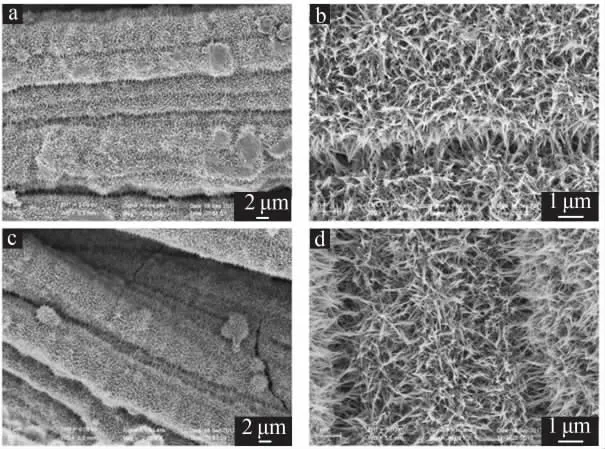
图3 WO3 及V-WO3 纳米线阵列的SEM 照片Fig.3 SEM of WO3and V-WO3 nanowire arrays
图4 为 WO3及V-WO3中 O 和 W 的 XPS 谱图。 由图4a 可见,O1、O2 为初始 WO3中 O 1s 的 2 个氧峰,图4c 为 Ar+刻蚀后 V-WO3的 O 1s 3 个氧峰。 O1 峰所在的529.2 eV 的位置为典型的金属氧键, 而O3所在的531.2 eV 是表面氧缺陷所在的典型位置[13]。从图4b、4d 可以看出,虽然 WO3及 V-WO3中 W 的XPS 谱图比较相似, 但从峰位上来看,V-WO3中W的结合能偏低,这是由Ar+刻蚀后产生的氧空位导致的。XPS 测试表明,Ar+刻蚀后的V-WO3有着丰富的氧空位存在,依据XPS 分峰面积定量分析表明V-WO3氧空位的含量约为37.8%。
图5a 为 WO3和 V-WO3分别在饱和的 Ar 及 N2溶液中的电流极化曲线。由图5a 可见,在通有N2的1 mol/L KOH 溶液中,WO3纳米线阵列的电流极化曲线在-0.5~-0.1 V 的电压范围内大于通有稀有气体Ar 时的电流,但变化不明显。但V-WO3纳米线阵列的电流极化曲线在-0.5~-0.1 V 的电压范围内明显大于通有稀有气体Ar 时的电流,意味着电催化固氮高效地发生在了V-WO3纳米线阵列上。
而当负电势较大时,饱和Ar 电解质中的阴极电流超过了饱和N2电解质,这是由于析氢反应在这一电压范围内占主导地位。换句话说,电压是平衡电催化合成氨和电催化析氢反应之间竞争的一个重要影响因素。 为此,本研究在V-WO3纳米线阵列工作电极上施加恒电势的条件下(-0.1、-0.2、-0.3、-04、-0.5 V)进一步进行电催化合成氨实验。
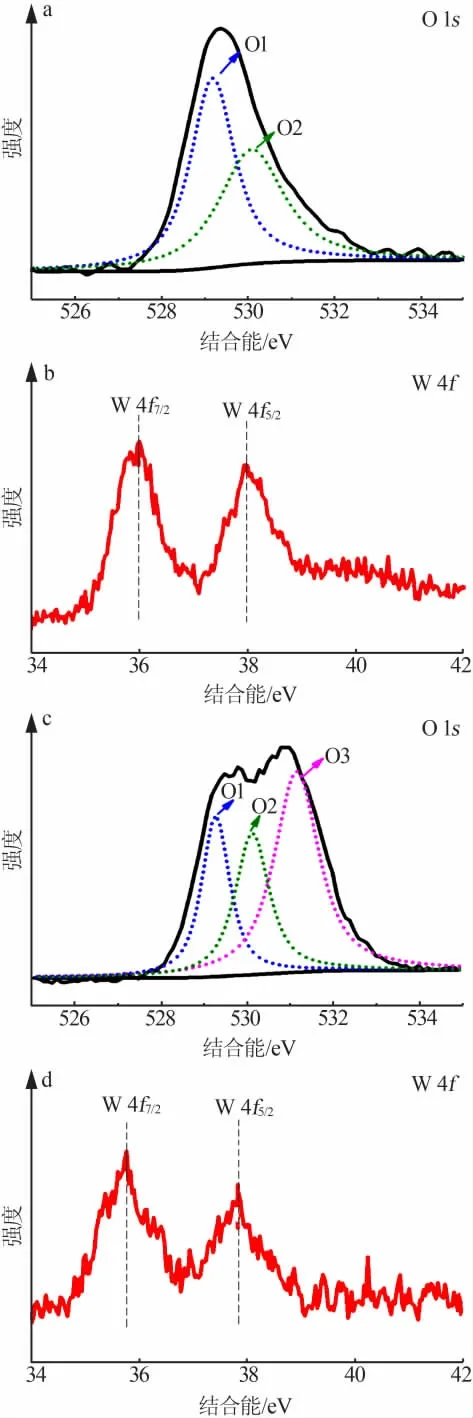
图4 WO3 和 V-WO3 的 XPS 谱图Fig.4 XPS of WO3 and V-WO3
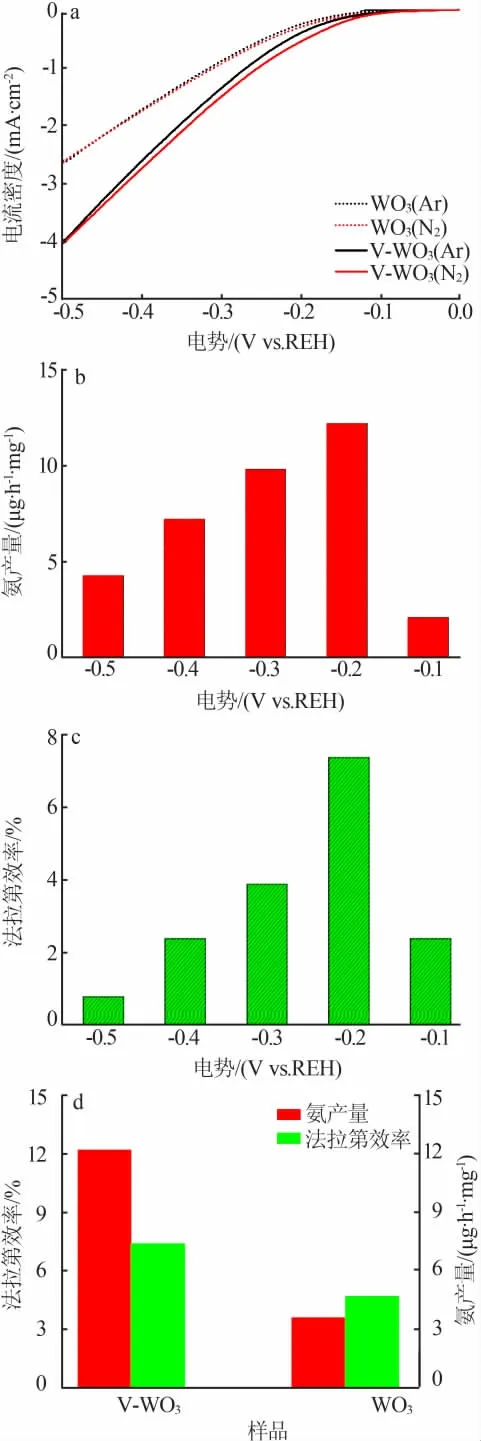
图5 WO3 和 V-WO3 分别在饱和的 Ar 及 N2 溶液中的电流极化曲线(a);V-WO3 在不同电势时的氨产量(b)和法拉第效率(c);WO3 及 V-WO3 在-0.2 V 时的氨产量和对应的法拉第效率(d)Fig.5 Current polarization curve of WO3 and V-WO3 in the Ar and N2 saturated solution(a);the NH3 yield of V-WO3 at different voltages(b);the Faraday efficiency of V-WO3 at different voltages(c);the NH3 yield and Faraday efficiency of WO3 and V-WO3 at-0.2 V(d)
图5b 为恒定电势(-0.1、-0.2、-0.3、-04、-0.5 V)下的NH3产量。 从图5b 可见,在恒定电势为-0.1 V时,NH3产量为 2.4 μg/(h·mg)。 当电压增至-0.2 V时,NH3的产量达到最高[12.4 μg/(h·mg)]。 随着电压的进一步增加,NH3产量逐渐减少,导致这种现象的一个主要原因是高电压下电催化析氢反应占了主导地位。 恒定电势下对应的法拉第效率(图5c)与恒定电势下的NH3产量表现出了类似的趋势。图5a所示的电流极化曲线可以证明这些结果,在饱和Ar和N2的电解质中测量到的最大间隙出现在-0.2 V附近。
为了证实所得的产物来自于V-WO3纳米线阵列电催化还原N2,本实验利用空白的导电碳布作为工作电极,在恒压-0.2 V 时分别在通有氩气和N2条件下进行了2 h 的测试,NH3产量测试分析表明:在通有氩气的条件下没有检测出NH3的生成;但在通有N2条件下, 有微量的NH3生成。 该对比实验表明,催化剂是影响NH3产量关键因素。
图5d 为 WO3和 V-WO3纳米线阵列在-0.2 V时的NH3产量和对应的法拉第效率。 从图5d 可以看出,WO3在-0.2 V 时的法拉第效率为 4.7%、NH3产量为 3.8 μg/(h·mg), 而 V-WO3在-0.2 V 时的法拉第效率为 7.4%、NH3产量为 12.2μg/(h·mg),相比于未刻蚀的WO3纳米线阵列, 刻蚀后的V-WO3纳米线阵列具有更高的NH3产量和更高的法拉第效率,其电催化合成氨性能得到了明显提升。
3 结论
在晶体结构中引入缺陷来调节材料的化学和物理性能是一种提高材料电催化性能的有效策略。 本文采用Ar+等离子体轰击策略在WO3的纳米线阵列上产生丰富的氧缺陷,氧缺陷WO3的纳米线阵列电催化活化N≡N 键, 从而在环境条件下实现了高效的直接氨合成。 氧元素的X 射线光电子能谱测试表明,V-WO3催化剂具有丰富的氧缺陷, 氧缺陷是导致N2高效电催化转化为NH3的原因。

