以可溶性淀粉为晶型调控剂制备多孔球形碳酸钙
胡彩霞 ,胡辰鑫,彭剑龙,钟 星
(1.东华理工大学,江西省大气污染成因与控制重点实验室,江西南昌330013;2.东华理工大学化学生物与材料科学学院)
碳酸钙是自然界及生物体中普遍存在的无机物,广泛应用在涂料、医用品、日用品、造纸和橡胶等行业[1-3]。 碳酸钙主要有 3 种晶型结构:方解石、文石和球霰石。 其中,热力学稳定晶型为方解石,最不稳定的是球霰石型碳酸钙[4-5]。 但由于球霰石特殊的球状结构,具有比表面积高、孔隙率大等优点,球型碳酸钙的制备已成为一个研究热点[6-7]。 研究发现通过添加某些晶型调控剂能制备得到稳定的球霰石型碳酸钙。
目前, 许多课题组研究了球霰石型碳酸钙的制备,常用的球霰石制备方法有 2 种[8]:CO2-Ca(OH)2碳化法与Ca2+-CO32-复分解法。由于碳化法的速率取决于CO2在水中低的溶解速率, 导致碳化法获得的球霰石产率不高。复分解法因其产率高、反应简单易行而受到广泛关注, 但常需要添加晶型调控剂以稳定其晶型和形貌。其中,可溶性晶型调控剂对碳酸钙晶型、形貌和尺寸等有调控作用[9]。
可溶性晶型调控剂主要包括可溶性的小分子、高分子和水溶性表面活性剂等。 谭婷婷等[10]以可溶性小分子硼酸为晶型调控剂, 采用复分解反应制备了方解石型球形碳酸钙,发现硼酸对碳酸钙的形貌、晶型、粒径等有较大的影响。 王君等[6]以表面活性剂羧甲基纤维素钠(CMC)为晶型调控剂获得了微米级碳酸钙微球, 发现CMC 的加入对碳酸钙微球的形貌、孔径、比表面积、表面电荷等有显著的影响。张晓蕾等[11]和郑天文等[12]以高分子聚丙烯酸(PAA)和水溶性表面活性剂十二烷基苯磺酸钠(SDBS)组成的复合晶型调控剂, 利用复分解法制备出高球霰石含量的碳酸钙微球。 丁红霞等[13]采用高分子聚乙烯醇(PVA)和十六烷基三甲基溴化铵(CTAB)组成的复合晶型调控剂获得球状及花状的球霰石。 基于仿生合成的生物高分子晶型调控剂也受到大量学者的关注,研究较多的有蛋白质和多糖类。常见的多糖如葡萄糖、蔗糖、可溶性淀粉和糊精等均对碳酸钙的形貌及晶型具有一定的影响[9,14],王农等[15]以蔗糖、葡萄糖和可溶性淀粉作为晶型调控剂, 采用碳化法获得粒径约为 50 nm 的立方形纳米碳酸钙。 张娟[14]发现可溶性淀粉和糊精两种晶型调控剂可以促进球霰石碳酸钙的形成。 张慧等[16]证实在可溶性淀粉调控下可以得到粒径约为4 μm 的球霰石碳酸钙, 但尚未发现孔状结构, 也尚未探讨工艺条件对碳酸钙形貌及晶型的影响规律。
本文利用复分解反应, 以氯化钙和碳酸钠为合成试剂,以可溶性淀粉(SS)为晶型调控剂,制备出以球霰石晶型为主的碳酸钙多孔微球, 研究SS 添加量、Na2CO3溶液滴加速度、 氯化钙与碳酸钠的物质的量比等工艺条件对碳酸钙形貌及晶型的影响规律,以获得最佳的制备球形碳酸钙的工艺条件,为拓宽碳酸钙的应用领域奠定相关工作基础。
1 实验部分
1.1 试剂与仪器
试剂:无水氯化钙,AR,广东光华科技股份有限公司;无水碳酸钙,AR,天津市大茂化学试剂厂;可溶性淀粉,AR,西陇科学股份有限公司。
仪器:DF-101S 型集热式恒温加热磁力搅拌器;HJ-2 型磁力加热搅拌器;DHG-9140A 型电热恒温鼓风干燥箱;TG16-WS 型高速台式离心机;JSM-7610F 型扫描电子显微镜;UItima Ⅳ型X 射线衍射仪。
1.2 碳酸钙的制备
取一定量的可溶性淀粉加入到100 mL 蒸馏水中,置于恒温水浴锅中,固定搅拌转速500 r/min,加热到80 ℃保持30 min,此时溶液几乎呈透明状。 随后冷却至室温,加入一定量的无水氯化钙,搅拌均匀后,滴入碳酸钠水溶液(0.1 mol/L),室温下搅拌反应5 h。 得到碳酸钙沉淀在10 000 r/min 的转速下离心分离5 min 后,用蒸馏水洗涤3 次,收集样品于60 ℃下干燥12 h 得到产品。 其制备工艺流程如图1 所示。
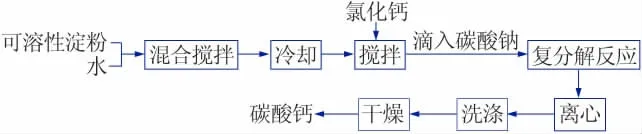
图1 碳酸钙制备工艺流程图Fig.1 Preparation process of spherical calcium carbonate
2 实验结果与讨论
2.1 SS 添加量的影响
实验条件:1.11 g 无水氯化钙(0.01 mol),0.1 mol/L碳酸钠水溶液100 mL,碳酸钠水溶液滴速为10 mL/min。 探 讨 SS 添 加 量 (0、0.2、0.4、0.5、1.0、1.5 g)对CaCO3形貌和晶型的影响,结果见图2。

图2 不同SS 添加量所得碳酸钙的SEM 照片Fig.2 SEM of calcium carbonate prepared by different SS adding amounts
由图2a 可见,不添加SS 时,所得碳酸钙样品呈现出大小不均匀、不规整的菱形颗粒;由图2b 可见,当SS 的添加量提高到0.2 g 时, 碳酸钙形成团聚的立方体状颗粒,粒径分布在5~8 μm;由图2c 可见,将SS 用量提高至0.4 g 时, 得到了分散均匀的立方状颗粒,粒径约为5 μm,也有少量的类球形颗粒;由图2d 可见,当SS 的添加量达到0.5 g 时,可以观察到形成了分散的球形碳酸钙微粒,球体粒径为1~2 μm,且从SEM 照片局部放大可以发现,部分有缺陷的球形碳酸钙表面呈多孔的结构; 由图2e 可见,继续增加SS 达到1.0 g 时, 球形碳酸钙微粒出现团聚现象,形成不规则的形状,也有部分菱形颗粒;由图2f 可见,当SS 用量提高至1.5 g 时,样品团聚现象严重,呈现更加不规则的形貌。
综上所述,SS 添加量对CaCO3的形貌有显著的影响。 当SS 的添加量较少时,由于可溶性淀粉分子链上存在丰富的羟基(—OH)基团,—OH 可与溶液中的Ca2+配位结合,影响Ca2+和CO32-的沉淀反应,抑制了碳酸钙结晶成核,降低了碳酸钙微粒的团聚,并进一步影响碳酸钙晶体的形成, 从而形成分散均匀的立方状颗粒[17]。 当 SS 的添加量适中时,由于可溶性淀粉具有的高分子链状结构, 其空间位阻可能会抑制部分碳酸钙的晶面生长。因此,浓度适中的可溶性淀粉溶液可以制备出球状结构碳酸钙微粒。 但当SS浓度过高时,由于可溶性淀粉溶液有一定的黏度,浓度过高会使生成的球状颗粒团聚在一起, 形成不规则形貌[16]。 因此,实验选择适宜的 SS 添加量为 0.5 g。
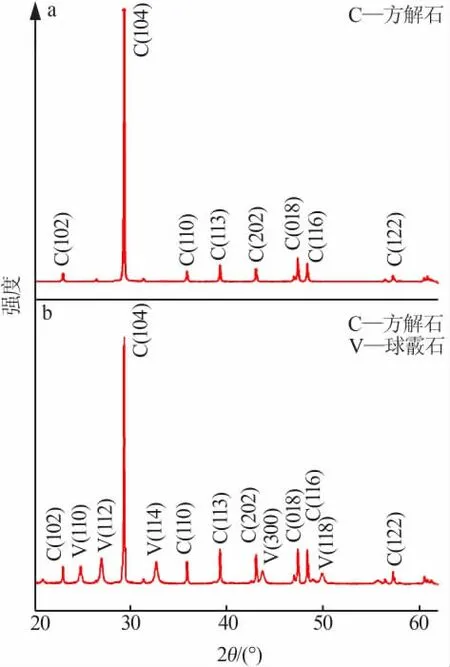
图3 不同可溶性淀粉下碳酸钙的XRD 谱图Fig.3 XRD patterns of calcium carbonate by different SS adding amounts
为了进一步探讨SS 添加量对CaCO3形貌和晶型的影响,图3 给出了添加量为0 g 和0.5 g 可溶性淀粉制得碳酸钙的XRD 谱图。由图3a 可以看到,图中衍射峰均为方解石衍射峰, 晶面衍射峰有(102)、(104)、(110)、(113)、(202)、(018)、(116)、(122),与标准卡片ASTM(05-0586)的方解石相的峰一致,证实未添加SS 所得碳酸钙为方解石结构。 而由图3b可见,SS 添加量为0.5 g 制备出的碳酸钙除了含有上述方解石特征峰外,还具有球霰石的衍射峰,晶面有(110)、(112)、(114)、(300)、(118)。 说明 SS 添加量为0.5 g 所得的碳酸钙是由方解石和球霰石混合晶型组成。 综上分析,为获得分散的多孔球形碳酸钙,选取最优SS 添加量为0.5 g 进行下一步研究。
2.2 碳酸钠水溶液滴加速度的影响
实验条件:1.11 g(0.01 mol)无水氯化钙,0.1 mol/L碳酸钠水溶液为100 mL,可溶性淀粉添加量为0.5 g。探讨碳酸钠水溶液的滴加速度(直接混合,10、5、3.5、1.5 mL/min)对 CaCO3形貌和晶型的影响,结果见图4。 从图4 可以看出,不同滴加速度对CaCO3的形貌有较大的影响。 如果不控制滴速,直接将碳酸钠水溶液混入,所得碳酸钙样品是不规整、团聚的菱形颗粒 (图4a); 控制滴加速度分别为10 mL/min和5 mL/min 时,碳酸钙形成菱形颗粒,粒径约为4 μm,颗粒间有一定的团聚(图4b~4c);当滴加速度降至3.5 mL/min 时,碳酸钙样品呈现球状颗粒和菱形颗粒共存的现象,其中球形碳酸钙表面呈多孔的结构,但球形碳酸钙大小不一,形状不规则(图4d);当滴加速度为 1.5 mL/min 时,可以观察到形成了以球形碳酸钙为主的微粒, 球形碳酸钙分散均匀、大小均一,球体粒径为4~5 μm,从局部放大图可以发现,球形碳酸钙表面呈现由众多碳酸钙微粒堆砌而形成的多孔结构(图4e)[6]。综上所述,滴加碳酸钠溶液的速度快, 碳酸钙主要生成立方体状颗粒;滴加碳酸钠溶液的速度慢,碳酸钙则更容易形成球状颗粒。 因此, 实验选择适宜的滴加速度为1.5 mL/min。
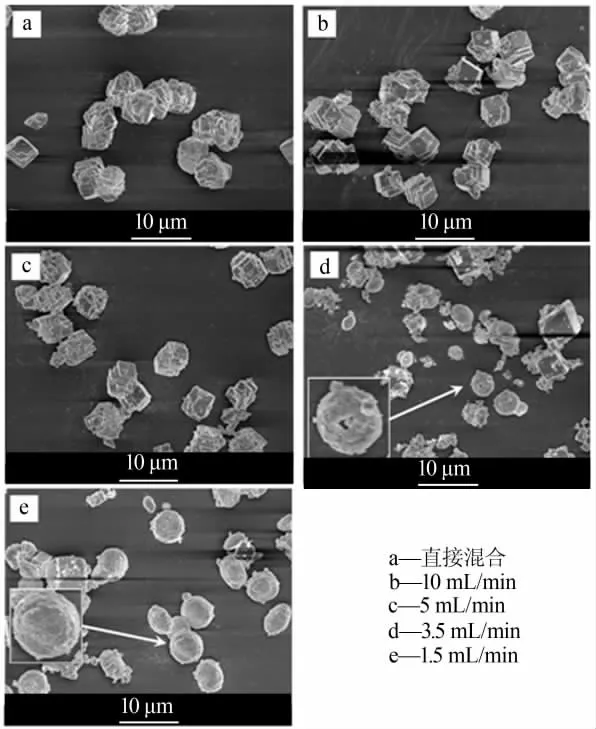
图4 不同滴加速度下碳酸钙的SEM 照片Fig.4 SEM of calcium carbonate prepared under different dropping speed
图5 为不同滴加速度制备碳酸钙的XRD 谱图。其中, 直接混合所得碳酸钙产品只出现方解石衍射峰,即为方解石型碳酸钙(图5a)。 这可能是由于反应物的滴加速度过快, 造成反应体系中局部过饱和度过高, 导致在初生的碳酸钙晶体表面二次或多次成核,并随着反应的继续而逐渐生长,最终形成了方解石型碳酸钙[18]。随着滴加速度降至1.5 mL/min,产品同时还出现球霰石衍射峰, 即主要形成了方解石和球霰石混合晶型碳酸钙(图5b)。 上述结果证实,滴加速度越慢,越利于球霰石型碳酸钙生长。 综上分析,为获得分散的多孔球形碳酸钙, 实验选择适宜的滴加速度为1.5 mL/min。

图5 直接混合(a)和滴加速度1.5 mL/min(b)制备碳酸钙的XRD 谱图Fig.5 XRD of calcium carbonate prepared by direct mixing(a) and dropping speed of 1.5 mL/min(b)
2.3 氯化钙与碳酸钠物质的量比的影响

图6 氯化钙与碳酸钠的不同物质的量比下碳酸钙形貌的扫描电镜照片Fig.6 SEM of calcium carbonate prepared with different amount-of-substance ratio of CaCl2 and Na2CO3
固定实验条件: 可溶性淀粉添加量为0.5 g,滴加碳酸钠水溶液的速度为1.5 mL/min。 探讨氯化钙与碳酸钠的物质的量比(1∶3、1∶2、1∶1、2∶1、3∶1)对CaCO3形貌的影响,结果见图6。 由图6a~6b 可以看到, 当氯化钙与碳酸钠的物质的量比为 1∶3 和 1∶2时,所得碳酸钙样品大部分为球状结构颗粒,少量为立方状结构;当氯化钙与碳酸钠的物质的量比为1∶1时,所制备的碳酸钙样品为球状结构,粒径为4~5 μm。 从局部放大图可以发现,球形碳酸钙表面呈现凹凸不平结构, 是由众多碳酸钙微粒堆砌而形成的多孔结构(图6c)[6]。 当氯化钙与碳酸钠的物质的量比为2∶1 时, 所制备的碳酸钙大部分为立方状结构颗粒,少量为球状结构(图6d);当氯化钙与碳酸钠的物质的量比增至3∶1 时, 所制备的碳酸钙样品全部为立方体结构(图6e)。为了进一步研究氯化钙与碳酸钠的物质的量比对CaCO3形貌的影响,分别对不同物质的量比的样品做了XRD 测试,结果见图7。分析可知,XRD 谱图与SEM 结果一致,即氯化钙与碳酸钠的物质的量比为1∶2 和2∶1 制得的碳酸钙均为球霰石和方解石的混合晶型。对比图7a 和图7b 可以发现,氯化钙与碳酸钠的物质的量比为1∶2 的样品球霰石衍射峰表现更强, 而氯化钙与碳酸钠的物质的量比为2∶1 的样品方解石衍射峰更强。XRD 证实氯化钙与碳酸钠的物质的量比为1∶2 时, 所得样品主要是球霰石碳酸钙;当氯化钙与碳酸钠的物质的量比为2∶1 时,所制备的样品主要是方解石碳酸钙。
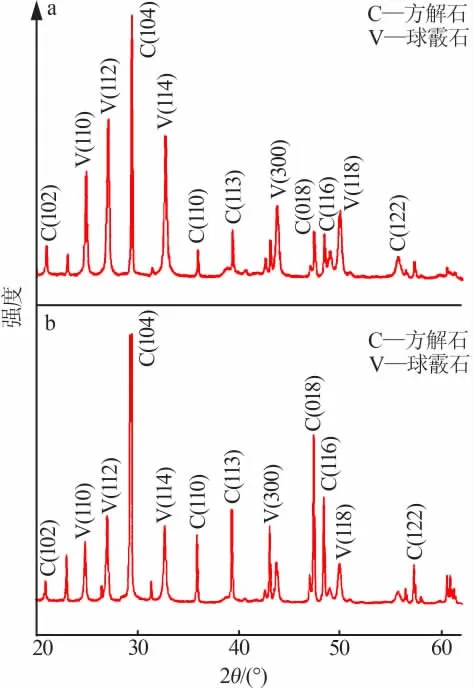
图7 氯化钙与碳酸钠的不同物质的量比下CaCO3 样品的 XRD 谱图Fig.7 XRD patterns of calcium carbonate with different amount-of-substance ratio of CaCl2 and Na2CO3
考虑到当氯化钙与碳酸钠的物质的量比为1∶3和1∶2 时,颗粒表面存在过量的碳酸根,碳酸根在水溶液中发生水解反应产生一定量的OH-,OH-可与溶液中的Ca2+生成微溶于水的氢氧化钙,一定程度上抑制了部分碳酸钙的晶面生长,从而形成球型碳酸钙[19]。 当氯化钙与碳酸钠的物质的量比为 2∶1 和3∶1 时,溶液中的Ca2+是富余的,由于反应中是滴加碳酸钠溶液,导致溶液的局部饱和度过高,增加了晶体的表面能, 促进了CaCO3的成核速率和晶体生长,从而形成更为稳定的方解石型碳酸钙。
上述结果表明, 溶液中氯化钙与碳酸钠的物质的量比对CaCO3形貌影响显著, 综合各方面考虑,氯化钙与碳酸钠的最佳物质的量比为1∶1,可以获得粒径为4~5 μm 的多孔球霰石碳酸钙。
3 结论
以氯化钙和碳酸钠为原料, 以SS 为晶型调控剂, 成功制备了粒径为4~5 μm 的多孔球霰石碳酸钙。研究发现SS 添加量、碳酸钠溶液滴加速度、氯化钙与碳酸钠的物质的量比对碳酸钙形貌和晶型影响显著,得到多孔球霰石碳酸钙的最佳制备工艺条件:SS 添加量为0.5 g,滴加速度为1.5 mL/min,氯化钙与碳酸钠的物质的量比为1∶1。

