IL-1β辅助小胶质细胞M1型活化的作用机制研究
沈和平 官俏兵 杨毅 郭丽 盛泳佳 韩晨阳
研究发现,神经炎症在绝大多数中枢神经系统疾病(缺血性卒中、帕金森病、阿尔茨海默病、脑白质病变等)中扮演着重要的角色[1-2]。小胶质细胞作为脑组织中常驻的免疫细胞,在炎症发生过程中快速活化,通过其表型的变化发挥促炎和抗炎的作用[3-4]。正常生理情况下,小胶质细胞可以清除死亡的神经细胞,促进神经细胞的生长;但是小胶质细胞短期的过度活化将会引起神经炎症,从而损伤神经细胞。小胶质细胞活化后可分为M1型和M2型两种[5-6]。M1型为经典的活化型,它是由IFN-γ或脂多糖(lipopolysaccharide,LPS)诱导产生的[7],主要发挥促炎作用;而M2型正好相反,它是由IL-4和IL-13诱导产生的,主要发挥抗炎作用[8]。IL-1β是M1型小胶质细胞分泌的主要炎症因子[9],但是其如何发挥促炎作用尚未阐明。IL-1β是一种具有多种生物活性的物质,不仅可作用于周围神经细胞,也可作用于免疫细胞,目前尚未发现IL-1β对于小胶质细胞有何作用。因此,本研究主要探讨IL-1β促进小胶质细胞M1型活化的作用和机制,为神经炎症发生、发展的机制探索提供新的思路。
1 材料和方法
1.1 主要试剂和材料 小鼠小胶质细胞BV2细胞系(武汉普诺赛生物技术有限公司,批号:CL-0493);LPS(美国 Sigma 公司分装);IL-6(批号:H007)、TNF-α(批号:H052)的ELISA试剂盒(南京建成生物工程研究所);一氧化氮(NO)检测试剂盒(比色法检测,南京建成生物工程研究所,批号:A01301);前列腺素G2(prostaglandin,PEG2)(美国 Abcam 公司,批号:133065);CD86的免疫荧光抗体(美国Abcam公司,批号:209896);免疫荧光染色试剂盒(美国Sangon Biotech公司,批号:670005);M1型标志蛋白单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)、趋化因子 8(chemokines-8,CXCL-8)的表达以及酪氨酸激酶(janus kinase 1,JAK1)、信号转导及转录激活蛋白 1(signal transducer and activator of transcription 1,STAT1)、磷酸化的JAK1(p-JAK1)、磷酸化的 STAT1(p-STAT1)的单克隆抗体(美国 CST 公司,批号:41987、10886、74129、9167、50996、14995);JAK1抑制剂 IN-7(上海 MCE 公司,批号:126296);重组人 IL-1β(美国 Sangon Biotech 公司,批号:600002)。
1.2 小胶质细胞的处理及分组 BV2细胞培养至对数期后,分为对照(Control)组、LPS 组、LPS+IL-1β 组。Control组常规培养;LPS组用终浓度为1 mg/L的LPS处理;LPS+IL-1β组先用15 μg/L的IL-1β预处理6 h,再用终浓度为1 mg/L的LPS处理。LPS的处理时间为24 h。IN-7处理实验中,将BV2细胞分为LPS组、LPS+IL-1β 组、LPS+IL-1β+IN-7组,其中 LPS+IL-1β+IN-7组在IL-1β处理前6 h用0.5 μmol/L IN-7预处理,阻断JAK1,其余处理同前。
1.3 培养基中IL-6、TNF-α、NO和 PEG2表达水平检测 培养基中IL-6、TNF-α和PEG2表达水平检测采用ELISA法,NO表达水平检测采用比色法。LPS干预BV2 细胞后,在 3、6、12、18、24 h 取培养基,用酶标仪在450 nm处测定吸光度(A),以标准品的浓度为横坐标,A为纵坐标绘制标准曲线,根据A带入标准曲线拟合方程式,计算培养基中细胞因子水平,结果以ng/L表示。
1.4 BV2细胞中CD86荧光染色实验 采用细胞爬片法进行细胞的免疫荧光染色。将盖玻片置于6孔板中,接种BV2细胞后待细胞长至70%,LPS处理后,用新鲜配置的4%多聚甲醛固定细胞10 min。PBS洗3次后用0.2%的Triton X-100进行透化处理10 min,2% BSA封闭30 min,单克隆抗体1∶300稀释后进行室温孵育1 h,PBS洗3次后,加入IgG抗体进行标记孵育。最后用0.5 mg/L DAPI染色试剂进行细胞核染色,PBS洗2次后加封片,荧光显微镜下观察,以荧光强度表示。
1.5 MCP-1、CXCL-8及JAK1-STAT1信号蛋白JAK1、STAT1、p-JAK1、p-STAT1表达水平检测 采用Western blot法。收集细胞用PBS洗2次后加入预冷的1.0 ml RIPA裂解液,在冰上裂解30 min,10 000 g转速下离心15 min,BCA试剂盒蛋白定量,用5×loading buffer煮沸8 min后进行电泳,PVDF膜使用5%脱脂奶粉封闭2 h,TBST稀释单克隆抗体一抗,孵育后PVDF膜用TBST洗2次后,用辣根过氧化物酶标记的山羊抗兔二抗孵育。孵育完成后用化学发光法检测,采用Image Pro-Plus 6.0软件进行光密度的分析,以GAPDH为内参,结果以目的蛋白与内参蛋白光密度值的比值表示。
1.6 统计学处理 采用SPSS 21.0统计软件。实验重复3次。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组培养基中IL-6、TNF-α、NO和PEG2表达水平比较 随着时间的延长,Control组培养基中 IL-6、TNF-α、NO和PEG2表达水平并无显著变化,且处于低水平。LPS组和LPS+IL-1β组培养基中IL-6、TNF-α、NO和PEG2表达水平随着时间的延长均上调(均P<0.05);与Control组比较,LPS组和LPS+IL-1β组培养基在 3、6、12、18、24 h 时 IL-6、TNF-α、NO 和 PEG2表达水平均上调(均 P<0.05);与LPS组比较,LPS+IL-1β 组培养基在 3、6、12、18、24 h 时 IL-6、TNF-α、NO 和 PEG2表达水平均上调(均P<0.05),见图1。
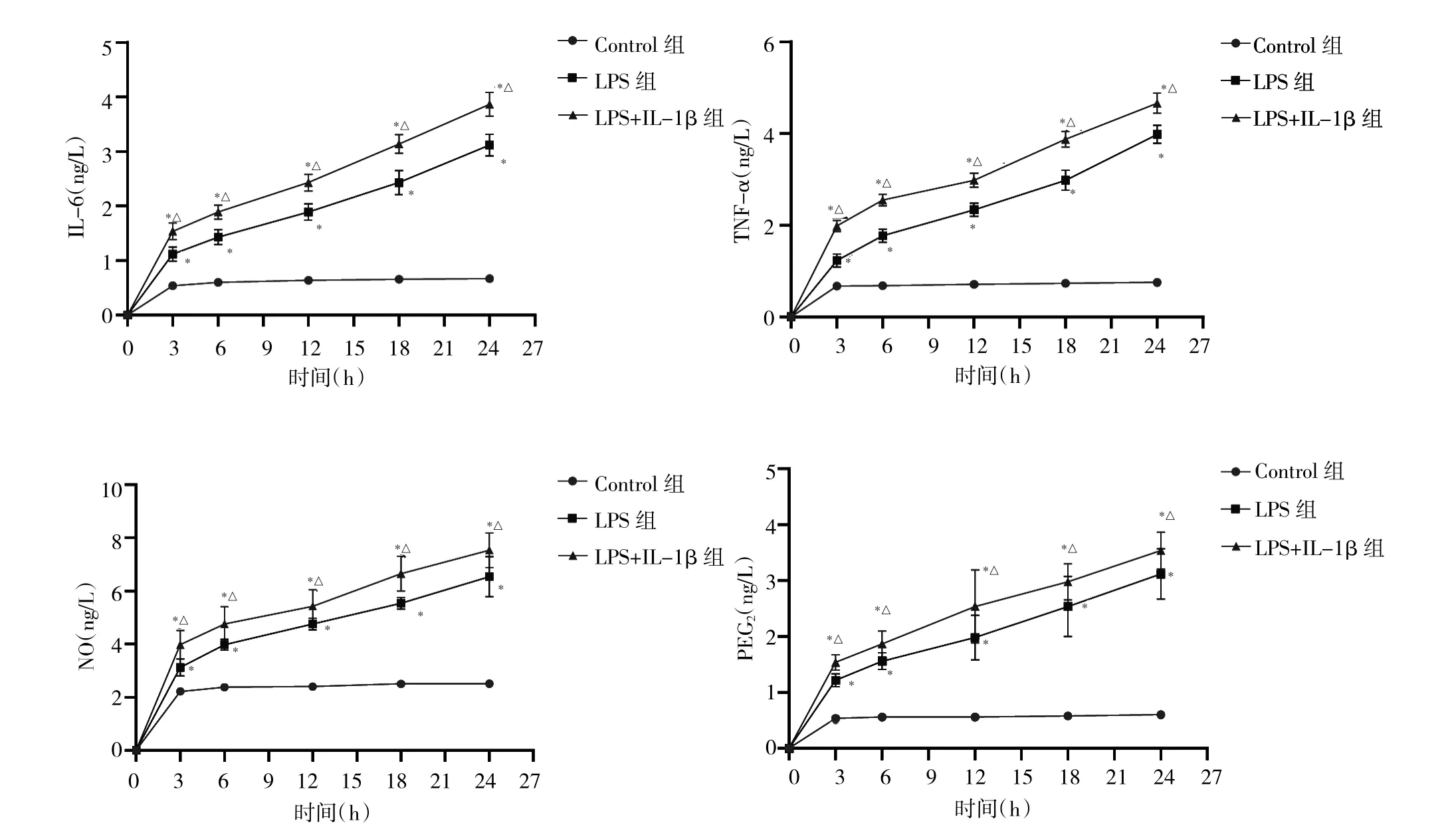
图1 各组培养基中IL-6、TNF-α、一氧化氮(NO)和前列腺素E2(PEG2)表达水平比较[与Control组比较,*P<0.05;与脂多糖(LPS)组比较,△P<0.05]
2.2 各组细胞中CD86荧光强度比较 与Control组比较,LPS组和LPS+IL-1β组细胞中CD86荧光强度均上调(均P<0.05)。与LPS组比较,LPS+IL-1β组细胞中CD86荧光强度上调(P<0.05),见图 2(插页)。

图2 各组细胞中CD86荧光强度比较(LPS为脂多糖)
2.3 各组细胞中MCP-1、CXCL-8及JAK1-STAT1信号蛋白表达水平比较 与Control组比较,LPS组和LPS+IL-1β 组细胞中 MCP-1、CXCL-8、JAK1、STAT1、p-JAK1、p-STAT1蛋白表达水平均上调(均P<0.05);与LPS组比较,LPS+IL-1β 组细胞中 MCP-1、CXCL-8、JAK1、p-JAK1、p-STAT1蛋白表达水平均上调(均P<0.05),见图3。
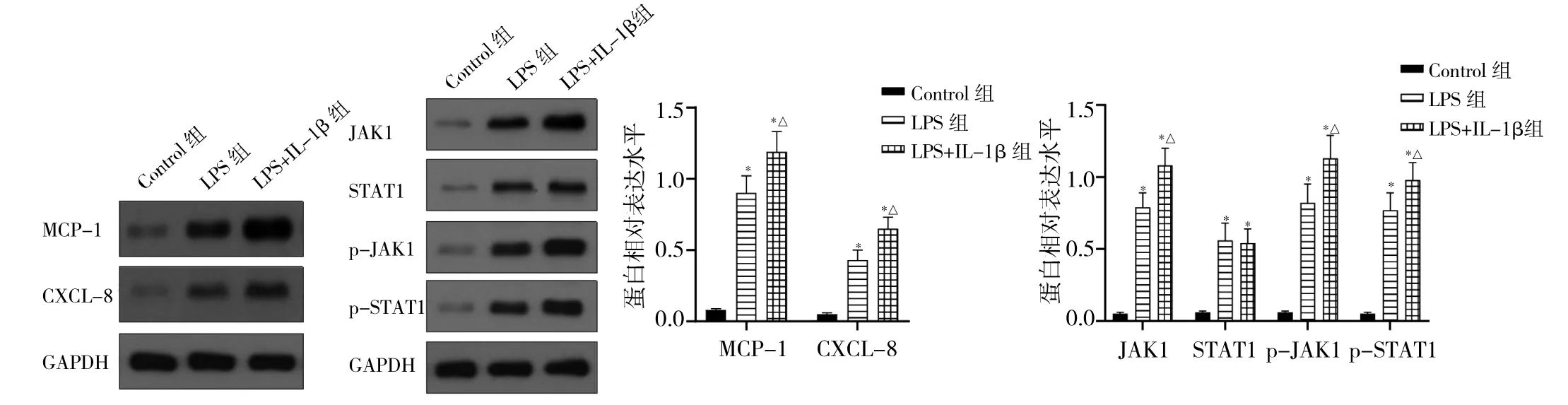
图3 各组细胞中单核细胞趋化蛋白1(MCP-1)、趋化因子8(CXCL-8)及酪氨酸激酶(JAK1)-信号转导及转录激活蛋白1(STAT1)表达水平比较[p-JAK1为磷酸化的JAK1;p-STAT1为磷酸化的STAT1;与Control组比较,*P<0.05;与脂多糖(LPS)组比较,△P<0.05]
2.4 抑制JAK1后,各组培养基中IL-6、TNF-α、NO和PEG2表达水平比较 IN-7预处理后,与LPS组和LPS+IL-1β 组比较,LPS+IL-1β+IN-7 组培养基在 3、6、12、18、24 h 时 IL-6、TNF-α、NO 和 PEG2表达水平均下调(均 P<0.05),见图 4。
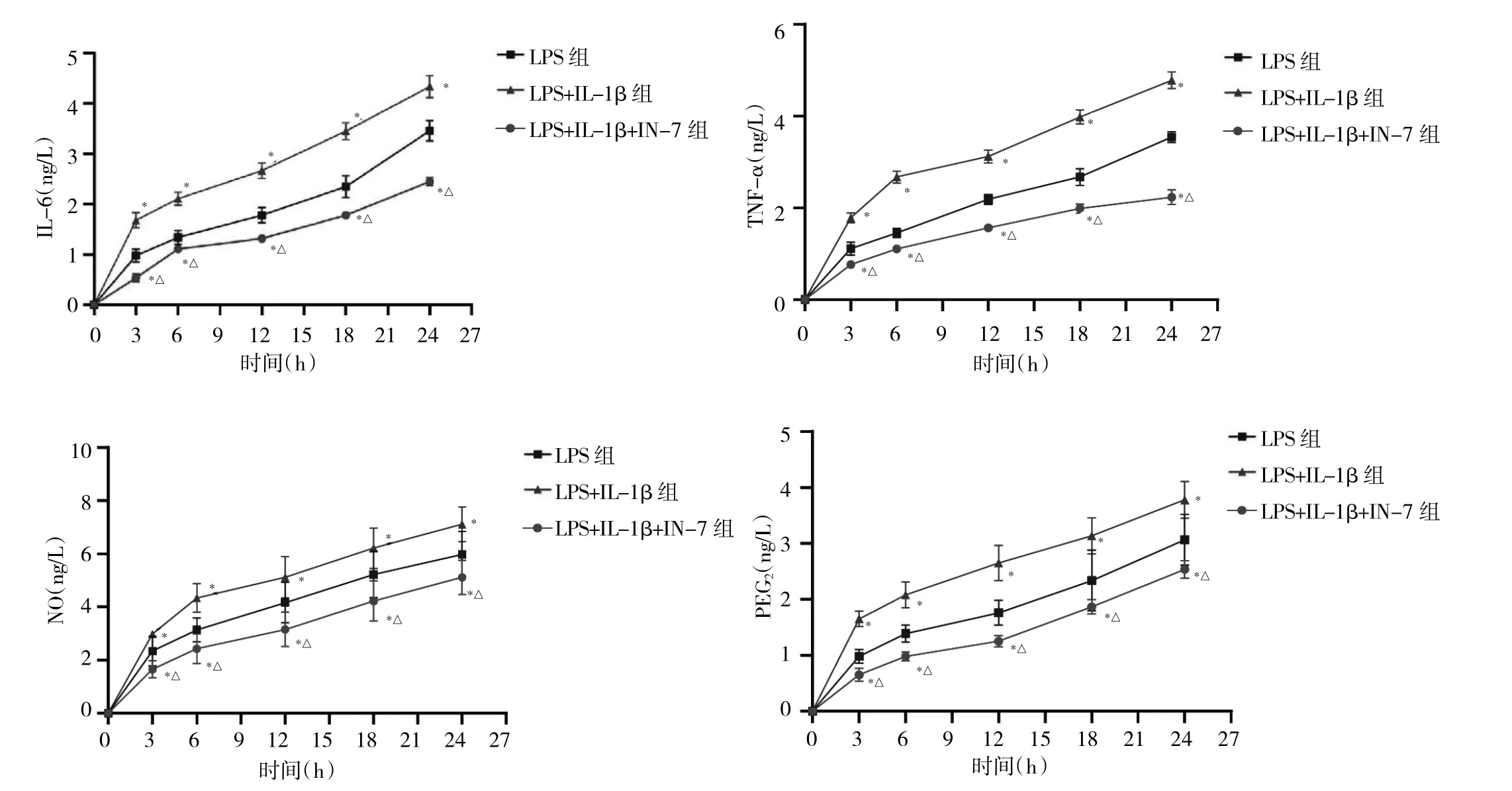
图4 抑制酪氨酸激酶(JAK1)后,各组培养基中IL-6、TNF-α、一氧化氮(NO)和前列腺素E2(PEG2)表达水平比较[与脂多糖(LPS)组比较,*P<0.05;与 LPS+IL-1β 组比较,△P<0.05]
2.5 抑制JAK1后,各组细胞中CD86荧光强度比较IN-7预处理后,与LPS组和LPS+IL-1β组比较,LPS+IL-1β+IN-7组细胞中CD86荧光强度下调(均P<0.05),见图 5(插页)。
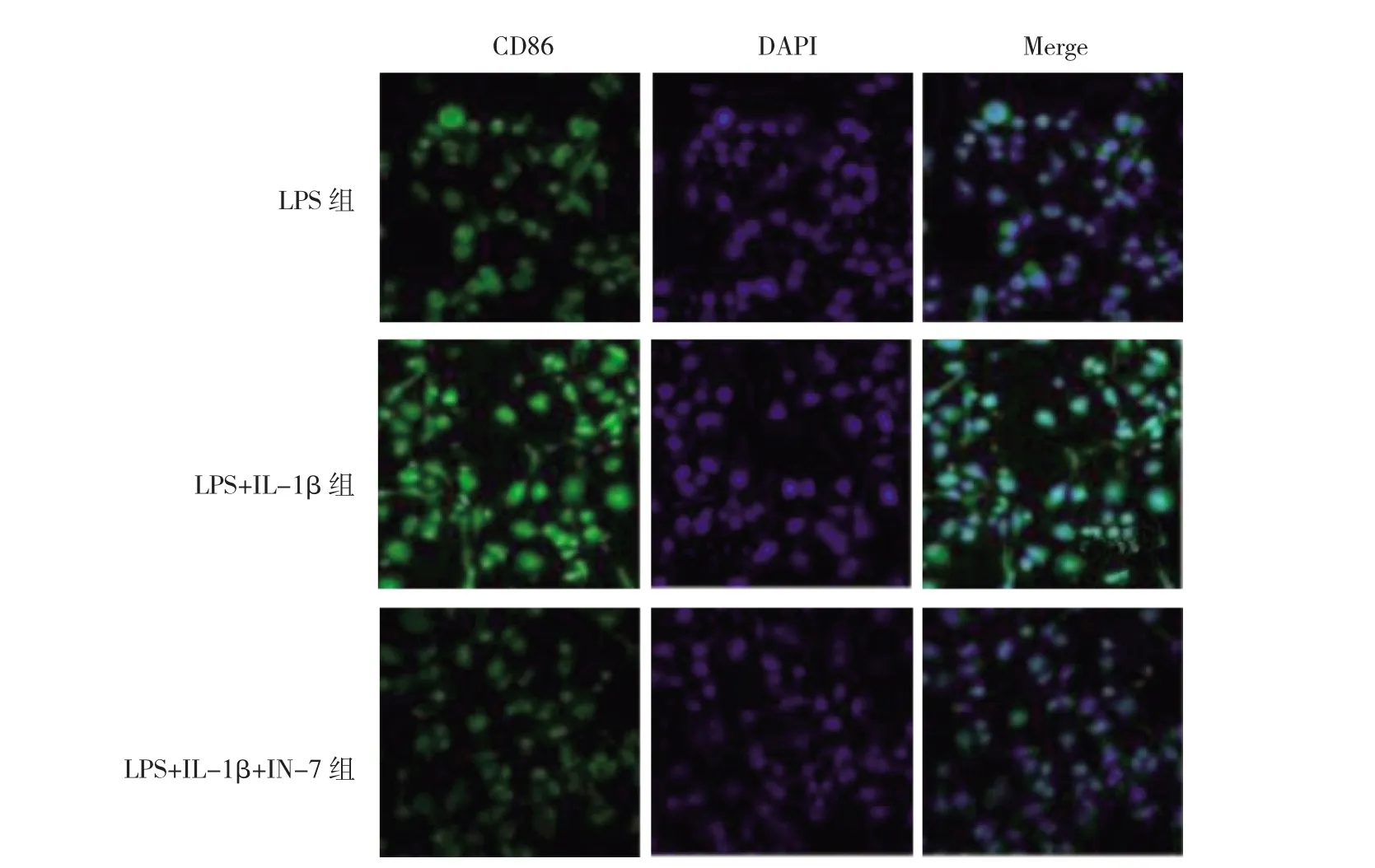
图5 抑制酪氨酸激酶(JAK1)后,各组细胞中CD86荧光强度比较(LPS为脂多糖)
2.6 抑制JAK1后,各组细胞中MCP-1、CXCL-8及JAK1-STAT1信号蛋白表达水平比较 IN-7预处理后,与LPS组和LPS+IL-1β组比较,LPS+IL-1β+IN-7组细胞中 MCP-1、CXCL-8、JAK1、STAT1、p-JAK1、p-STAT1蛋白表达水平均下调(均P<0.05),见图6。

图6 抑制酪氨酸激酶(JAK1)后,各组细胞中单核细胞趋化蛋白1(MCP-1)、趋化因子8(CXCL-8)及JAK1-信号转导及转录激活蛋白(STAT1)表达水平比较[p-JAK1为磷酸化的JAK1;p-STAT1为磷酸化的STAT1;与脂多糖(LPS)+IL-1β组比较,*P<0.05;与LPS组比较,△P<0.05]
3 讨论
神经炎症是神经系统接收外界信号产生的先天性免疫应答反应,是机体防御系统启动的标志[10]。在神经炎症中,小胶质细胞释放过度的炎症因子,在疾病的发展过程中发挥着重要的作用[11]。小胶质细胞是中枢系统胶质细胞的一类,也是发挥神经炎症的主要细胞之一。既往研究已经发现小胶质细胞是一种巨噬细胞,可以分为M0、M1、M2型[12]。M0是小胶质细胞静止状态,而M1和M2是激活态的小胶质细胞。M1细胞主要发挥识别、趋化和吞噬的功能,然而小胶质细胞过度的激活可以大量释放TNF-α、IL-6、IL-1β等炎症因子,促进神经细胞的损伤。其机制和IL受体等信号激活有关,所以M1型巨噬细胞也是促炎细胞。其中IL-1β是巨噬细胞主要释放的促炎因子之一,有着多种病理生理功能[13]。而M2型细胞正好相反,主要起到抗炎的作用[14],在神经炎症的发生、发展中M1/M2的平衡和转化是至关重要的。
既往研究发现TNF-α、IL-1β是最重要的炎症因子,它可以诱导星型胶质细胞和内皮细胞产生趋化因子和黏附因子,进一步增强慢性炎症的进展[15]。IL-1β对小胶质细胞具有自分泌的作用,能上调IL-6和TNF-α的表达,促进小胶质细胞的增生[15-16],也可以诱导神经细胞的损伤和凋亡。因此,可以说IL-1β是通过小胶质细胞自分泌后影响神经细胞及周围细胞。但是在神经炎症中小胶质细胞的活化是级联放大的,所以分泌的IL-1β是否通过诱导小胶质细胞活化发挥作用也尚未可知。为了探明IL-1β对于小胶质细胞活化的作用,本实验采用LPS诱导小胶质细胞M1型活化,LPS是M1型激活的经典激活剂,可以诱导小胶质细胞向M1型激活,其中M1型标志物IL-6、TNF-α、NO和PEG2的表达水平上调,而未经过LPS刺激的对照组细胞IL-6、TNF-α、NO和PEG2的表达未见明显变化。值得注意的是,当用IL-1β 预处理 BV2细胞后,IL-6、TNF-α、NO 和 PEG2等表达水平进一步上调,同时免疫荧光的结果也显示CD86的表达上调,明显高于单一LPS诱导。CD86是M1型细胞膜表面标志物,它的表达水平增高,说明了BV2向M1进行了转化。因此,从表型转化的角度来看,IL-1β可以辅助LPS促进小胶质细胞的M1型活化。
小胶质细胞的活化受到多条信号通路的调控,其中JAK1-STAT1是主要的调控信号。IFN-γ和LPS是诱导M1型活化的重要内源性物质,在JAK1信号中,STAT1的激活是M1活化的关键信号[17-19]。LPS和IFN-γ通过激活p-JAK1激活了p-STAT1,从而诱导信号的传递。而在本研究中也发现IL-1β可以进一步激活JAK1-STAT1的激活,表现为p-JAK1和p-STAT1的表达上调,且明显高于单一的LPS诱导。为了明确IL-1β是否通过该信号,本实验采用IN-7进行JAK1的阻断,结果显示,当JAK1阻断后,IL-1β的作用受到了抑制,M1型标志分泌因子IL-6、TNF-α、NO和PEG2的表达水平下调,甚至低于单一LPS组,这是因为LPS通过促进JAK1信号激活发挥作用,当JAK1信号受到抑制后,LPS自然无法发挥作用。同时免疫荧光染色结果也显示CD86的表达水平下调。其标志物MCP-1和CXCL-8的表达下调[20],JAK1信号中关键因子p-STAT1的表达下调。所以该实验证明IL-1β促进小胶质细胞M1活化是激活了JAK1-STAT1信号发挥作用的。
综上所述,本研究发现IL-1β可以辅助小胶质细胞的M1型活化,其作用机制是通过JAK1-STAT1信号发生的。这是神经炎症中IL-1β发挥作用的新机制,为神经炎症的研究提供了新的思路和参考。

