p65和p16在局限期小细胞肺癌中的表达及其临床意义
黄鲁众 蒋中秀 赵志光
小细胞肺癌(small cell lung cancer,SCLC)约占肺癌的13%~15%,确诊时只有不足1/5属于局限期,大部分已错过手术时机[1-2]。SCLC患者虽然对放化疗较敏感,但总体生存期仍较短。近年来,随着靶向治疗和免疫治疗的出现,SCLC患者的生存期得到明显延长[3-4]。但SCLC的治疗水平并未取得突破性进展,对其发生、发展机制等尚不明确,有关其复发、预后评估的有效指标也较少。本研究应用免疫组化SP法检测128例局限期SCLC患者的癌组织和其中50例患者的癌旁肺组织中p65、p16的表达情况,并进行相关性分析和预后分析,以探讨p65和p16在局限期SCLC中的临床意义。
1 对象和方法
1.1 对象 选取2010年1月至2018年12月在温州医科大学附属第二医院经病理确诊的128例局限期SCLC患者的癌组织标本,患者中男87例,女41例;年龄 33~74(56.60±11.08)岁,其中≤40岁 16例,>40岁~≤60岁87例,>60岁25例;肿瘤部位:左侧64例,右侧64例;肿瘤最大径:≤3 cm 27例,>3.0 cm~≤7.0 cm 90例,>7.0 cm 11例;淋巴结有转移72例,无转移56例;术前血清神经元特异性烯醇化酶(neuronspecific enolase,NSE)水平升高77例,正常51例。并将其中50例患者的癌旁肺组织作为对照。纳入标准:(1)有明确的病理诊断;(2)局限期指病变局限于一侧胸腔且能被纳入一个放射治疗野,经胸部CT、腹部CT、脑MRI等确定;(3)患者行根治性手术,术前未行抗肿瘤治疗,术后予化放疗等辅助治疗;(4)临床资料完整。排除标准:(1)除外混合腺癌、鳞癌等其他恶性成分的患者;(2)排除随访时间不足6个月失访的患者。本研究经温州医科大学附属第二医院医学伦理委员会审批通过,所有患者均知情同意。
1.2 SCLC癌组织与癌旁肺组织中p65、p16表达检测 采用免疫组化SP法。标本经固定、脱水、透明、包埋等制成石蜡切片,切片厚度为4 μm。脱蜡水化,滴加3% H2O2,室温孵育1 h,滴加柠檬酸液加热修复8 min后冷却至室温,滴加非免疫血清封闭3.5 h;滴加p65、p16抗体(分别按 1∶500、1∶200稀释)后 4 °C 冰箱过夜;滴加二抗室温孵育1 h,滴加辣根酶标记链卵白素液室温孵育1 h,滴加DAB试剂显色,放入苏木素复染,脱水透明封片。
1.3 免疫组化结果判定 p65阳性定位于细胞核,细胞质染色视为阴性;p16阳性定位于细胞核或细胞质。由2位病理科医生双盲阅片,随机选取5个包含癌组织的高倍视野,得出:(1)阳性细胞百分比:0%~10%为0分,11%~25%为1分,26%~50%为2分,>50%为3分;(2)染色强度:无着色为0分,浅黄色为1分,棕黄色为2分,黄褐色为3分。总分=阳性细胞百分比评分×染色强度评分,总分<3分为阴性,总分≥3分为阳性。
1.4 临床资料收集 主要包括患者性别、年龄、肿瘤部位、肿瘤最大径、淋巴结转移和术前血清NSE水平等。采用住院(门诊)观察、电话联系等形式随访,随访截止时间为2020年12月。
1.5 统计学处理 采用SPSS 21.0统计软件。计数资料组间比较采用x2检验;SCLC癌组织中p65与p16表达的相关性分析采用Pearson相关;预后分析应用Kaplan-Meier曲线,生存率比较应用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 SCLC癌组织与癌旁肺组织中p65、p16表达的比较 SCLC癌组织中p65阳性表达率为56.3%(72/128),明显高于癌旁肺组织的8.0%(4/50),差异有统计学意义(x2=34.212,P<0.01);SCLC癌组织中p16阳性表达率为35.2%(45/128),明显低于癌旁肺组织的70.0%(35/50),差异有统计学意义(x2=17.641,P<0.01)。免疫组化结果见图1。

图1 小细胞肺癌(SCLC)癌组织与癌旁肺组织中p65、p16的表达(a:SCLC癌组织中p65表达呈阳性;b:癌旁肺组织中p65表达呈阴性;c:SCLC癌组织中p16表达呈阴性;d:癌旁肺组织中p16表达呈阳性;免疫组化SP法,×200)
2.2 SCLC癌组织中p65与p16表达的相关性 Pearson相关分析显示SCLC癌组织中p65与p16表达呈负相关(r=-0.406,P<0.01),见表 1。
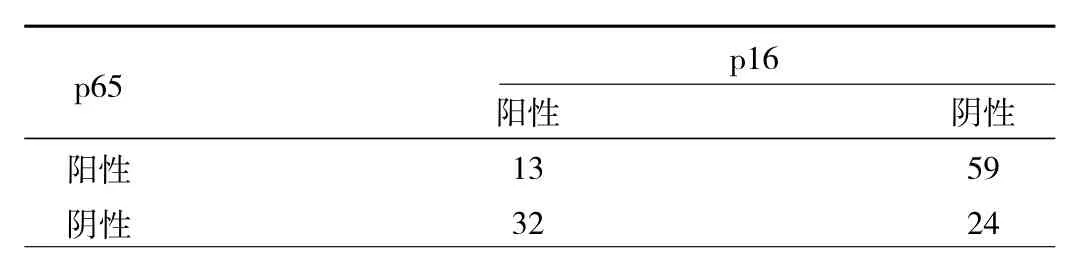
表1 SCLC癌组织中p65与p16表达的相关性(例)
2.3 SCLC癌组织中p65、p16阳性表达与临床特征的关系 SCLC癌组织中p65阳性表达与淋巴结转移和术前血清NSE水平均有关(均P<0.05),而与患者性别、年龄、肿瘤部位和肿瘤最大径均无关(均P>0.05)。SCLC癌组织中p16阳性表达与淋巴结转移有关(P<0.05),而与患者性别、年龄、肿瘤部位、肿瘤最大径和术前血清NSE水平均无关(均P>0.05),见表2。
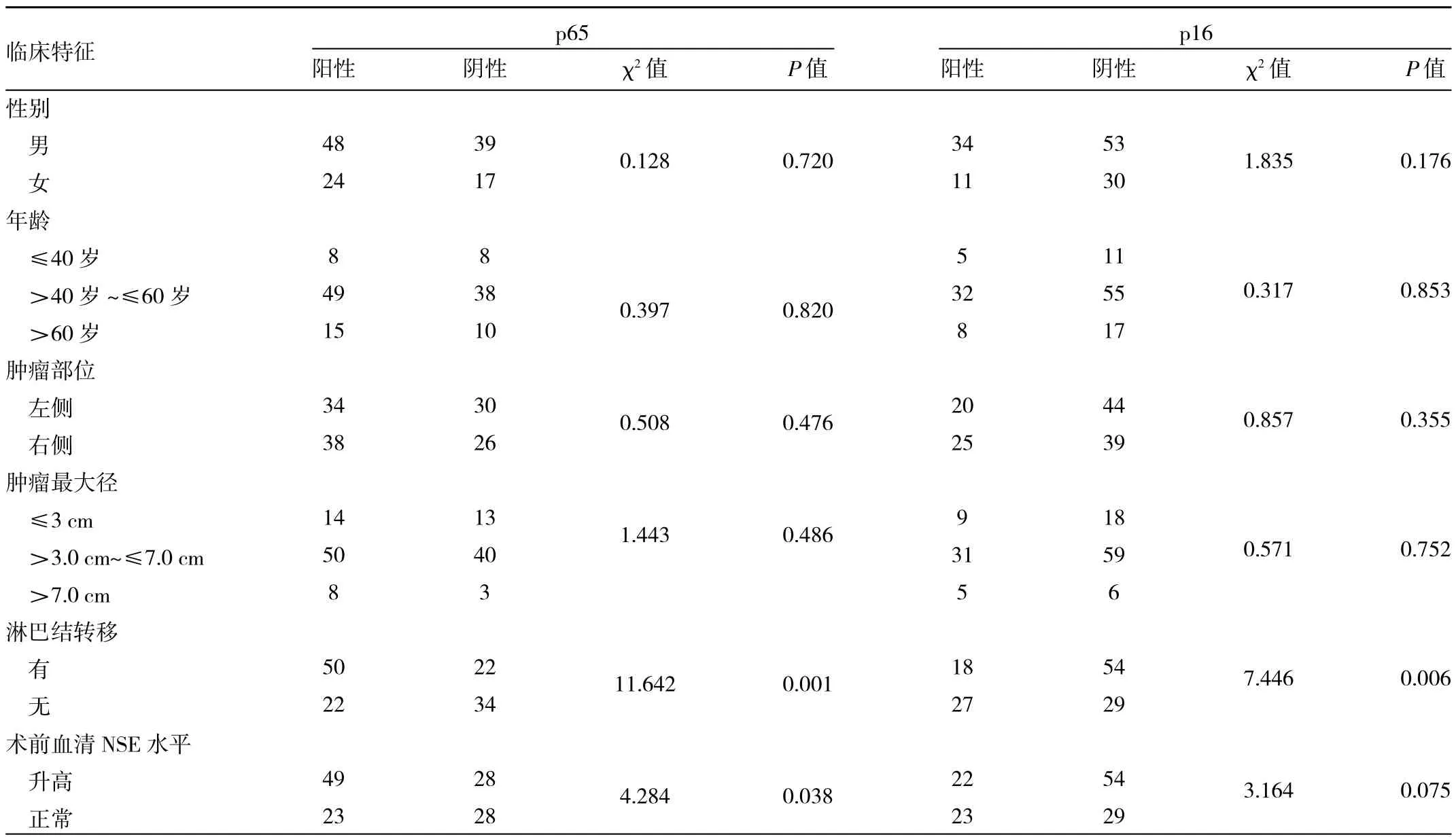
表2 SCLC癌组织中p65、p16阳性表达与临床特征的关系(例)
2.4 SCLC癌组织中p65、p16阳性表达与预后的关系 128例SCLC患者中有9例失访,最终纳入119例患者进行预后分析。随访截止时,死亡107例,存活12例。患者总体中位生存期为20.3个月,1年和2年生存率分别为85.6%和37.6%,见图2a。p65阳性表达患者的总体中位生存期为18.9个月,明显短于p65阴性表达患者的 21.8个月,差异有统计学意义(x2=7.695,P=0.006),见图2b。p16阳性和阴性表达患者的总体中位生存期分别为21.3和19.8个月,两者比较差异无统计学意义(x2=3.228,P=0.072),见图 2c。

图2 小细胞肺癌(SCLC)癌组织中p65、p16阳性表达与预后的关系(a:SCLC患者总体生存期;b:p65的表达水平与SCLC患者预后的关系;c:p16的表达水平与SCLC患者预后的关系)
3 讨论
SCLC恶性程度高,较早发生淋巴结转移和远处转移,中位生存期短。近30多年来,其治疗水平基本处于平台期,初诊时的分期、规范的治疗是治疗的关键[5-6]。对于可行手术的局限期SCLC患者,术后化疗或同步化放疗可以控制肿瘤的生长,但其无进展生存期和总体生存期仍较短[1]。
本研究显示,SCLC患者p65表达上调,p16表达下调,可能在肿瘤的发生、发展过程中发挥一定的作用。同时,SCLC癌组织中p65与p16表达呈负相关,提示两者相关的通路可能存在一定的关联。p65是NF-κB家族中含量最丰富、功能最重要的成员。其作用于肿瘤的机制主要包括:(1)激活细胞周期蛋白 D1(CycinD1),促进细胞无限生长[7-8];(2)参与血管生成以及肿瘤微环境的形成,为肿瘤生长提供能量;(3)产生氧自由基造成DNA损伤[8]等。p16基因是最早发现的直接参与调控细胞周期的肿瘤抑制基因[9-10],其表达产物p16INK4A与CDK4/6特异性结合,阻碍其与CycinD1形成复合物,以致细胞停留在G1期,无法进入S期[10-11]。当p16基因突变或失活时,细胞周期失去调控,导致细胞无限生长。
SCLC分期大多应用美国退伍军人医院研究小组制定的标准,TNM分期一般用于术前疾病评估[12]。局限期SCLC的术前TNM分期主要与肿瘤最大径和淋巴结转移有关。肿瘤最大径与肿瘤的增殖水平有关。随着医疗水平的进步以及患者对肺癌的认知水平和重视水平的提高,大多数患者会定期体检,所以就诊时,肿瘤体积不会过大。淋巴结转移与肿瘤的迁移水平有关。本研究得出在淋巴结转移的SCLC患者中,p65上调,p16下调。p65基因可直接作用于瘤细胞恶性表型相关基因,以及激活Snail转录因子,从而诱导上皮-间质转化,以获得更强的迁移能力[13];而p16基因失活,可上调基质细胞衍生因子(SDF-1)和基质金属蛋白酶2(MMP-2)的表达[14],同样可以促进上皮-间质转化。血清NSE是临床检测SCLC的首选肿瘤标志物,可用于疾病的进展与预后评估[15-16]。本研究中,p65的表达水平与术前血清NSE水平有关,提示p65基因的激活,可能促进神经内分泌细胞分泌NSE。
国内外关于p65与SCLC患者的预后研究不多,更多的预后研究是关于非小细胞肺癌。Lin等[17]研究显示,p65和p-p105共同阳性表达与非小细胞肺癌的预后不良有关,而p65的单独阳性表达与其无明显相关性。郭子君等[18]的一项关于SCLC的研究,得出p65阴性表达患者预后更好,与本研究结果一致。国内外关于p16与SCLC的研究主要是表达水平的变化,而有关预后生存的研究暂无报道。p16缺失突变包括纯合缺失和杂合缺失,在杂合缺失突变中是可以正常表达p16蛋白[14],因此在蛋白水平研究p16基因突变与预后关系不如基因水平研究更严谨。
综上所述,p65、p16可能在SCLC患者的发生和发展中起一定作用;同时,p65也可能对SCLC患者的预后有一定的指导意义。

