G6PD基因c.592C>T和c.95A>G遗传多态性与其发病风险的相关性研究
仇雯丽,丁科,董明右,凌永嫦,,石凤,滕元姬,4,何丽桥,,王俊利,5,李妹燕
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院检验学院,广西 百色 533000;3. 右江民族医学院附属医院产科,广西 百色 533000;4. 右江民族医学院附属医院检验科,广西 百色 533000;5. 右江民族医学院附属医院生殖医学中心,广西 百色 533000)
葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症又称蚕豆病,是最常见的一种遗传性酶缺陷病,主要临床表现为溶血性贫血、高胆红素血症。G6PD缺乏症在疟疾流行的地区广泛分布,尽管非洲地区患病率高,但高人口密度使亚洲成为此疾病发病重心,并且患有此疾病的亚洲人群发生溶血的风险指数最高[1]。我国两广及云贵地区为高发地区,其中广西地区人群携带率约为7.4%,男性发病率明显高于女性[2]。成熟的红细胞内无线粒体,磷酸戊糖途径是红细胞内唯一的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)来源,G6PD是细胞内磷酸戊糖途径的关键限速酶,对保护红细胞免受氧化损伤具有重要作用。G6PD酶表达水平较低时,患者会出现黄疸和急性溶血性贫血,严重威胁着患者的生命安全[3]。G6PD的基因突变有着明显的地域或群体特异性[1-2,4],其中,我国广西地区人群常见的基因突变类型主要为c.1376G>T、c.1388G>A、c.95A>G[5]。俸诗瀚等[5]研究了c.95A>G位点突变率高,尚未进一步研究该位点的基因多态性,此外,c.592C>T位点突变仅见于广东、广西、山东和浙江等沿海地区[6]。因此,本研究将分析广西地区G6PD基因相关位点c.592C>T和c.95A>G多态性与G6PD缺乏症发病风险的相关性,为G6PD缺乏症发病风险的预测筛查提供更有力的理论指导。
1 对象与方法
1.1 研究对象 通过病例对照研究,收集2017~2019年在右江民族医学院附属医院确诊的G6PD缺乏症患者及健康体检者全血标本(n=712)。G6PD缺乏症患者为病例组(n=417),女性156例,男性261例,平均年龄(35.06±22.33)岁。健康体检者为对照组(n=295),女性197例,男性 98例,平均年龄(36.11±18.48)岁。该研究经过右江民族医学院附属医院伦理委员会讨论批准,且已获得研究对象的知情同意。
1.2 研究方法
1.2.1 G6PD活性测定及基因组 DNA 的提取和保存 收集研究对象抗凝血2 ml,使用日立全自动生化分析仪(型号7600)检测G6PD酶活性。使用上海执诚生物科技有限公司生产的货号为GP8507的葡萄糖-6-磷酸脱氢酶测定试剂盒(速率法)检测G6PD活性,并使用DNA提取试剂盒(深圳亚能生物科技有限公司)提取全血基因组DNA,于-80℃冰箱保存待测。
1.2.2 SNPscanTM多重SNP分型检测 本实验采用上海天昊生物科技有限公司的SNPscanTM多重SNP分型试剂盒对c.592C>T和c.95A>G进行分型。操作步骤为:①每个位点设计3条探针,2条5′端鉴别探针和1条3′端探针,见表1;②将高温处理后的短片段基因组DNA与探针混合物变性复性;③加入连接酶反应体系;④利用带荧光标记的通用引物对连接产物进行PCR扩增;⑤分析确定不同位点的基因型;⑥多重位点分型的实现:通过改变位点鉴别连接序列的长度和加接连接反应从而实现多位点检测,并且通过改变探针中通用引物序列,采用PCR引物进行扩增,从而进一步增加检测位点的数目。

表1 G6PD基因c.592C>T和c.95A>G位点PCR引物
1.3 统计学方法 本实验数据运用SPSS 17.0 统计分析,通过Logistic回归计算两位点基因型和等位基因分布差异,并且经过性别、年龄、民族校正计算P值和OR值,G6PD病例组和对照组的临床特征分布通过四格表χ2检验分析。采用SHEsis在线软件进行两位点的单倍型分析。检验水准α=0.05,以P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征分布 病例组和对照组在年龄分布上,差异无统计学意义(P>0.05)。两组性别差异具有统计学意义,男性G6PD缺乏症发病风险高于女性(P<0.001)。民族在两组间差异具有统计学意义(P<0.05),见表2。

表2 G6PD病例组和对照组的临床特征分布
2.2 G6PD基因SNP基因型和等位基因频率比较 c.592C>T的基因型和等位基因与G6PD的发病风险不相关,并且该位点的显性模型和隐性模型与其发病风险也不具有相关性。但是c.95A>G位点的基因型AG(Pa=0.001,OR=2.833,95%CI:1.459~5.370)和GG(Pa=0.005,OR=17.109,95%CI:2.313~126.547)与G6PD缺乏症的发病风险相关,是该疾病的致病因素。c.95A>G位点的显性模型和隐性模型及其等位基因G在G6PD缺乏症病例组和对照组中的分布差异有统计学意义(Pa<0.05且OR>1),见表3。结果表明,c.95A>G位点的显性模型和隐性模型及等位基因G与G6PD缺乏症发病风险有关,且是该疾病的风险因素。
2.3 c.592C>T和c.95A>G与性别的相互作用对G6PD缺乏症的影响 通过进一步分析c.592C>T和c.95A>G两位点与性别的相互作用,我们发现男性携带c.592C>T位点的CC基因型发病风险增加(Pa<0.001,OR=3.361,95%CI:2.451~4.608)。与携带c.95A>G位点AA基因型的女性相比,携带AG基因型的女性和携带AA和GG基因型的男性G6PD发病风险显著升高(均有Pa<0.05且OR>1),见表4。
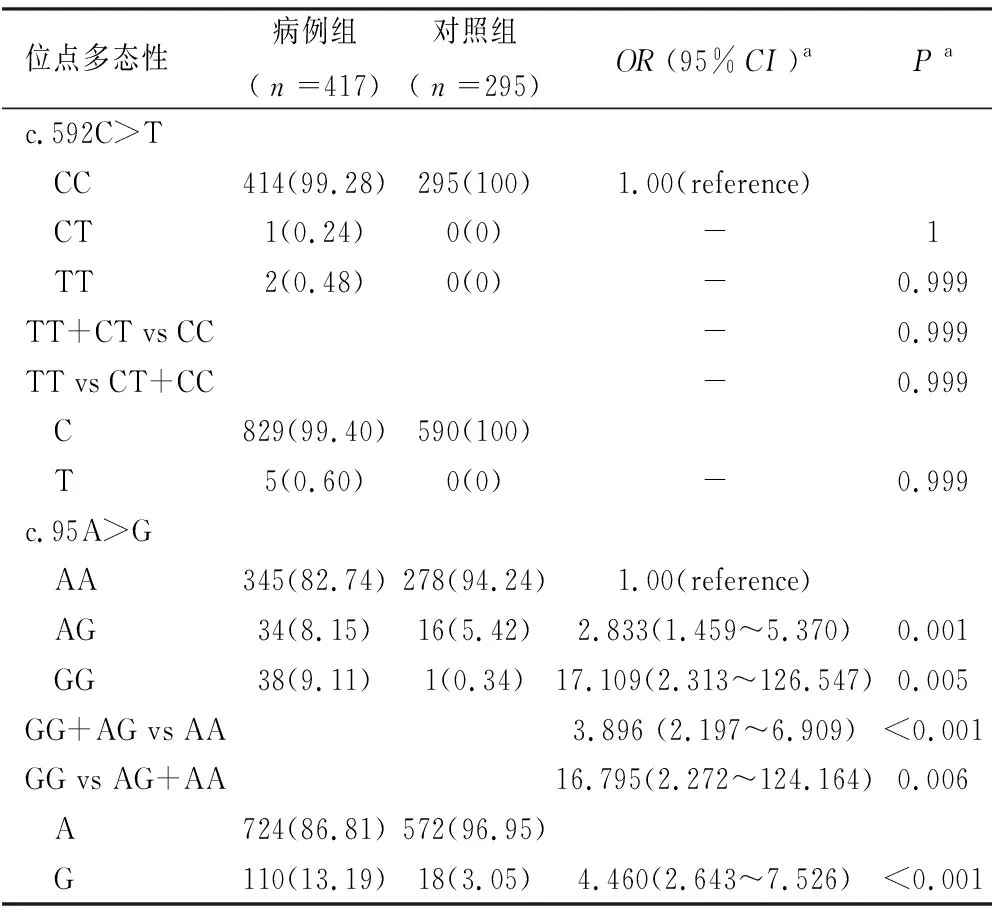
表3 G6PD SNP基因型和等位基因在病例组与对照组的比较

表4 c.592C>T和c.95A>G与性别对G6PD缺乏症的影响
2.4 G6PD基因及其多态性与G6PD表达水平的相关性 用统计学方法检测G6PD酶在病例组和对照组表达水平的差异,并且比较c.592C>T和c.95A>G不同基因型之间G6PD酶表达的水平。研究结果如图1所示:对照组G6PD酶表达水平高于病例组,两组之间G6PD酶表达水平有差异且具有统计学意义(P<0.001,见图1A),说明G6PD缺乏症发病与其酶表达含量降低有关。病例组中,c.592C>T位点的三个基因型CC、CT和TT之间酶表达水平没有差异,无统计学意义(P均>0.05,见图1B)。然而,G6PD酶表达水平在c.95A>G位点AA基因型和GG基因型、AG基因型和GG基因型中表达有差异,且差异具有统计学意义(P均<0.05,见图1C)。图1C表明,携带AA和AG基因型的患者G6PD酶表达活性较高。
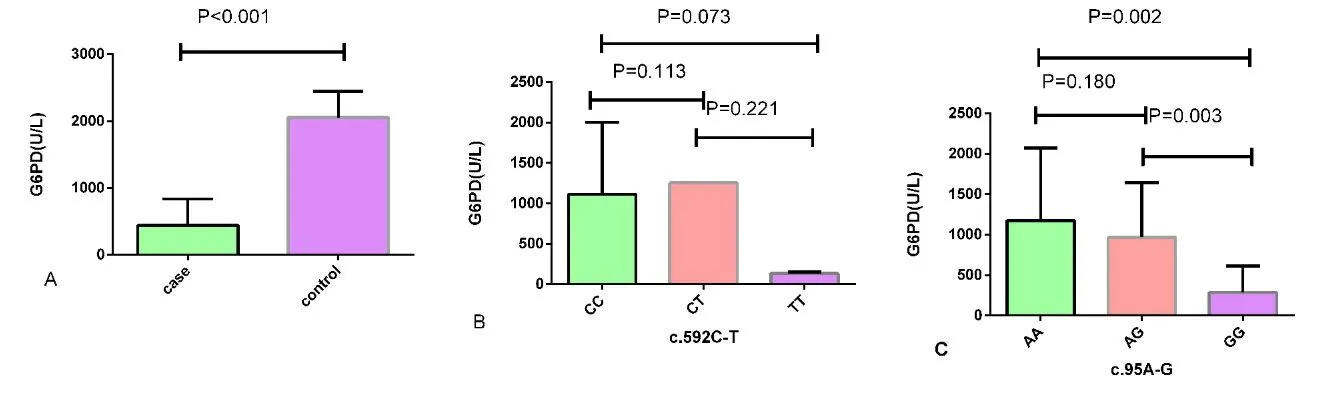
注:A:表示病例组和对照组G6PD表达水平;B:c.592C>T位点不同基因型G6PD表达水平;C:c.95A>G位点不同基因型G6PD表达水平。
2.5 G6PD SNPs单倍型分析 将G6PD基因的两个位点c.592C>T和c.95A>G通过在线SHEsis软件进行单倍型分析。分析结果见表5,c.592C>T和c.95A>G位点有三种单倍型组合,包括CA、CG和TA。CA单倍型在G6PD病例组和正常组分别占86.21%和97.46%。该单倍型在病例组和正常组间差异具有统计学意义(P<0.01,OR=0.171,95%CI:0.098~0.296),CA单倍型可能是G6PD缺乏症的保护因素。CG单倍型在G6PD病例组和正常组分别占13.19%和2.54%,CG单倍型在两组中差异也具有统计学意义(P<0.01,OR=5.865,95%CI:3.382~10.170),提示携带CG单倍型的人患G6PD缺乏症的风险增加,该单倍型是G6PD缺乏症的风险因素。
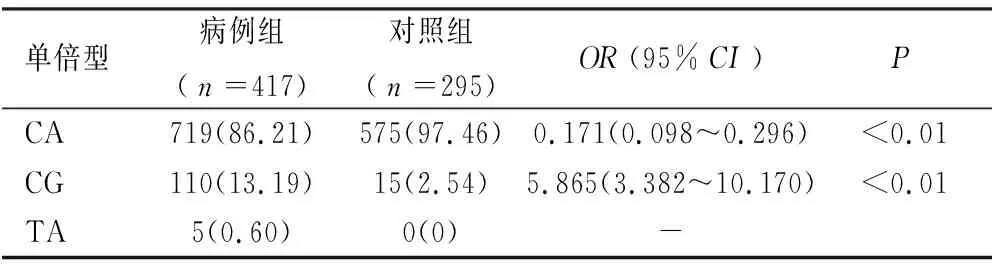
表5 G6PD SNPs单倍型分析及与该疾病发病风险的关系
3 讨论
G6PD缺乏症属于遗传性酶缺陷病,主要是由于G6PD基因发生变异所引起。从1990年到2013年,全世界约4亿人患有G6PD缺乏症,平均每年约4100人死亡[7]。G6PD缺乏症大多是无症状的,然而G6PD缺乏症患者暴露于氧化应激环境中,如接触蚕豆、感染或某些药物时极易产生溶血反应[8]。G6PD基因位于 Xq28 染色体上,该染色体由13个外显子和12个内含子组成,编码515个氨基酸。男性只携带一条X染色体,女性携带两条X染色体,因此男性发病率大于女性。在中国,G6PD 缺乏症主要发生在华南地区,呈“南高北低”的分布特点[6],其中广西地区发病率为8.02%[9],因此,研究广西人群G6PD 基因多态性对于本地区居民健康至关重要。
G6PD缺乏症的发病风险与地域、性别存在相关性,而且与年龄无关。在该研究人群中,我们发现,壮族人群的发病风险明显高于非壮族人群,这与Liu ZD等[6]研究结果相一致,而男性发病风险高于女性,这与G6PD缺乏症主要是由于位于X染色体的基因突变导致G6PD酶表达活性降低有关相一致[10]。进一步研究性别与c.592C>T和c.95A>G相互作用对G6PD缺乏症的影响,发现与携带c.95A>G位点AA基因型的女性相比,女性携带AG基因型和男性携带AA和GG基因型G6PD发病风险显著升高。本研究通过分析G6PD基因相关位点c.592C>T和c.95A>G多态性发现,在417例病例组中c.592C>T位点突变3例,统计学结果表明,c.592C>T位点突变与G6PD缺乏症发病风险不相关,与谭建强等[11]研究发现301例突变基因c.592C>T突变仅1例基本吻合。其次,c.95A>G突变是广西常见的突变类型之一[11-12],本研究发现,c.95A>G位点的基因型AG和GG与G6PD发病风险相关,c.95A>G位点的显性模型、隐性模型及等位基因G与G6PD缺乏症发病风险有关。病例组G6PD酶表达活性明显低于正常对照组,而且c.95A>G位点AA和AG基因型酶活性较高。利用在线SHEsis软件将两个位点c.592C>T和c.95A>G进行单倍型分析,分析结果表明CA单倍型可能是G6PD缺乏症的保护因素,CG单倍型使G6PD缺乏症的发病风险增加。
通过本研究,我们发现c.95A>G遗传多态性与G6PD缺乏症发病风险有关,为G6PD缺乏症提供了相关遗传学的理论基础。虽然目前研究已经证明基因突变可以导致G6PD缺乏症,但是对其相关遗传机制我们会再进一步深入研究。

