柴桂口服液体外抗炎作用的研究
周淑棉,刘梦倩,樊丹阳,胡庭俊
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西大学图书馆,广西南宁 530004)
炎症是免疫系统对感染、损伤或刺激的第一反应,在进行疾病诊断过程中,红、肿、热、疼是炎症反应的基本临床表现[1]。有证据表明抗炎作用是通过调节各种炎性细胞因子水平来实现的,如干扰素、白介素类,肿瘤坏死因子和一氧化氮等[2]。类固醇和非类固醇类抗炎药作为炎症的常规疗法,显示出多种不足和副作用[3]。有鉴于此,天然的抗炎活性药物可作为一个替代选择。传统中药以其毒性小、不易形成耐药性和安全环保等优点备受关注[4-5]。近年来,有关中药联合使用在抗炎作用中的良好效果有较多报道。熊颖[6]综合60例临床病例分析得出,柴胡桂枝干姜汤在临床上可用于治疗慢性浅表性胃炎。张辉果等[7]研究发现,小儿柴桂退热颗粒可以通过降低患儿体内炎症因子表达水平,辅助治疗患儿急性上呼吸道感染并改善其临床症状。柴桂口服液是一种复方中药制剂,方源自张仲景的《伤寒论》中的柴胡桂枝干姜汤,具有小柴胡汤与理中汤合方之义,由小柴胡汤减去半夏、人参、大枣、生姜,加上干姜、桂枝、牡蛎和天花粉而成[8]。有研究表明[9],柴桂制剂在抗炎、抗病毒及增强机体免疫方面作用显著,目前未见有柴桂制剂在动物炎症性疾病防治方面的研究。因此,本研究旨在明确柴桂口服液的体外抗炎特性,为研发具有抗炎功效的柴桂制剂提供依据和参考。
1 材料与方法
1.1 材料
1.1.1 药品和细胞 柴桂口服液,河南牧翔动物药业有限公司研制,规格为1.44 g/mL(即每1 mL柴桂口服液相当于原生药1.44 g),100 mL/瓶,批号20190901;小鼠RAW 264.7巨噬细胞,购自中国科学院上海生命科学院细胞研究所。
1.1.2 主要试剂 CCK-8试剂盒(批号A311-02-AA),南京诺维赞生物科技有限公司产品;脂多糖(LPS),北京索莱宝科技有限公司产品;小鼠TNF-α测试盒(批号M190919-102a)、IL-6测试盒(批号M190919-004a)、IL-1β测试盒(批号M190930-001b)和IL-8 测试盒(批号M190930-104b),均为深圳欣博盛生物科技有限公司产品;一氧化氮测试盒(批号20191007),南京建成生物研究所产品。
1.1.3 主要仪器 多功能微孔板检测仪(INFINITE M200 PRO),瑞士TECAN公司产品;倒置显微镜(TS100-F),Nikon公司产品;二氧化碳培养箱(C150),德国BINDER公司产品;实时定量PCR仪(CFX 96),Bio-Rad公司产品;超声波细胞粉碎机(SCITENTZ),宁波新芝生物科技股份有限公司产品。
1.2 方法
1.2.1 CCK-8法测定柴桂口服液对RAW264.7安全浓度试验 设置细胞对照组和不同浓度药物组(800 μg/mL、400 μg/mL、200 μg/mL、100 μg/mL、50 μg/mL、25 μg/mL和12.5 μg/mL),每组8个重复。将处于对数生长期的RAW264.7细胞消化后轻轻吹打至单个细胞,调节浓度至4×105个/mL,每孔100 μL加至96孔板中,37℃、5% CO2培养箱培养24 h。第2 d弃上清,PBS洗2次,药物组每孔加入100 μL上述稀释好的药物,细胞对照组加入100 μL细胞维持液,37℃、5% CO2培养箱培养24 h。取出96孔培养板吸弃培养液,PBS洗3次后,每孔加入100 μL含100 g/L的CCK-8的DMEM高糖完全培养液,避光孵育1 h,用酶标仪测OD 450 nm值。
1.2.2 柴桂口服液对LPS诱导RAW264.7细胞分泌炎性细胞因子的调节作用 设置细胞对照组、LPS对照组(1 μg/mL)及3个不同浓度的柴桂口服液药物组(100 μg/mL、50 μg/mL及25 μg/mL)。每组3个重复。取对数生长期的RAW264.7细胞调整浓度为5×106cells/mL,按2 mL/孔接种于12孔培养板中。37℃、5% CO2培养箱孵育过夜使细胞贴壁。第2 d吸弃上清,药物组加入稀释好的各浓度柴桂口服液2 mL,孵育1 h后,除空白对照组外,其他各组加入LPS(终浓度1 μg/mL)处理,继续培养24 h。24 h时收集细胞及上清液,样品(含细胞及上清液)经超声破碎处理后,严格按照ELISA检测试剂盒的程序操作进行测定IL-6、IL-8、IL-1β、TNF-α及NO的水平。
1.2.3 RT-PCR测定柴桂口服液对LPS诱导RAW264.7细胞炎性细胞因子mRNA表达水平 试验分组及处理同1.2.2。RAW264.7细胞经处理培养24 h,PBS洗3次,每孔加入0.5 mL TRlzol裂解液,传统法提取细胞总RNA,并反转录为cDNA,荧光定量PCR扩增体系及反应程序参考ChamQ Universal SYBR qPCR Master Mix说明书操作。引物序列见表1。

表1 检测RAW264.7细胞中炎症因子的Real-time PCR引物
1.2.4 统计学分析 数据采用SPSS软件进行统计学分析,试验结果用平均值±标准差表示。组间数据差异性采用单因素方差分析。
2 结果
2.1 柴桂口服液对RAW264.7细胞活性的影响
通过CCK-8法测定了柴桂口服液对RAW 264.7细胞24 h细胞活性的影响。由表2可见,LPS刺激细胞24 h,柴桂口服液在200 μg/mL~800 μg/mL显著降低细胞的存活率(P<0.05)。12.5 μg/mL~100 μg/mL的柴桂口服液对RAW264.7细胞的存活率无显著影响,与细胞对照组相比差异不显著(P>0.05)。因此,筛选药物浓度为100 μg/mL、50 μg/mL和25 μg/mL进行下一步的抗炎试验。
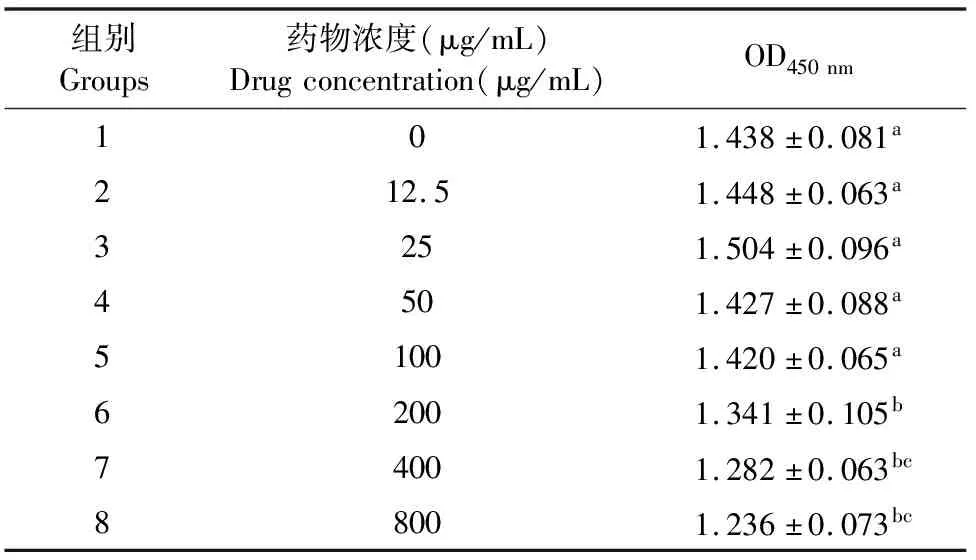
表2 柴桂口服液对RAW264.7细胞存活率的影响(Mean±SD,n=8)
2.2 柴桂口服液对LPS诱导RAW264.7细胞分泌促炎细胞因子的调节作用
LPS处理细胞24 h,LPS模型组RAW264.7细胞分泌炎性因子IL-6、IL-8、IL-1β、TNF-α及NO的水平极显著高于细胞对照组(P<0.01),而经过不同浓度的柴桂口服液处理后,能有效减少上述细胞因子的分泌量。
与细胞对照组比较,LPS刺激细胞后IL-6的水平极显著上调(P<0.01);与LPS模型比较,25 μg/mL~100 μg/mL的柴桂口服液均极显著降低细胞分泌IL-6的水平(P<0.01);柴桂口服液100 μg/mL组细胞IL-6水平极显著低于25 μg/mL和50 μg/mL组(P<0.01)。呈现一定的量效关系。
LPS刺激后细胞分泌IL-8水平升高,LPS模型组细胞IL-8的水平极显著升高(P<0.01);与LPS模型组相比,25 μg/mL~100 μg/mL的柴桂口服液均能极显著降低IL-8的水平(P<0.01)。柴桂口服液100 μg/mL和50 μg/mL组的IL-8水平均极显著低于25 μg/mL组,呈现一定的量效关系。
LPS刺激后细胞分泌IL-1β的水平升高,与细胞对照组比较,LPS刺激细胞后IL-1β的水平极显著升高(P<0.01);与LPS模型相比,25 μg/mL~100 μg/mL的柴桂口服液均极显著降低细胞分泌IL-1β水平(P<0.01)。柴桂口服液100 μg/mL组的IL-1β水平极显著低于25 μg/mL和50 μg/mL组(P<0.01),呈现一定的量效关系。
与细胞对照组比较,LPS刺激细胞后TNF-α的水平极显著上调(P<0.01);与LPS模型相比,25 μg/mL~100 μg/mL的柴桂口服液均极显著降低细胞分泌TNF-α的水平(P<0.01),呈现明显的量效关系。
与细胞对照组比较,LPS刺激细胞后NO的水平极显著升高(P<0.01);与LPS模型相比,25 μg/mL~100 μg/mL的柴桂口服液均极显著降低细胞分泌NO的水平(P<0.01)。
综合上述试验结果,LPS刺激细胞后,显著促进了炎症因子IL-6、IL-8、IL-1β、TNF-α及NO的分泌,而用柴桂口服液处理后,明显降低了上述因子的水平,表明柴桂口服液能降低由LPS引起的细胞炎性因子IL-6、IL-8、IL-1β、TNF-α及NO的分泌水平,从而产生良好的抗炎效果。

表3 柴桂口服液对LPS诱导RAW264.7细胞分泌炎性因子的调节作用(Mean±SD,n=3)
2.3 柴桂口服液对LPS诱导RAW264.7细胞炎性细胞因子mRNA水平调节作用
结果如表4,LPS刺激细胞后,RAW264.7细胞IL-6、IL-8、IL-1β、TNF-α及iNOS的mRNA表达水平极显著升高,与细胞对照组比较差异极显著(P<0.01),柴桂口服液能有效拮抗上述炎症因子mRNA的过度表达。与LPS模型组比较,药物组细胞IL-6、IL-8、IL-1β、TNF-α和iNOS的mRNA的表达水平均被极显著抑制(P<0.01),并且药物浓度越高,抑制效果越明显。

表4 柴桂口服液对LPS诱导RAW264.7细胞炎性因子mRNA表达调节作用(Mean±SD,n=3)
3 讨论
炎症是动物体对各种致炎因素及其所引起的损伤产生的防御性反应,可以定义为促炎因子的顺序释放。细胞因子在炎症过程中通过激活机体的免疫系统,促进免疫细胞释放炎症介质,调节细胞或组织内细胞因子的平衡,如IL-1β、IL-6、IL-8和TNF-α等可促进炎症细胞聚集、活化和炎症介质释放,影响着炎症的发生发展[10-12]。有研究报道证实[13],中药可以调节巨噬细胞的极化、凋亡以及免疫活性,抑制炎症相关因子的过度释放,进而减轻炎症反应及控制炎症进展。

M.DNA Marker 2 000;1~5.CELL组、LPS组、25 μg/mL组、50 μg/mL组及100 μg/mL组
抑制炎症因子的分泌是中药发挥调节作用的主要方式之一,近年来有关中药复方制剂抗炎效果的报道被证实。张丽娜等[14]发现中药复方能有效抑制小鼠链球菌性肺炎p38MAPK信号通路的活化,控制炎症进程。三黄方通过抑制细胞因子NO、IL-1β、PGE-2和TNF-α释放,发挥抗炎效果,且其在治疗炎症性疾病时毒性较低[15]。黎涛等研究发现,柴桂退热颗粒联合炎琥宁能够通过抑制炎症因子hs-CRP、TNF-1α、IL-4的产生来缓解炎症的临床症状[16]。多种中药及复方均可通过下调巨噬细胞内IKKβ、JNK、NF-κB和MAPK的磷酸化水平,抑制NF-κB、JNK和MAPK信号通路的转导,进而减少促炎因子TNF-α、IL-6和IL-1β等的合成[17]。研究表明,中药还可通过抑制巨噬细胞中NLRP3炎症小体的活性来下调炎症相关蛋白的表达,从而减少IL-12、TNF-α和NO等促炎因子的合成与释放[18]。刘俊等[19]发现野黄芩苷可降低LPS诱导的RAW264.7细胞内JNK和p38的磷酸化水平,抑制MAPK信号通路转导,进而降低TNF-α的表达,并上调TGF-β与IL-10的表达水平。丹参宁胶囊是临床用于治疗非酒精性脂肪性肝炎的有效药物,研究证实其可通过上调巨噬细胞中microRNA-152的表达来降低TNF-α和IL-6 的mRNA的表达水平,从而抑制TNF-α和IL-6的分泌,减轻炎症反应[20]。黄芩素能够抑制脂多糖诱导的RAW264.7细胞COX-2的活性,阻止转录因子C/EBPβ与DNA结合,从而抑制花生四烯酸的代谢而产生抗炎作用;柴胡皂苷a与柴胡皂苷d通过抑制LPS的活性,以减少细胞中COX-2和iNOS的表达;桂枝挥发油具有良好的抗炎、免疫及促软骨细胞增殖等药理活性[21-23]。
抑制炎症因子抑制炎性介质特别是炎性细胞因子,如白介素IL-1β、IL-6和TNF-α的过度产生可能预防或抑制多种炎性疾病[24]。本试验通过LPS刺激RAW264.7细胞建立炎症模型,观察柴桂口服液对LPS诱导的炎症反应的干预作用。结果显示,LPS组细胞中IL-6、IL-8、IL-1β、NO及TNF-α的水平极显著升高,不同浓度药物处理后,极显著降低了上述炎症因子的分泌及相关炎症基因的mRNA表达。提示柴桂口服液能抑制因LPS导致的炎症因子的过度分泌,调节细胞内炎症因子的平衡,从而减缓炎症造成的损伤。

