基于网络药理学技术探讨药用昆虫琵琶甲的活性酚类成分与作用机制
罗建蓉 唐 策 李轩豪 张 艺
1.大理大学药学院,云南 大理 67100;2. 成都中医药大学,四川 成都 611137
琵琶甲是云南民间常用的一种药用昆虫,为鞘翅目拟步甲科昆虫喙尾琵琶甲(BlapsrynchopeteraFairmaire)的成虫,收载于《中国民族药辞典》,具有清火解毒、软坚散结、消肿止痛、熄风定惊之功效[1]。云南民间常用于治疗发烧、咳嗽、胃炎、疔疮、肿瘤等疑难杂症[2]。现代研究发现琵琶甲具有抗癌、抗炎、抗氧化和抗菌等药理作用[3];琵琶甲含有酚类[4-5]、多巴胺衍生物[6]、生物碱[7]、环肽[8]、油脂等成分类型。本课题组前期从琵琶甲中分离得到多个酚类成分,并包括5个新酚类成分[5]。已报道的琵琶甲化学成分中,酚类数量最多,是琵琶甲的重要化学成分组成。从琵琶甲中发现的原儿茶酸、羟基酪醇和原儿茶醛,这些酚类也广泛分布在果蔬、植物药中,对其药理作用研究较广且深入,而对其他酚类,尤其从该昆虫中发现的新酚类成分的药理研究较为缺乏且不深入,大多局限在抗氧化、抗癌等体外活性初筛阶段,其药理作用机制尚不明确,限制了琵琶甲药用价值的开发利用。
网络药理学为研究中药“多成分-多靶点-多途径”复杂体系治疗复杂疾病提供很好的研究策略和方法。网络药理学方法在乌头汤、六味地黄丸、清络饮等中药方剂的药效物质与作用机理的研究中得到有效运用[9-10]。文章基于网络药理学方法,以琵琶甲中酚类成分为研究对象,采用反向药效团匹配方法筛选潜在靶点蛋白和作用通路,通过构建“成分-靶点-通路”网络模型,探讨琵琶甲可能发挥药效的活性成分,预测其对多种疾病可能存在的药理作用及作用机制,为琵琶甲酚类成分的研究提供参考和借鉴,并为昆虫琵琶甲药用价值的开发利用提供依据。
1 材料与方法
1.1 化学成分收集与类药性分析 结合课题组前期研究及检索CNKI、SciFinder、PubMed等数据库,提取琵琶甲的酚类成分,依据Lipinski 规则筛选其类药性。Lipinski 规则是药物分子设计和筛选中最常用的规则之一,如果化合物具有良好的吸收和渗透特性,应满足以下条件[11]:①氢键供体数目不大于5;②氢键受体数目不大于10;③脂水分配系数Clog P 不大于5;④相对分子质量不大于500。
1.2 琵琶甲酚类成分潜在靶点预测 运用反向分子对接服务器PharmMapper server,预测化合物或天然活性成分的潜在作用靶点[12]。将酚类结构导入PharmMapper服务器,获取靶蛋白的PDB ID,靶点名称(target name)和匹配值(Fit Score)。匹配值越高代表分子与靶点越匹配,故取匹配值前10位的蛋白作为该化合物的重要靶点蛋白。命名不规范的靶点需进一步通过UniProt数据库获得规范的蛋白编号,并获得相应的基因信息。
1.3 靶点相互作用网络构建及核心靶点筛选 将获得的琵琶甲潜在作用靶点导入String数据库,限定物种为Homo sapiens,获得靶点的相互作用关系,通过Cytoscape 软件构建PPI网络,并进行网络的拓扑特征分析,筛选网络中的核心靶点,并将节点大小和颜色设置为反应degree的大小,线条的粗细表示Combined score值的大小。
1.4 通路富集分析 将靶点信息导入生物分子功能注释系统数据库MAS 3.0,得到靶点的相关通路信息,并应用KEGG通路数据库进行通路注释分析和富集分析[13]。
1.5 琵琶甲主要酚类成分-靶点-通路网络构建 以筛选的25个酚类成分、潜在靶点和通路为网络节点(node),导入Cytoscape软件,构建琵琶甲酚类成分-靶点-通路网络图。
2 结果
2.1 琵琶甲中酚类成分的收集与类药性分析结果 共收集到25个类药性符合Lipinski规则的活性酚类成分,化合物相关信息见表1。它们大多具有邻二酚羟基的结构特点,其中化合物1~7、10~13是从昆虫琵琶甲中发现的新化合物;原儿茶酸、羟基酪醇和原儿茶醛则在天然产物中广泛分布,且药理活性多样。

表1 琵琶甲中25个酚类化学成分基本信息
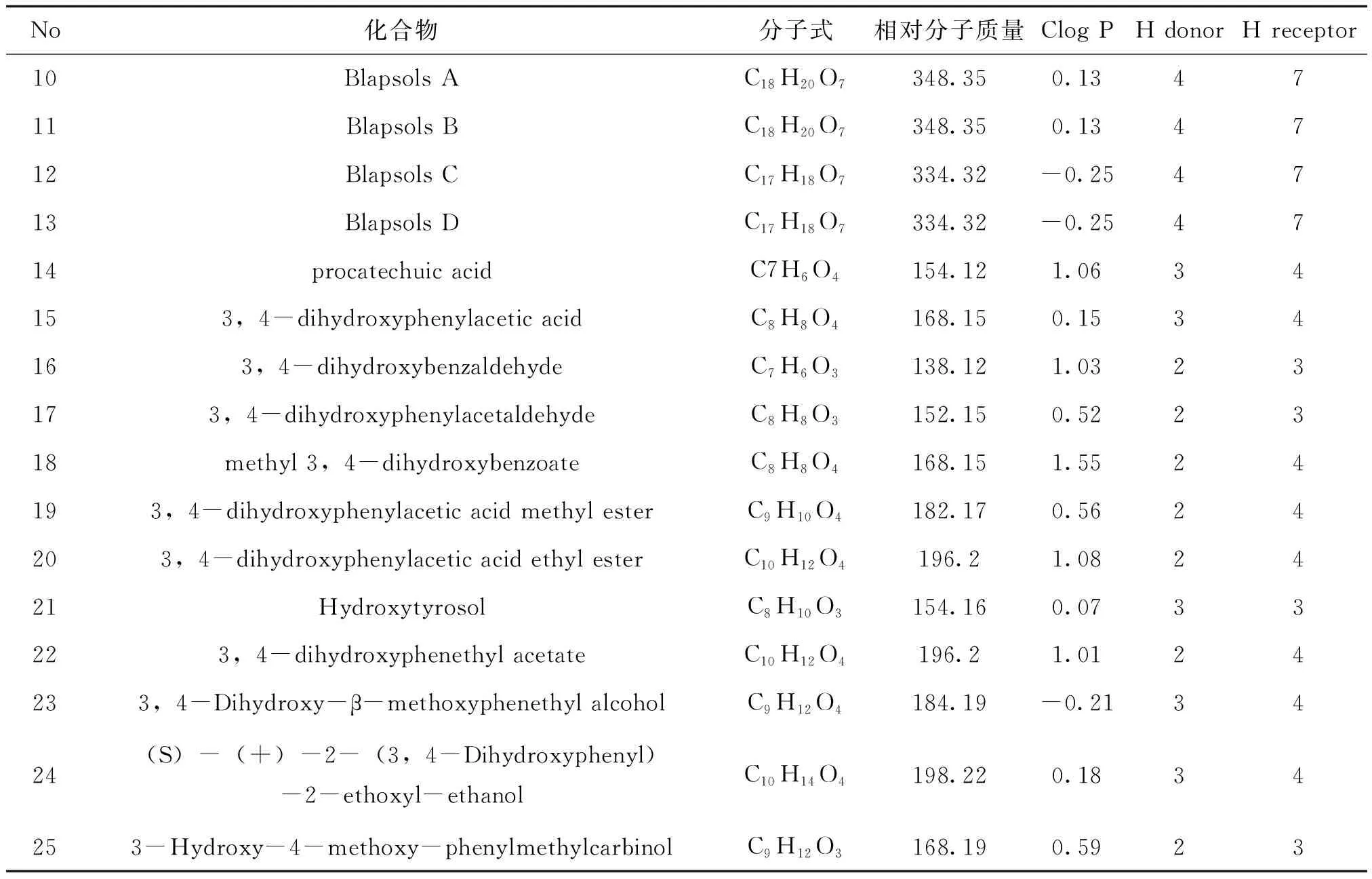
续表1
2.2 琵琶甲中酚类成分潜在靶点预测 经反向药效团匹配实验预测得25个酚类成分的潜在作用靶点,各取匹配值前10的靶点,去掉重复靶点共得121个不同靶点。结果显示琵琶甲中不同酚类成分既可作用于相同靶点,也可作用于不同靶点,其中CRABP2、GCK、FKBP1A、PCK1、NR3C1、MME、SULT2B1、FGG、MTAP、GSTT2B、SRC、HRAS、IL2、PNMT、IMPA1等靶点出现的频率较高,是主要的潜在靶点蛋白群,它们在细胞生长、死亡、细胞周期等细胞过程中发挥重要作用。

图1 靶点蛋白PPI网络
2.3 琵琶甲中酚类成分靶点蛋白的PPI网络分析 剔除独立于网络之外的靶标蛋白,得酚类成分的靶点蛋白PPI网络,如图1所示。在PPI网络中,包含121个节点、437 条边,平均度值为7.2,靶点的degree值越大,节点越大,颜色越深,表示靶点重要性越大。SRC、HRAS、IL2、GART、AR、F2、KDR、RXRA、JAK2等靶点的度值较高,为连通网络中其他节点的桥梁,在网络中发挥关键作用,靶点间相互作用、协同起效。
2.4 琵琶甲中酚类成分潜在靶点的通路注释分析 121个潜在靶点投入MAS 3.0生物分子功能注释系统,获得72条P小于0.05的重要通路,并经KEGG数据库注释分析,主要涉及疾病、免疫与炎症、内分泌、信号转导、代谢等相关信号通路,表2列举出显著性和频率较高的42条相关通路信息。与人类疾病直接相关通路有12条,为前列腺癌、小细胞肺癌、子宫内膜癌、非小细胞肺癌、急性髓系白血病、甲状腺癌、膀胱癌、黑色素瘤、原发性免疫缺陷、阿尔茨海默病和二型糖尿病,可见涉及肿瘤类疾病相关信号通路最多。涉及免疫与炎症相关的重要通路主要有黏着斑、血管内皮生长因子、黏着连接、过氧化物酶体增殖剂激活受体、T细胞受体信号通路、花生四烯酸代谢、细胞丝裂原活化蛋白激酶、FcεRI、Jak-STAT信号通路等。与内分泌相关的主要通路有胰岛素信号通路、肾素-血管紧张素系统、PPAR、脂肪细胞因子信号通路、促性腺激素释放激素信号通路等。与代谢相关通路中,嘌呤代谢、细胞色素P450介导的外源性物质代谢、淀粉和蔗糖代谢、糖酵解和糖异生、嘧啶代谢和谷胱甘肽代谢显著性和频数居前列。与信号转导相关主要通路为VEGF、表皮生长因子受体、紧密连接、Jak-STAT等。
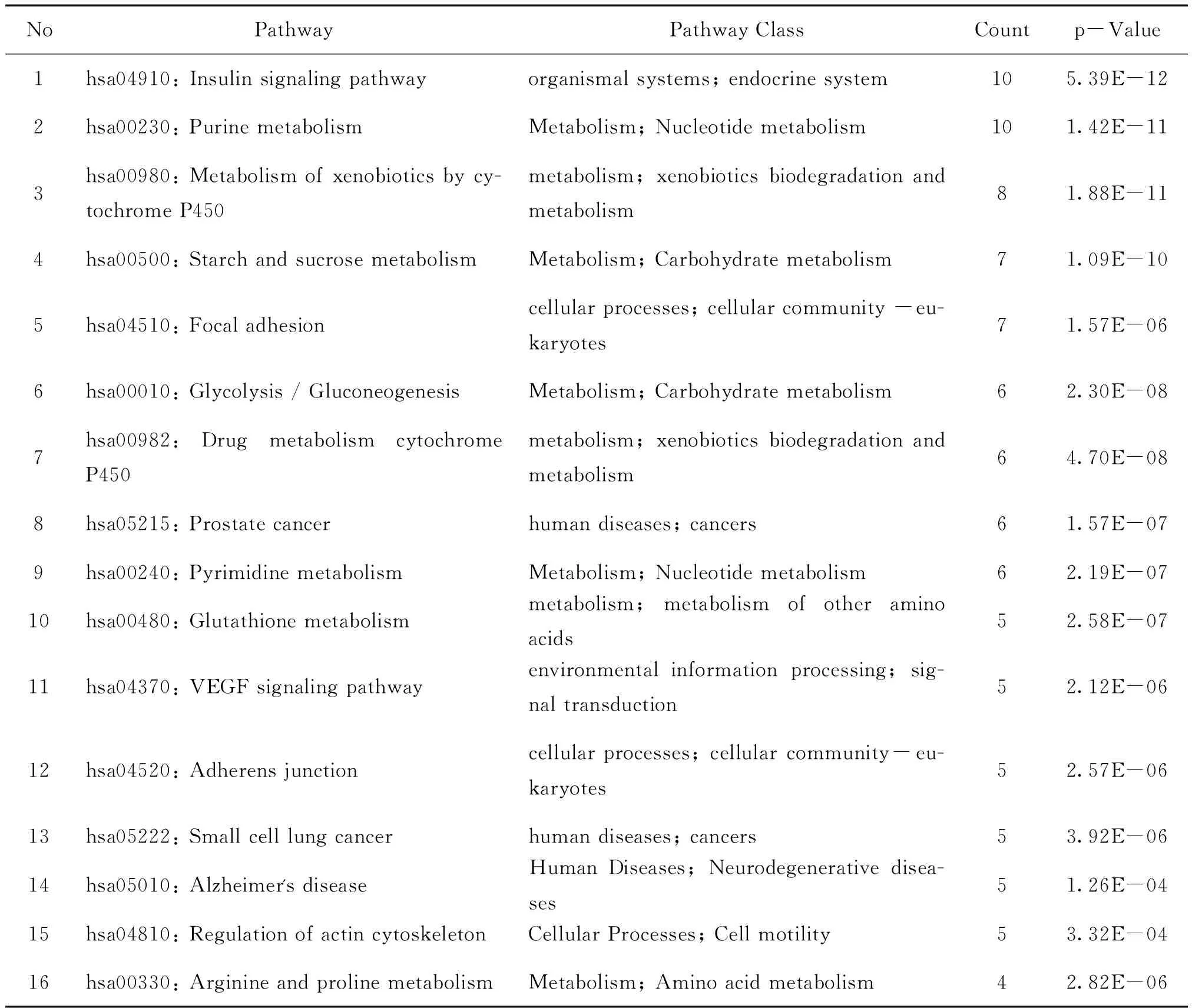
表2 琵琶甲主要酚类成分潜在作用通路

续表2
2.5 GO富集分析 琵琶甲中酚类成分潜在的121个靶点经 MAS 3.0系统进行GO富集分析,获取生物学过程、细胞组成和分子功能的富集条目,预测靶点的功能分布。GO富集结果显示,以P<0.05为标准,靶点基因主要富集于364个生物学过程、243 种分子功能和68类细胞组成。其中,在生物学过程中,信号转导、蛋白质水解、碳水化合物代谢、氧化应激、转录调控和DNA依赖性所占比例较大;细胞质、细胞核、胞质溶胶、质膜、膜、胞外区和线粒体在细胞组成中较重要;在分子功能中,转移酶活性、蛋白结合、核苷酸结合、离子结合、ATP结合、锌离子结合、水解酶活性和肽酶活性作用较突出。图2分别列出了显著性较高和比例较大的26种生物过程、20种细胞组成和23种分子功能。
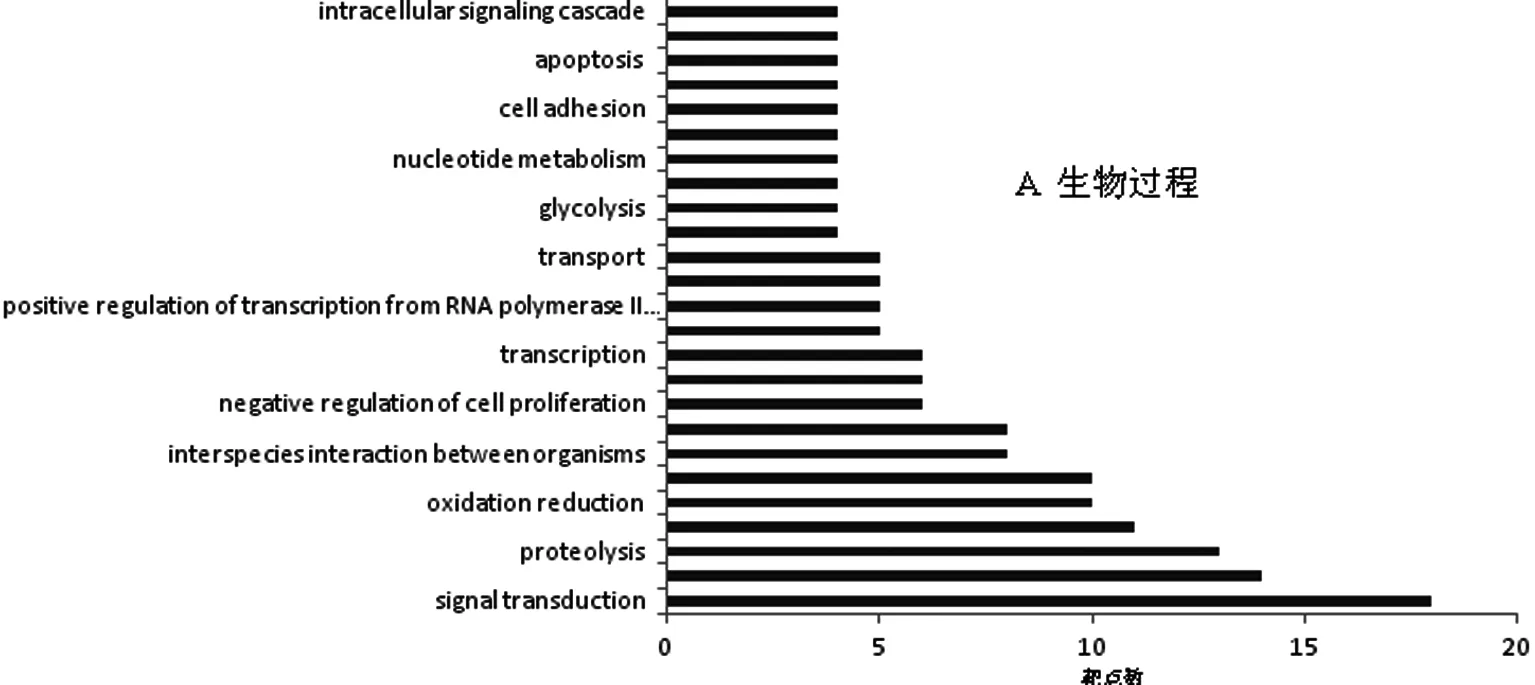

图2 琵琶甲酚类成分潜在靶点的GO富集分析

图3 化合物-靶点-作用通路网络
2.6 琵琶甲酚类成分-靶点-通路网络构建与分析 25个酚类成分、121个靶点及72条信号通路共同组成网络图中的218个节点,成分、靶点、通路之间的相互作用组成了487条边,具体网络关系如图3所示。分析结果表明,靶点GTP结合Harvey 大鼠肉瘤病毒癌基、糖原合成酶激酶3β、磷酸烯醇丙酮酸羧激酶、葡萄糖激酶、细胞视黄酸结合蛋白、非受体型酪氨酸激酶、乙醇脱氢酶族3、3-磷酸肌醇依赖性蛋白激酶1、及脑啡肽酶的网络节点联接度排名前10位,为网络的枢纽节点,表明它们可能是琵琶甲酚类成分的核心作用靶点。由图3可见,琵琶甲中酚类成分、靶点、通路间存在复杂的网络关系,相同成分对应多个靶点,同一靶点连接多种成分,多条通路之间通过共有靶点连接存在协同作用,而非孤立的,体现出多成分、多靶点、多途径的网络特征。
3 讨论
药用昆虫琵琶甲富含蛋白、多肽、油脂、多糖等大分子及氨基酸、核苷等营养成分,而其丰富的小分子次生代谢产物所发挥的药效不容忽视。尽管该昆虫的药用价值获得持续关注,但仍缺乏研究从整体上来阐释其物质基础、药效及其作用机制。目前对琵琶甲的药理实验研究主要集中在对其总提物的抗肿瘤和抗炎活性方面[3],且未深入研究相关作用机制。故本研究从网络药理学和系统生物整体的角度探讨琵琶甲主要酚类活性成分的药理作用机制,并阐释琵琶甲消炎、消包块的传统功效,预测结果发现琵琶甲除对肿瘤、炎症外,还对糖尿病、阿尔茨海默病等内分泌系统和神经系统方面疾病有治疗作用,并预测得到相关重要靶点及通路,可为昆虫琵琶甲药用价值的深入研究和开发提供参考。
预测发现琵琶甲酚类成分的121个主要作用靶点通过干预胰岛素信号通路、嘌呤代谢、黏着斑、VEGF信号通路、PPAR信号通路等72条主要的相关疾病代谢通路发挥多种疗效,反映琵琶甲酚类成分与靶点和通路间复杂的网络关系。分析网络发现有8条通路与人类疾病癌症直接相关,分别为前列腺癌、小细胞肺癌、子宫内膜癌、非小细胞肺癌、急性髓系白血病、甲状腺癌、膀胱癌和黑色素瘤,由此可见抗癌作用可能是琵琶甲主要酚类成分的最主要药效作用之一。同时网络还显示在癌症信号通路中靶点HRAS、PDPK1、RXRA、FGFR1、GSK3B、RARB、AR、GSTP1、NOS2、APAF1、PTK2、CTNNA1、PIM1、MMP、RARA、DAPK1等发挥重要作用,这对探讨琵琶甲酚类成分的抗癌作用靶点及机制具有重要指导意义。本次网络药理学预测结果琵琶甲中酚类成分的抗癌作用得到了实验研究证实,blapsins A、blapsins B、rynchopeterines B、rynchopeterines C、原儿茶酸、羟基酪醇、原儿茶醛等成分具有抗肿瘤活性。研究表明blapsins A和blapsins B具有抑制癌症HIS14-3-3蛋白活性[14],rynchopeterines B和rynchopeterines C能抑制癌细胞Caco-2 和A549 的生长[5]。原儿茶酸能通过抑制成纤维细胞生长因子、MMP2和MMP9蛋白表达,从而抑制A549、H3255和Calu-6三种非小细胞肺癌细胞生长[15]。原儿茶酸通过抑制Ras / Akt / NF-κB通路,进而抑制黑色素瘤细胞在小鼠肝脏的转移[16]。羟基酪醇通过抑制Akt / STAT3和NF-κB通路,抑制雄激素受体的应答,从而抑制前列腺癌细胞增殖[17]。高剂量羟基酪醇可诱导乳头状甲状腺癌细胞系和滤泡甲状腺癌细胞凋亡[18]。原儿茶醛能抑制人结直肠癌HCT116细胞生长和诱导细胞凋亡[19]。
此外,网络药理学预测得琵琶甲酚类成分作用于Focal adhesion、VEGF、PPAR、Adherens junction、MAPK、Jak-STAT、ErbB、Fc epsilon RI、mTOR、T cell receptor、B cell receptor、Arachidonic acid metabolism等多条炎症相关的重要通路,推测抗炎可能是琵琶甲酚类的重要药效作用。实验研究表明,rynchopeterines B 能通过降低TNF-α、IL-1β、PGE2、COX-2和TGF-β1炎症因子表达,发挥出显著的抗大鼠慢性前列腺炎作用[20]。Blapsols A~D能够抑制COX-2活性[6]。原儿茶酸可抑制LPS刺激角质细胞的炎性介质产生[21];还能对LPS诱导的小鼠急性肺损伤发挥保护作用[22]。原儿茶酸明显抑制高糖诱导的人肾小球系膜细胞(MCs)增殖,保护MCs免受高糖损伤[23]。但目前对琵琶甲酚类成分抗炎作用的研究报道还较少,有必要加强相应的实验验证工作。
研究预测发现琵琶甲中酚类成分主要通过胰岛素、二型糖尿病、肾素-血管紧张素系统、PPAR、mTOR、脂肪细胞因子、GnRH、黑素生成等信号通路,对内分泌系统疾病发挥作用。研究发现,羟基酪醇对氧化损伤相关疾病具有良好的防治效果,它能缓解血管内皮功能障碍,减缓动脉粥样硬化的发展[24]。羟基酪醇能改善胰岛素信号通路,并通过抑制mTOR改善胰岛素抵抗;能降低糖尿病模型大鼠的空腹血糖,提高肝糖原含量;还能提高MetS模型大鼠的糖耐量及胰岛素敏感性[25]。原儿茶醛在抗动脉粥样硬化、保护心肌、抗血栓形成,神经保护,抗纤维化等方面具有较好的药理活性[26]。
研究结果还显示,琵琶甲中酚类成分在神经系统疾病方面主要涉及GSK3B、NOS2、 HRAS、BACE1、PPP1CC等重要靶点,和阿尔茨海默病、神经活性配体-受体相互作用、神经营养因子、FcεRI、ErbB、MAPK等通路发挥作用。其中,GSK-3β参与阿尔茨海默病、神经营养因子信号通路、细胞周期、磷酸化途径、胰岛素、癌症、ErbB等信号通路,GSK-3β是tau激酶,在AD病程发展中的记忆障碍、小胶质细胞介导的炎症、tau蛋白磷酸化、炎性因子的释放以及突触丢失和神经元死亡等方面,从多途径发挥抗AD的作用[27]。研究发现,羟基酪醇能够保护神经元抵御Aβ造成的损伤,显著降低神经元内氧化应激水平;能有效抑制多巴胺氧化诱导的细胞凋亡,可以辅助单胺氧化酶抑制剂用于帕金森病的治疗[24];原儿茶酸有良好的神经保护作用,可改善Aβ1-42诱导的PC12细胞毒性,对阿尔茨海默病(AD)细胞模型有保护作用,对AD具有潜在的治疗作用[28];还能明显降低帕金森模型大鼠血清TNF-α、MDA及IL-1β水平,提高SOD活性,对帕金森病引起的氧化应激损伤有保护作用[29]。其他酚类成分的相关药理作用,仍需进一步细胞及动物实验验证。
昆虫琵琶甲中的酚类成分繁多,目前对其药理作用的研究主要集中在原儿茶酸、羟基酪醇和原儿茶醛上,而对从该昆虫中发现的11个新酚类成分rynchopeterines A~E、Blapsols A~D、blapsins A和blapsins B的研究甚少,局限在DPPH自由基清除作用,肿瘤细胞毒作用,对COX抑制活性等方面的体外活性测试上,它们的药理作用及机制仍有待深入探讨。本研究预测得这些酚类的相关药理作用、靶点蛋白与作用通路将为进一步深入药理作用机制的实验研究提供参考。

