系统性红斑狼疮患者外周血调节性B细胞表达与预后的相关性
王智,丁华兵,张永生
(新疆库尔勒解放军第九五一医院,新疆维吾尔自治区库尔勒841000)
系统性红斑狼疮(SLE)是一种多因素引起的自身免疫病,可反复发作,以女性多见,发病高峰在15~40岁[1-2]。现代研究显示该病的发病涉及到行为生活方式、遗传、免疫和环境等因素的变化,也是一种多基因遗传病;临床特征是多脏器损害,多伴随有血液系统损害,可造成患者出现失血、营养缺乏或者溶血性贫血等并发症,造成严重预后[3-4]。临床上常用疾病活动指数(SLEDAI)来评价SLE的活动性,但是该种评价的客观性不强,且评价体系比较繁琐[5-6]。调节性B淋巴细胞(Breg)在免疫应答的负性调控中发挥着重要作用,可以作为抗原递呈细胞、产生抗体、分泌细胞因子,从而在肿瘤微环境中通过抑制有效的抗肿瘤免疫,促进肿瘤的发生与发展[7-8]。特别是CD19调节性B淋巴细胞可通过产生IL-10等抑制炎性细胞因子介导免疫耐受,抑制过度炎性反应,从而抑制有害的免疫反应[9-11]。本文具体探讨了SLE患者外周血调节性B细胞表达与预后的相关性,以明确调节性B细胞参与SLE免疫以及潜在的机制,以期推进SLE免疫治疗的开展。现总结报道如下。
1 资料与方法
1.1 一般资料 本院得到了所有入选者的知情同意与本院伦理委员会的批准;2012年1月—2018年6月选择在本院诊治的SLE患者82例作为病例组,其中男22例,女60例;年龄6~56岁,平均(37.92±2.19)岁;平均病程(6.58±0.82)年;平均SLEDAI评分(11.48±1.49)分;平均体质量指数(21.48±1.72)kg/m2。
同期选择在本院体检的健康人群82例作为对照组,其中男24例,女58例;年龄8~58岁,平均(38.00±1.47)岁;平均体质量指数(22.09±2.77)kg/m2。2 组人群的性别、年龄、体质量指数等对比差异无统计学意义,有可比性。
纳入标准:①符合《内科学》中关于SLE的诊断标准;②采血前都未接受过化疗、放疗或免疫治疗;③SLEDAI评分≥9分。
排除标准:①非SLE引起的心、肾、脑、血液、肝、肺等系统的损害;②临床资料缺乏者。
1.2 方法
1.2.1 常规指标检测 记录2组常规血液学指标,包括红细胞计数、血小板计数、白细胞计数、血红蛋白等,由全自动血液分析仪检测。
1.2.2 外周血调节性B细胞表达情况 空腹状态下采集所有入选者的静脉血3~5 mL,平分为2管。其中一管不进行抗凝,静置放置30 min后2 000 r/min,离心15 min,取上层血清,采用酶联免疫吸附试验(ELISA)法(上海生工公司,批号20149222,检出限0~100 pg/mL)检测IL-10含量。另外一管进行乙二胺四乙酸(EDTA)抗凝,将外周血单个核细胞分离。每管中加入淋巴细胞分离液,体积大小与血液样本相同,采用磷酸缓冲盐溶液(PBS)稀释,3 000 r/min(离心半径12 cm)离心15 min,吸取离心后的中间层,再次PBS悬浮后离心,弃上清,细胞沉淀用5 mL PBS重悬洗涤。调整单个核细胞密度为2×106/mL;离心后加入每管加入1 mL染色buffer,震荡离心后加入 3 μL CD19 抗体、10 μL CD27 抗体进行表面抗体染色,避光孵育30 min,然后加入250 μL破膜剂,避光孵育20 min,洗涤3次。加入10 μL IL-10抗体进行细胞内染色,避光孵育40min,洗涤3次后加入400 μL stain buffer,振荡混匀后进行流式细胞仪(美国BD公司3100型)分析,以前向角和侧向角散射光散点图设门区分,记录 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞含量。
1.3 预后调查 采用病历调查、随访门诊与电话随访的方式调查病例组患者的预后死亡与存活情况。
1.4 统计学方法 采用SPSS 22.00统计学软件对本研究所涉及的计量数据与计数数据分析,采用(±s)、率等进行表示,对比方法为 t检验与 χ2检验,相关性分析采用直线相关分析,以关联系数(r)表示,检验水准为ɑ=0.05。
2 结果
2.1 常规血液学指标对比 病例组的红细胞计数、血小板计数、白细胞计数、血红蛋白都显著低于对照组(P<0.05),见表 1。
表1 2组常规血液学指标指标对比 (±s)

表1 2组常规血液学指标指标对比 (±s)
Hb(g/L)病例组 82 3.78±0.11 3.38±0.15 45.39±5.95 74.33±2.21对照组 82 6.39±0.21 4.51±0.11 153.29±6.11 139.20±3.29 t 99.696 55.011 114.567 148.213 P 0.000 0.000 0.000 0.000组别 n WBC计数(×109/L)RBC计数(×109/L)PLT计数(×109/L)
2.2 血清 IL-10 含量和 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞比例对比 病例组的血清IL-10 含量和外周血 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞低于对照组(P<0.05),见表2。
表2 2组血清IL-10含量对比 (pg/mL,±s)
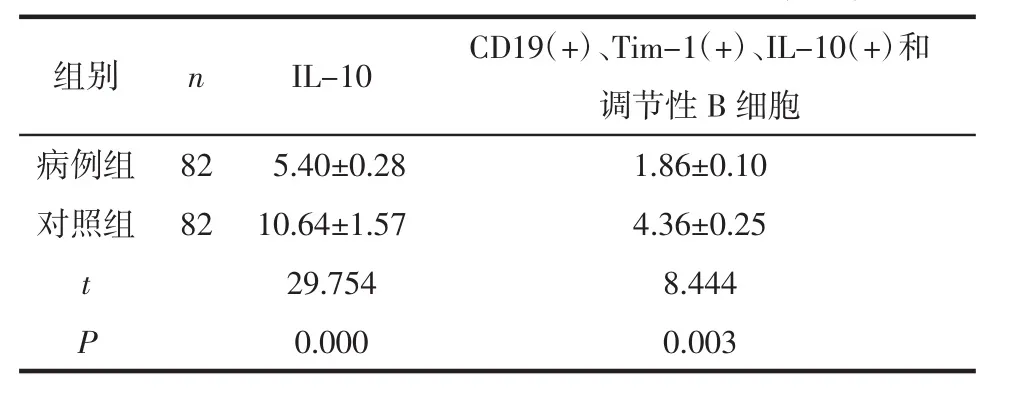
表2 2组血清IL-10含量对比 (pg/mL,±s)
组别 n IL-10 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞病例组 82 5.40±0.28 1.86±0.10对照组 82 10.64±1.57 4.36±0.25 t 29.754 8.444 P 0.000 0.003
2.3 预后情况 病例组患者随访调查至2019年12月,82例患者中死亡15例,死亡率为18.3%。其中死亡患者的 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞水平(1.52±0.14)pg/mL,显著低于存活患者的 CD19(+)、Tim-1(+)、IL-10(+)和调节性 B细胞水平(1.82±0.11)pg/mL,对比差异有统计学意义(P<0.05)。
2.4 相关性分析 在病例组中,直线相关分析患者的预后死亡与 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞比例、IL-10含量、红细胞计数、血小板计数都存在相关性(P<0.05),见表 3。
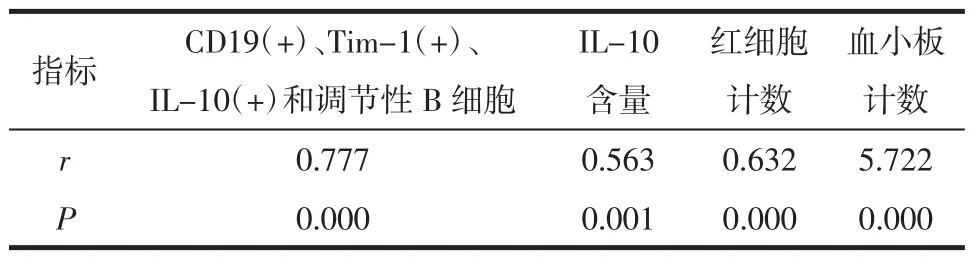
表3 SLE患者外周血调节性B细胞表达与预后的相关性 (n=82)
3 讨论
SLE是一种病因尚不明确的累及多系统的自身免疫性疾病,滥用抗生素、病毒感染、使用染发剂等化学污染都可诱发该病[12]。该病患者几乎均有不同程度的血液学改变,贫血是血液系统损害中最常见表现,其程度轻重不一,主要包括失血性贫血、慢性病性贫血、肾性贫血等,也是造成重度贫血病例较多的原因之一[13-14]。本研究显示病例组的红细胞计数、血小板计数、白细胞计数、血红蛋白都显著低于对照组。从机制上分析,SLE可导致机体造血前体细胞和中性粒细胞受到不同自身抗体的破坏,可使得骨髓增生受到抑制,从而导致红细胞计数、血小板计数等降低[15-16]。
SLE的发生是一个多因素参与、多基因改变、多阶段发展的病变过程,免疫因素在该病的发生发展发挥重要的作用[17]。调节性B细胞与SLE的发生发展和转移密切相关,B细胞可以产生抗体参与体液免疫调节,也将识别的抗原递呈给T细胞,激活细胞免疫,使T细胞活化增殖,从而参与机体免疫应答[18-19]。调节性B细胞并无特异性的表面标志,不过IL-10被认为是其特性之一[20]。在自身免疫性脑脊髓膜炎、炎症性肠病、类风湿性关节炎等模型,调节性B细胞通过细胞—细胞接触抑制自身反应性B淋巴细胞,促进IL-10的分泌,从而可抑制有害的免疫反应[21]。本研究显示病例组的血清IL-10含量、外周血 CD19(+)、Tim-1(+)、IL-10(+)和调节性 B 细胞比例显著低于对照组。表明SLE患者的CD19(+)、Tim-1(+)、IL-10(+)和调节性 B 细胞比例比较低,也伴随有IL-10的低表达。从机制上分析,IL-10是由Th2细胞活化的B细胞、单核-巨噬细胞等产生的细胞因子,通过阻断促炎因子的作用,发挥其抗炎作用[22]。SLE患者多伴随有炎性因子的过表达,从而可导致持续的免疫激活,调节性B细胞过度活化并产生大量的自身抗体及免疫复合物,也会抑制IL-10的分泌,从而形成恶性循环。并且IL-10能抑制单核巨噬细胞的抗原递呈作用,能减少黏附分子的表达,抑制IL-12合成的作用,从而阻碍Th1免疫反应[23]。
一系列复杂因素决定了个体的SLE发病易感性,包括基因缺失、细菌感染、基因变异等,但是确切的病因还不明确。该病患者的预后比较差,死亡率一直居高不下,很多患者也伴随有血管损害,包括血管内血栓形成、动脉和小动脉硬化以及坏死性动脉炎等。本研究病例组患者随访调查至2019年12月,82例患者中死亡15例,死亡率为18.3%,其中死亡患者的 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞水平显著低于存活患者;直线相关分析患者的预后死亡与 CD19(+)、Tim-1(+)、IL-10(+)和调节性B细胞比例、IL-10含量、红细胞计数、血小板计数都存在相关性。从机制上分析,调节性B细胞能通过分泌IL-10等细胞因子,下调效应T淋巴细胞对机体免疫应答的作用,从而发挥对机体的保护作用[24]。IL-10可抑制单核巨噬细胞释放炎性介质,抑制脂多糖和干扰素(IFN)-γ导致的肿瘤坏死因子(TNF)-α、IL-1β、IL-6、IL-8、和粒-巨核细胞集落刺激因子分泌[25]。而调节性B细胞也可分泌IgG和IgA中和有害可溶性因子,增强清除含有潜在自身抗原的凋亡细胞[26]。不过本研究也有一定的不足,研究的样本数量较少,且调节性B细胞的具体作用机制也不明确,将在下一步进行深入分析。
综上所述,SLE患者伴随有外周血CD19(+)、Tim-1(+)、IL-10(+)和调节性 B 细胞比例与血清IL-10表达降低,与患者的预后显著相关。

