大蒜素通过TLR4/NF-κB途径对慢性腹泻大鼠肠黏膜修复及炎性因子的调节
杨艳玲,张晶,覃元
慢性腹泻是指病程在两个月以上的腹泻或间歇期在2~4周内的复发性腹泻,病因较为复杂,病程迁延。根据病因不同,临床症状多样化,治疗原则各异。据报道,慢性腹泻是五岁以下儿童中第三大死亡原因,每年导致超过300万人死亡[1-2]。研究发现,饮食、心理、基因、环境、压力和炎症等多种因素均与慢性腹泻有关[3]。这些因素可能会改变肠脑轴,诱发胃肠道蠕动异常或损害肠黏膜屏障功能,随后导致相关的腹泻症状[4]。
最近的研究表明,炎症可能在慢性腹泻的发病机制中发挥作用[5-6]。炎性细胞因子,例如IL-1β、IL-6和TNF-α会影响肠胃蠕动、分泌和重吸收。此外,IL-1β和TNF-α可以增加慢性腹泻患者的肠道敏感性[7]。因此,找到这些炎症因子异常表达的机制肯定会使慢性腹泻患者受益。
众所周知,TLR4/NF-κB通路在炎症反应中起重要作用[8]。研究发现,过敏性肠综合征的小肠黏膜中的主要黏膜受体,TLRs家族成员(TLR4、TLR5和TLR9)被上调[9]。此外,TLR4可以激活关键的炎症介质NF-κB来调节炎症反应[8,10]。TLR4/NF-κB信号通路在慢性腹泻中研究甚少,因此需要进一步的研究。
大蒜素(Allicin)是从葱科葱属植物大蒜(Allium Sativum)的鳞茎中提取的一种有机硫化合物,也存在于洋葱和其他葱科植物中,学名二烯丙基硫代亚磺酸酯。研究表明,大蒜素具有消炎、降血压、抗肿瘤等多种生物学功能[11]。因此,我们对大蒜素是否可以在慢性腹泻中对肠黏膜有保护作用及发挥抗炎作用产生了兴趣。
本文试图研究大蒜素是否通过TLR4/NF-κB信号通路对慢性腹泻有改善作用,对炎症因子有调节作用,进一步探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 60只Wistar大鼠(雄性,体质量180±20 g)购自武汉大学动物实验中心。实验大鼠饲养于标准动物房。大鼠经一周适应环境,正常饮水饮食。
1.1.2 试剂 大蒜素(纯度≥98%)购自上海源叶生物科技有限公司。内毒素、TNF-α、IL-1β、IL-6和IL-10试剂盒购自南京凯基生物科技有限公司。苏木精-伊红(HE)、DAB和免疫组化试剂盒购自北京索莱宝生物科技有限公司。DNA提取试剂盒购自北京天根生化科技有限公司。SYBR®Premix EX TaqTMII试剂盒购自日本TaKaRa公司。RIPA裂解液、BCA蛋白定量试剂盒购于美国Abcam公司。兔抗p-TLR4抗体(货号:1387S;批号:20190234)、兔抗TLR4抗体(货号:14358S;批号:20190145)、兔抗p-NF-κB p65抗体(货号:8214S;批号:20200112)、兔抗NF-κB p65抗体(货号:8242S;批号:20194578)、兔抗β-actin抗体(货号:4970S;批号:20200178)和山羊抗兔IgG二抗(货号:2985S;批号:20190823)购自Cell Signaling Technology公司。
1.2 方法
1.2.1 动物造模 建立慢性腹泻大鼠模型[12]:Wistar大鼠均以含生药1 g/mL生大黄水煎剂按0.02 mL/g 剂量灌胃,每日1次,连续8 d,造成慢性腹泻模型。每只大鼠进行单笼饲养,以排便量和湿粪率作为腹泻的指标。湿粪率:每天通过滤纸印记计算湿粪率,确定24 h内排便的总数以及湿粪的数量,湿粪率=湿粪数量/排便总数×100%。灌胃给药8 d后,造模各组大鼠排便量和湿粪率明显高于对照组(P<0.01),表明造模成功。
1.2.2 分组及给药
(1)分组:Wistar大鼠分为空白对照组(C组)、模型组(M组)、大蒜素低剂量组(A-L组)、大蒜素高剂量组(A-H组),每组15只。C组大鼠灌胃等体积的生理盐水,M组、A-L组、A-H组按第1.2.1小节进行相应剂量的灌胃。
(2)给药:给药方式为灌胃。C组:无菌生理盐水,20 mL/kg;M组:无菌生理盐水,20 mL/kg;A-L组:30 mg/kg的大蒜素;A-H组:50 mg/kg的大蒜素[13]。每天给药一次,连续2周。
1.2.3 血浆内毒素水平测定 实验结束后,各组大鼠经腹腔注射10%水合氯醛麻醉后,于腹主动脉采血,并置于肝素抗凝试管内,3 000 rpm/min 离心15 min,吸取上层血浆,按照用ELISA试剂盒说明书测定血浆中内毒素水平。
1.2.4 血清炎症因子水平测定 实验结束后,各组大鼠经腹腔注射10%水合氯醛麻醉后,于腹主动脉采血,并置于EP管内,3 000 rpm/min 离心15 min,吸取上层血清,按照ELISA试剂盒说明书进行操作,用酶联仪在450 nm波长依序测定各孔的光密度(OD值),根据OD值所绘制的标准曲线计算出血清中TNF-α、IL-1β、IL-6、IL-10的含量。
1.2.5 HE检测大鼠结肠组织病理变化 切取各组大鼠结肠组织,经固定、脱水、浸蜡、包埋,制成5 μm的切片。切片放入苏木素溶液中5 min,自来水清洗。切片放入伊红染液中染色 3 min,流水稍洗。之后切片置于梯度酒精(70%、80%、90%、100%)中脱水,各5 min,再放入二甲苯Ⅰ、Ⅱ中透明,各5 min。将切片取出,风干,在组织上滴加中性树胶封片,使用莱卡显微镜进行拍摄。
1.2.6 qRT-PCR检测大鼠粪便中双歧杆菌、乳酸杆菌和大肠杆菌的相对数量 各组大鼠粪便样品中的基因组DNA用基因组DNA提取试剂盒,紫外分光光度计检测各组样品中DNA含量,并将每个配对的样品调节至相同浓度。使用SYBR®Premix EX TaqTMII试剂盒进行qRT-PCR。扩增:95 ℃,30 s;变性:95 ℃,40 s;退火:在不同的温度下循环40 s (双歧杆菌55 ℃,乳酸杆菌50 ℃,大肠杆菌52 ℃)。使用FTC-3000p实时PCR系统完成实验后,采用2-ΔΔCt法分析数据。其中使用的引物见表1。

表1 引物序列
1.2.7 Western blot检测大鼠结肠组织中TLR4、NF-κB p65的磷酸化程度 RIPA裂解液提取各组大鼠的结肠组织(100 mg)中的总蛋白,BCA法进行定量,样品经变性后进行上样。按照实验步骤进行电泳-转膜-封闭(5%脱脂奶粉)-一抗孵育[p-TLR4抗体(1∶2 000)、TLR4抗体(1∶2 000)、p-NF-κB p65抗体(1∶2 000)、NF-κB p65抗体(1∶2 000)和β-actin抗体(1∶2 000),4 ℃冰箱过夜]-二抗孵育[IgG抗体(1∶5 000),室温1.5 h]-显影曝光。Image-Pro Plus图像分析系统对蛋白条带进行分析。
1.3 统计学方法

2 结果
2.1 大蒜素对各组大鼠状态及体质量的影响
造模期间,C组大鼠反应灵活、主动觅食、频繁活动、大便成形、体质量增加; M组、A-L组、A-H组大鼠在造模第2天就出现稀便,之后病情逐渐加重,体质量也慢慢减轻,饮食减少、少动、消瘦,但是有自愈的倾向。给药期间,C组大鼠依旧反应灵活、主动觅食、频繁活动、大便成形、体质量不断增长;M组大鼠有自愈的倾向,稀便次数有所减少,体质量有所增加;A-L组和A-H组大鼠随着药物的治疗,体质量不断增加,稀便次数减少。见表2。
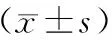
表2 各组大鼠体质量变化
2.2 大蒜素对各组大鼠排便量和湿粪率的影响
如图1所示,C组、M组、A-L组、A-H组大鼠排便量和湿粪率差异具有统计学意义(F=20.54,P<0.001;F=62.54,P<0.001)。与C组比较,M组大鼠排便量和湿粪率显著升高(均P<0.001);与M组比较,A-L组大鼠排便量和湿粪率下降(均P<0.05),A-H组大鼠排便量和湿粪率下降(均P<0.01),且随着大蒜素剂量增加,效果越明显。

图1 各组大鼠的排便量和湿粪率 A:各组大鼠排便量的比较;B:各组大鼠湿粪率的比较。与C组比较,***P<0.001;与M组比较,#P<0.05,##P<0.01
2.3 大蒜素对各组大鼠血浆中内毒素表达水平的影响
如图2所示,C组、M组、A-L组、A-H组大鼠血浆中内毒素表达差异具有统计学意义(F=32.04,P<0.001)。与C组比较,M组大鼠血浆内毒素表达水平显著上调(P<0.001);与M组比较,A-L组和A-H组大鼠血浆内毒素表达水平下降(P<0.05,P<0.01),且随着大蒜素剂量增加,血浆内毒素水平下降越明显。

图2 各组大鼠血浆内毒素表达水平 与C组比较,***P<0.001;与M组比较,#P<0.05,##P<0.01
2.4 大蒜素对各组大鼠血清中炎症因子表达水平的影响
如图3所示,C组、M组、A-L组、A-H组大鼠血清中TNF-α、IL-1β、IL-6、IL-10表达差异具有统计学意义(F=24.56,P<0.001;F=28.11,P<0.001;F=36.32,P<0.001;F=55.72,P<0.001)。与C组比较,M组大鼠血清中TNF-α、IL-1β、IL-6表达水平显著上调(均P<0.001),IL-10的表达水平显著下调(P<0.001);与M组比较,A-L组大鼠血清中TNF-α、IL-1β、IL-6表达水平下调(均P<0.05),IL-10的表达水平上调(P<0.05);与M组比较,A-H组大鼠血清中TNF-α、IL-1β、IL-6表达水平下调(均P<0.01),IL-10的表达水平上调(P<0.01);且随着大蒜素剂量增加,效果越明显。
2.5 大蒜素对各组大鼠结肠组织病理变化的影响
如图4所示,HE染色结果显示,C组大鼠结肠组织有完整的上皮和黏膜,隐窝结构无破坏;与C组比较,M组大鼠结肠组织的上皮和黏膜被严重破坏,隐窝结构也有破坏;与M组比较,A-L和A-H组大鼠结肠组织的上皮和黏膜有所修复,隐窝结构也能较清楚的看见,且与剂量呈正比。
2.5 大蒜素对各组大鼠肠道菌群相对数量的影响
如图5所示,C组、M组、A-L组、A-H组大鼠肠道中双歧杆菌、乳酸杆菌、大肠杆菌的相对数量差异具有统计学意义(F=95.02,P<0.001;F=68.90,P<0.001;F=24.27,P<0.01)。与C组比较,M组大鼠肠道中双歧杆菌、乳酸杆菌的相对数量显著减少(均P<0.001),大肠杆菌的相对数量明显增加(P<0.01);与M组比较,A-L组大鼠肠道中双歧杆菌、乳酸杆菌的相对数量增加(均P<0.05),大肠杆菌的相对数量减少(P<0.05);与M组比较, A-H组大鼠肠道中双歧杆菌、乳酸杆菌的相对数量增加(均P<0.01),大肠杆菌的相对数量减少(P<0.05),且呈剂量依赖性。

图3 各组大鼠血清中TNF-α、IL-1β、IL-6、IL-10的表达水平 A:各组大鼠血清中TNF-α表达水平的比较;B:各组大鼠血清中IL-1β表达水平的比较;C:各组大鼠血清中IL-6表达水平的比较;D:各组大鼠血清中IL-10表达水平的比较。与C组比较,***P<0.001;与M组比较,#P<0.05,##P<0.01

图4 各组大鼠结肠组织病理变化(HE,×200)
2.6 大蒜素对各组大鼠结肠组织中p-TLR4、p-NF-κB p65蛋白表达的影响
如图6所示,C组、M组、A-L组、A-H组大鼠结肠组织中p-TLR4、p-NF-κB p65蛋白表达差异具有统计学意义(F=28.06,P<0.001;F=45.28,P<0.001)。与C组比较,M组大鼠结肠组织中p-TLR4、p-NF-κB p65蛋白表达水平显著上调(均P<0.001);与M组比较,A-L组大鼠结肠组织中p-TLR4蛋白表达水平下调(P<0.05),p-NF-κB p65蛋白表达水平下调(P<0.01);与M组比较, A-H组大鼠结肠组织中p-TLR4、p-NF-κB p65蛋白表达水平下调(均P<0.01),且呈剂量依赖性。

图5 各组大鼠肠道中双歧杆菌、乳酸杆菌和大肠杆菌的相对数量 A:各组大鼠肠道中双歧杆菌的相对数量比较;B:各组大鼠肠道中乳酸杆菌相对数量的比较;C:各组大鼠肠道中大肠杆菌相对数量的比较。与C组比较,**P<0.01,***P<0.001;与M组比较,#P<0.05,##P<0.01

图6 各组大鼠结肠组织中p-TLR4、p-NF-κB p65蛋白表达水平 A:各组大鼠结肠组织中p-TLR4、p-NF-κB p65蛋白表达图;B:各组大鼠结肠组织中p-TLR4蛋白表达水平比较;C:各组大鼠结肠组织中p-NF-κB p65蛋白表达水平比较。与C组比较,***P<0.001;与M组比较,#P<0.05,##P<0.01,###P<0.001
3 讨论
慢性腹泻是全球重大的健康问题,其高发病率和高复发率严重影响患者的生活质量,造成患者的经济负担[14-15]。慢性腹泻的发病机制复杂,研究表明其可能与肠道动力、炎性反应、免疫反应异常等密切相关,其中炎性反应是慢性腹泻的重要发病机制[16-17]。本实验中发现,慢性腹泻的大鼠肠黏膜结够发生变化,血清中炎性因子(TNF-α、IL-1β、IL-6、IL-10)的表达水平发生变化,与上述报道一致。
众所周知,TLR属于模式识别受体,是先天免疫系统的组成部分[18]。TLR4能够通过MyD88依赖性途径激活NF-κB。NF-κB是炎症反应的关键转录因子,其可以在应激环境中被激活[19-20]。研究表明,NF-κB是炎症相关的疾病如神经退行性疾病和糖尿病的可行治疗靶标[21-22]。因此,抑制NF-κB可以有效阻断炎症途径。本实验中发现,当大鼠造成慢性腹泻模型后,血清中炎症因子的表达发生变化,结肠组织中TLR4/NF-κB蛋白表达水平升高,因此,通过抑制NF-κB的激活,可改善腹泻和黏膜微结构等症状。
肠道是体内最大的细菌库,肠黏膜屏障的损伤可使肠道的微生物、内毒素侵入肠外组织。研究表明,肠道微生物群改变在慢性腹泻的病理生理中具有重要作用[23]。频繁腹泻会导致肠道菌群失调。肠道中有三种常见的微生物群:双歧杆菌、乳酸杆菌和大肠杆菌。血清内毒素的水平在一定程度上可以反映肠黏膜屏障的完整性,也可以对药物的治疗进行评价[12]。本实验中,我们发现模型组大鼠血浆内毒素水平显著上调,双歧杆菌、乳酸杆菌的相对数量显著减少,大肠杆菌的相对数量明显增加。
大蒜素是从百合科葱属植物大蒜的鳞茎中提取的一种有机硫化合物,也存在于洋葱和其他葱属植物中[24]。大蒜素具有较强的抗菌消炎作用,对多种球菌、杆菌、真菌、病毒等均有抑制或杀灭作用[25-26]。本实验中,大蒜素明显改善了慢性腹泻的症状,慢性腹泻大鼠排便量和湿粪率下降、结肠黏膜组织有所修复、血清中炎性因子表达发生变化、TLR4/NF-κB蛋白表达水平下降。
综上所述,本研究发现TLR4/NF-κB途径与慢性腹泻之间存在相关性,NF-κB是炎症反应的关键介质。大蒜素可抑制了TLR4/NF-κB通路的激活并调节大鼠的血清中炎症因子的表达,从而改善慢性腹泻的病程。

