三血管气管切面对新生儿先天性血管环的超声诊断价值 分析
梁蓉,何冠南,赵婧,李宁,白艳,杨家翔,李钱梅
(四川省妇幼保健院超声科,四川 成都 610031)
0 引言
先天性血管环(congenital vascular ring,CVR)是一种罕见的心血管异常,常由主动脉弓和其主要分支在胚胎时期因起源和位置上的发育异常引起,异常血管和(或)动脉韧带完全性或不全性地包绕气管或(和)食管形成环状结构,并压迫气管或食管导致呼吸或消化道管腔狭窄进而诱发婴幼儿出现气管阻塞、呼吸困难甚至呼吸衰竭等不良临床症状[1]。因此,CVR的及时准确诊断成为临床亟待解决的问题之一,但长期以来,超声对CVR的诊断符合率普遍较低[2],有学者提出婴幼儿CVR超声准确率低的原因可能与超声缺少对3VT切面的检查有关[3],故本研究拟在常规超声心动图切面的基础上进行3VT切面,以MRI或手术结果为金标准,回顾性分析46 例CVR新生儿的常规切面和3VT切面超声心动图声像特征,探讨3VT切面对新生儿CVR的诊断价值,为进一步提高超声心动图对CVR的诊断准确率,并促使3VT切面在该疾病诊断中的广泛应用提供事实依据。
1 资料与方法
1.1 一般资料
选取2017年3月至2020年3月间,在四川省妇幼保健院行超声心动图检查并经MRI或手术确认为先天性血管环的新生儿46例,男25例,女21例,年龄2~28天,出生体重1800~4050g。
1.2 仪器和方法
使用GE Vivid E9和迈瑞M9彩色多普勒超声诊断仪,经胸超声探头频率3~14MHz,患儿须在安静状态下,取平卧位或左侧卧位及仰卧头后伸位进行检查。(1)常规切面超声心动图扫查(以下简称常规):依次检查左室长轴、大动脉短轴、心尖四腔心、心尖五腔心、剑下两腔心、主动脉长轴切面等。重点观察主动脉弓位置、数目及内径,主动脉三个分支起源部位、走行及左肺动脉的起源、内径及走行。(2)3VT切面扫查:探头置于胸骨旁第4、5肋间隙,显示大动脉短轴切面后将探头往头侧偏斜,示标指向患儿左肩,显示上腔静脉短轴,主动脉和肺动脉排列成V形,气管位于主动脉和上腔静脉之间,检查过程中将探头向剑突方向移动,并向头侧偏转,动态观察主动脉、肺动脉及其分支,以及上腔静脉和气管之间的关系。使用彩色多普勒显示主动脉及分支、肺动脉及分支血流灌注情况,并用脉冲多普勒测量各部位流速,判断血流性质。
2 结果
2.1 CVR诊断结果及构成类型
46例CVR患儿中,左位主动脉弓伴右锁骨下动脉迷走(left aortic arch with aberrant right subclavian artery,LAAARSA)28例,右位主动脉弓伴左锁骨下动脉迷走(right aortic arch with aberrant left subclavian artery,RAA-ALSA)11例,双主动脉弓(double aortic arch,DAA)4例,肺动脉吊带(pulmonary artery sling,PAS)3例。与MRI或手术结果相比较,超声正确诊断33例,漏诊13例,准确率71.7%。其中,LAA-ARSA正确诊断19例,漏诊9例,准确率67.8%,RAAALSA正确诊断7例,漏诊4例,准确率63.6%,DAA正确诊断4例,准确率100%,PAS正确诊断3例,准确率100%。见表1。
2.2 CVR在3VT切面超声特征
LAA-ARSA:19例表现为右锁骨下动脉起自降主动脉绕气管后方走形,形成“C”形血管环(图1)。
RAA-ALSA:7例表现为主动脉弓位于气管右侧,与动脉导管、迷走的左锁骨下动脉共同形成“U”形血管环(图2)。

表1 46例CVR患儿(常规+3VT)超声诊断与确诊结果比较(%)
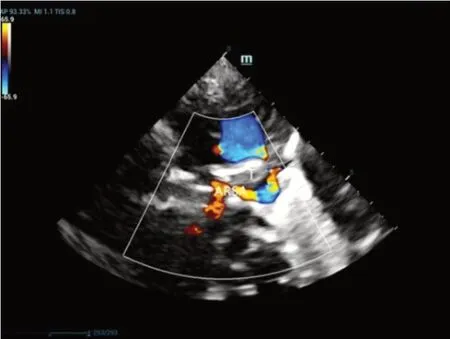
图1 LAA-ARSA声像图
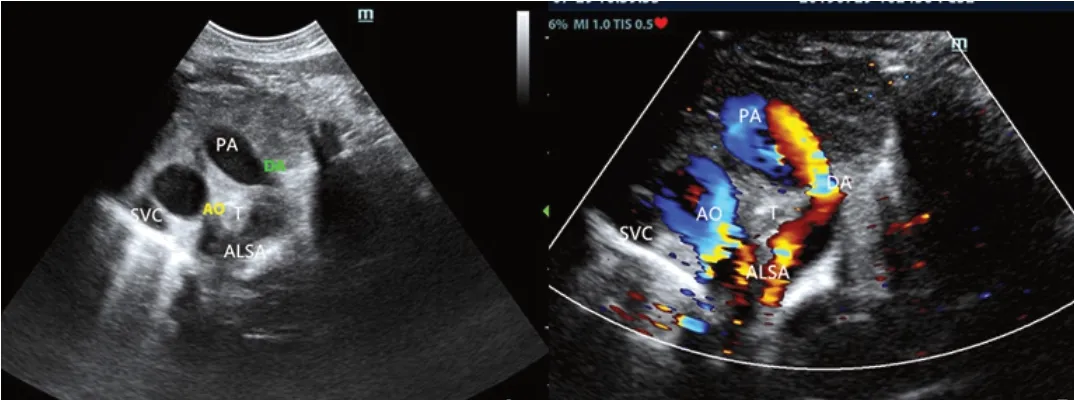
图2 RAA-ALSA声像图
DAA:4例表现为升主动脉分成两支包绕气管向后汇合到降主动脉形成“O”形血管环(图3)。

图3 DAA声像图
PAS:3例表现为左肺动脉异常起源于右肺动脉绕气管后方走行形成“C”形血管环(图4)。
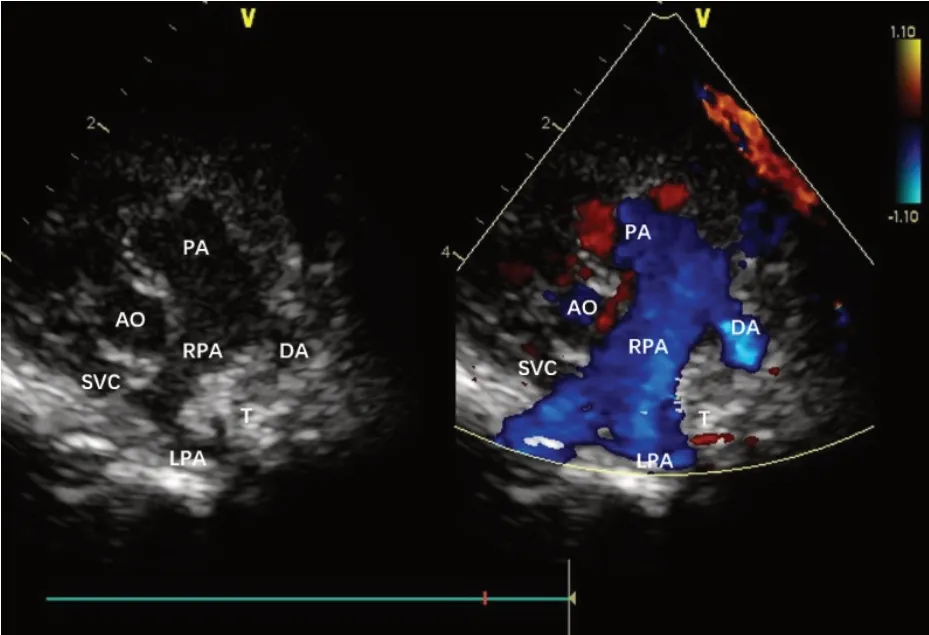
图4 PAS声像图
2.3 CVR在常规超声心动图切面声像特征
LAA-ARSA:9例表现为胸骨上窝切面探头示标指向患儿左肩时显示主动脉长轴,主动脉弓依次发出右颈总动脉,左颈总动脉,左锁骨下动脉,ARSA。
RAA-ALSA:4例表现为胸骨上窝切面探头示标指向患儿右肩时显示主动脉弓长轴,主动脉弓依次发出左颈总动脉、右颈总动脉、右锁骨下动脉、ALSA。
DAA:3例在胸骨上窝主动脉弓长轴切面探及左右两弓,左侧主动脉弓发出左颈总动脉和左锁骨下动脉,右侧主动脉弓发出右颈总动脉和右锁骨下动脉。
PAS:3例在大动脉短轴切面表现为肺动脉分叉消失,仅显示右肺动脉。
2.4 合并畸形情况
46例CVR中,房间隔缺损或卵圆孔未闭38例,动脉导管未闭28例,室间隔缺损4例,永存左上腔静脉3例,法洛氏四联征2例,三尖瓣反流23例,肺动脉高压3例。
3 讨论
CVR是由国外学者Turner于1862年首次报道一例RAA-ALSA而被人熟知,约占先天性心脏病的1%~3%,主要是由于人体胚胎发育期出现的6对腮动脉弓以及成对的背侧主动脉未顺序融合或吸收,在主动脉弓的发育过程中包绕并压迫气管或者食管所致,临床分为完全性血管环和不完全性血管环。大多数CVR患儿出生时并无明显临床表现,其临床进程取决于气管的受压程度,随着年龄增长,环绕血管逐渐增粗,对气管的压迫症状逐渐明显,常出现咳嗽、喘鸣、气促、反复呼吸道感染、吐奶等非特异性的临床表现,严重时可导致呼吸衰竭[4-6]。既往对CVR的诊断主要依靠CT和MRI等[7],由于患儿出生后胸廓、肺组织等干扰,常规超声心动图切面常难以清晰显示和判断主动脉、肺动脉及其分支的走行,故CVR的超声诊断率普遍较低。在胎儿期,3VT切面已作为基本检查切面运用于胎儿超声心动图的检查中[8,9]。鉴于新生儿期血管环和胎儿期血管环声像图相似,因此,本研究中笔者尝试将胎儿3VT切面运用到新生儿超声心动图检查中,通过对我院46例行超声心动图检查并经MRI或手术证实的CVR新生儿进行回顾性分析,发现CVR超声诊断准确率为71.7%,比国内学者张新等[10]报道CVR超声检查准确率(57.4%)明显增高,该现象发生的原因可能与我们对每一个患者均进行常规超声心动图切面和三血管气管切面超声检查,进而较大幅度的降低了该病漏诊率有关;其次,本研究选取新生儿作为研究对象亦可能是CVR检查准确率提高的原因。而我们选择将新生儿作为研究对象,原因有两点,(1)新生儿体型小,胸壁薄,超声穿透力相对较高,肺部气体和胸廓的干扰相对较小,气管相对较容易显示。(2)新生儿期胸腺还未回缩到胸骨柄后方,检查过程中我们以胸腺作为透声窗,对新生儿三血管气管切面进行观察,同时追踪血管走行。在新生儿期我们能够将大血管的分支显示的更清楚,对左右锁骨下动脉的显示率相对较高,这使我们对CVR的诊断和鉴别诊断更具有意义。
本研究中,列入研究对象的46例CVR由LAA-ARSA、RAA-ALSA、DAA和PAS四种类型构成。(1)LAA-ARSA:是因右侧第4主动脉弓在锁骨下动脉和颈动脉之间退化,造成右锁骨下动脉起源于降主动脉,经食管的后缘向右上行走,可造成食管左后壁的压痕。本研究28例LAA-ARSA患儿中,19例病例在3VT切面有表现,但有9例CVR漏诊,分析原因主要是因患儿肺气和胸廓骨组织的干扰造成对主动脉分支血管显示不满意;另外,部分新生儿动脉导管关闭形成动脉韧带,超声对动脉韧带的显示效果不理想也是漏诊的原因之一。(2)RAA-ALSA:由于胚胎发育期右侧第4主动脉弓持续存在,而左侧第4主动脉弓在左颈总动脉和左锁骨下动脉之间中断,使左锁骨下动脉起源于降主动脉,并行走在气管后方,与动脉导管或动脉韧带形成“U”形血管环。本研究11例LAA-ARSA患儿中准确诊断7例,有4例仅诊断右位主动脉弓,迷走的左锁骨下动脉因肺气干扰无法显示而漏诊。(3)DAA:是因胚胎发育时左、右第4主动脉弓均不退化吸收,两个主动脉弓均发自升主动脉,分别从气管、食管两侧绕过至其后方汇入降主动脉,形成一个“O”形环。本研究4例DAA患儿在3VT切面均有表现,在常规超声切面检查中因肺气干扰漏诊1例。(4)PAS:胚胎发育过程中,左肺动脉的发育过程落后于气管、支气管树的发育,右肺动脉、左肺动脉绕气管形成“C”形血管环。本研究3例PAS患儿在3VT切面上均有相应的超声表现。
以往关于CVR的报道,国内学者多以PAS和DAA为主,在我们的研究中,CVR的构成以LAA-ARSA、RAA-ALSA最多见,这与国外Mustafa Kir等学者[11]的报道一致,但与国内报道有差异[4],原因可能与我们将3VT切面作为常规检查切面,从而使更多无症状新生儿CVR得以检出有关。以往CVR患儿主要是以出现临床症状就诊后被检查发现,而LAAARSA、RAA-ALSA引起的临床症状较少,特别是新生儿期心血管和呼吸系统的临床症状特征不明显,常规切面检查并不容易发现这类疾病,易于误诊漏诊。我们将3VT切面常规运用于新生儿超声心动图检查中,使LAA-ARSA、RAA-ALSA的检出率得到了很大的提高。通过我们回顾性研究发现,3VT切面的运用能显著提高CVR超声诊断率,对新生儿联合运用常规切面和3VT切面进行超声心动图检查,能够较迅速的显示血管环的类型,减少患儿接受超声检查时间,有效节约时间成本,提高超声检查效率,增加患儿家属的接受度并降低患儿的检查费用。而心脏彩超检查作为一种无创检查方法,不仅操作简单、方便快捷,具有可重复性,且无放射性损害,在诊断有无血管环的同时,可检测是否合并心内其它畸形。国外学者报道CVR患者的影像学检查方法中,超声心动图所占的比例最高,为96%[12]。故笔者认为,可将3VT切面作为新生儿常规超声心动图检查切面,将超声心动图作为CVR的初筛检查项目。
综上所述,3VT切面在新生儿先天性血管环的超声诊断中具有重要作用,可作为新生儿超声心动图检查的常规切面,有利于提高新生儿先天性血管环的超声检查准确率,降低常规超声心动图切面对先天性血管环的漏诊。

