HPV多重感染与单一高危感染对宫颈病变的影响
邓新同,陈丽,刘丽萍
(1.承德医学院研究生院 ,河北 承德 067000;2.保定市第一中心医院,河北 保定 071000)
0 引言
宫颈癌严重威胁女性身心健康,其预后较差,但发展缓慢,如果能及时发现癌前病变并及时诊治,可有效降低宫颈癌的发病率,延长患者生存期。近年来,宫颈癌发病年轻化趋势越来越明显。据统计,2018年在全球范围内新增宫颈癌患者的人数为五十多万,而死亡人数达到30多万[1]。经多项研究证实,高危型人乳头瘤病毒( high risk-human papilloma virus,HR-HPV)持续感染是促成子宫颈癌的必要条件。其中16/18亚型又称极高危型HPV,其分别占全球宫颈癌病例的55%-60%、10%-15%[2]。
大约80%女性在一生中感染过HPV,但绝大部分都会被自身免疫系统清除,只有一小部分会持续存在,如果持续存在的这不部分不被及时发现并治疗,则可能发展成宫颈癌前病变甚至是宫颈癌。高级别宫颈鳞状上皮内病变(cervical squamous intraepithelial lesion,SIL)被视为癌前病变,从HSIL发展到宫颈癌需要十几年时间,如早期治疗,可以有效降低宫颈癌发病率。由于HPV病毒存在多种亚型,且不同亚型之间没有交叉抗体,所以容易引起HPV的多重亚型感染[3]。近年来,有关HPV多重高危亚型感染是否促进宫颈病变的进展的研究日益增多,但目前并无一致结论。陈雪[4]等人的研究认为,与单一高危感染相比,高低危混合感染并不增加宫颈病变的风险,但多重高危型HPV感染促进宫颈病变的进展。但也有部分学者认为HPV多重感染并不增加宫颈病变的严重程度,只是造成宫颈低级别的癌前病变[5],临床中还应把重点放在HPV的感染类型而不是感染型别的多寡上。这说明,对HPV多重亚型混合感染对宫颈病变影响的研究是有必要的。针对以上问题,本课题旨在研究HPV多重亚型混合感染与单一高危感染相比对宫颈病变的发生、发展产生的影响,并单独研究HPV16/18型单一及多重感染致宫颈病变规律。研究相应的管理模式,以指导临床中对对相关感染情况的处理,以早发现、早诊断、早治疗宫颈癌前病变,减少宫颈癌发病率。
1 资料与方法
1.1 研究对象
2018年10月至2019年10月就诊于保定市第一中心医院妇科门诊行宫颈癌筛查,其中HR-HPV阳性且行阴道镜下宫颈活检的278例患者为研究对象。按高危型HPV感染情况分为三组:A组:单一型高危HPV感染(158例);B组:多重高危型HPV感染(94例);C组:高危-低危混合型HPV感染(26例)。三组平均年龄分别为(42.20±1.22)岁、(40.88±13.38)岁、(39.50±11.27)岁,三组患者平均年龄比较差异无统计学意义(P>0.05)。三组基本情况比较(包括吸烟史、婚育史、家族史、既往史)无统计学意义(P>0.05)。
宫颈病变情况以宫颈阴道镜下活检结果为金标准。病变程度按由轻到重分为:未见上皮内病变(NILM)及宫颈炎症、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)和宫颈鳞状细胞癌(SCC)。
1.2 检测方法
1.2.1 宫颈脱落细胞学(TCT)、HPV检测
受检者非月经期,检查前1天无性生活及阴道冲洗、阴道上药操作,无菌棉球清理宫颈表面分泌物,专用采样刷深入宫颈口1-1.5cm处,顺时针旋转采样刷3-5圈采集标本后立即放入固定液并送往病理科检测。顺序为先采集宫颈脱落细胞,再采集HPV样本。
1.2.2 阴道镜下宫颈活检
受检者月经结束后3-7天,检查前3天无性生活及阴道冲洗、阴道上药操作,由经验丰富的临床医师按照标准进行操作,对可疑部位进行活检,如无肉眼可见病变则取宫颈(3、6、9、12)点进行多点活检,标本置于福尔马林液中并立即送往病理科有高级职称的病理科医师进行诊断。
1.2.3 根据TBS分类法(2001年修订)进行TCT诊断,分为未见上皮内病变(NILM)或恶性细胞、不典型鳞状细胞(ASC)两类(又包括ASCUS、ASC-H、LSIL、HSIL以及SCC)。
1.2.4 采用cohas 4800 HPV检测,可提供HPV 16型、18 型,以及HPV 31,33,35,39,45,51,52,56,58,59,66,68 ,73 和82共计16 个高危HPV亚型检测及HPV6,11, 81共计3个低危HPV亚型检测。
1.2.5 HO女性生殖器肿瘤分类(2014)
建议采用与细胞学分类相同的二级分类法(即LSIL和HSIL),LSIL相当于CIN1,HSIL包括CIN3和大部分CIN2。CIN2用p16免疫组化染色进行分流,p16染色阴性者按LSIL处理,阳性者按HSIL处理。
1.3 统计学方法
采用 SPSS 22.0统计软件进行数据分析,计量资料服从正态分布的以均数±标准差(±s)表示。计数资料以例数表示,组间比较采用卡方检验。检验水平α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 HPV多重感染情况
单一型高危HPV感染(158例);多重高危型HPV感染(94例);高危-低危混合型HPV感染(26例)。HPV多重感染率达44.44%。多重感染中二重感染所占比例最高为(94/120,78.33%),最多为六重感染。
2.2 各组癌前病变及宫颈鳞癌检出率
2.2.1 含16/18型别HPV感染组别中,A、B、C组癌前病变检出率分别为:70.47%、84.91%、77.78%;宫颈鳞癌检出率分别为12.07%、3.77%、11.11%。
2.2.2 非16/18型别HPV感染组别中,A、B、C组癌前病变检出率分别为:56.52%、63.41%、35.29%;宫颈鳞癌检出率分别为2.11%、2.44%、0.00%。
2.3 各高危型别HPV感染情况
单一感染中HPV16、52、56占感染类型前三位,分别占(50/158,31.56%)、(21/158,13.29%)、(18/158,11.39%)。多重感染中最常见的是含HPV16型感染,占(32/120,26.67%)。子宫颈鳞状细胞癌共13例,其中含HPV16感染10例,占比76.92%。
2.4 在含16/18型别HPV感染者中宫颈各级癌前病变及宫颈鳞癌检出率无统计学差异(P>0.05,详见表1)。
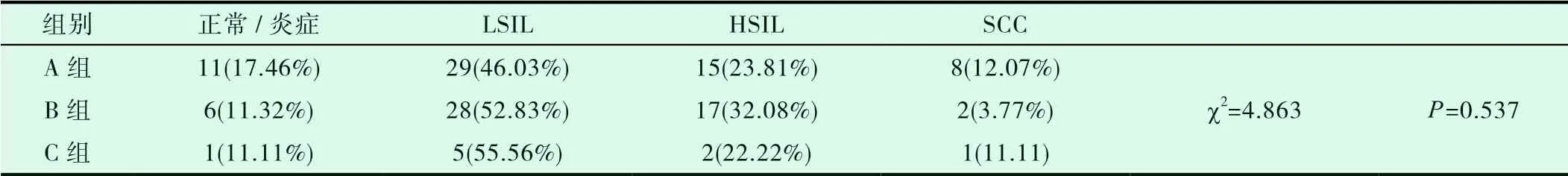
表1 含16/18型HPV感染者中宫颈各级癌前病变及宫颈鳞癌分布情况
2.5 在非16/18型HPV高危型感染者中宫颈各级癌前病变及宫颈鳞癌检出率无统计学差异(P>0.05,详见表2)。
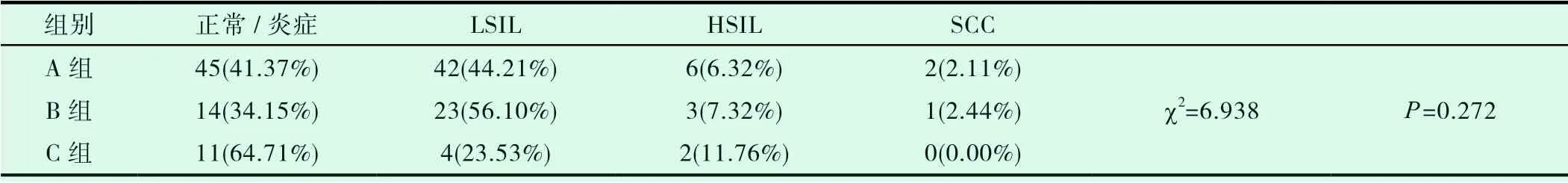
表2 非16/18型HPV高危型感染者中宫颈各级癌前病变及宫颈鳞癌分布情况
3 讨论
HPV是一种双链环状DNA病毒,其种类繁多,不同亚型HPV编码外壳蛋白有很大的基因变异,这种基因变异则导致不同HPV亚型之间几乎没有交叉保护抗体,这就容易引起HPV多重感染[6]。关于HPV多重感染率,报道并不统一,有相关研究得到,HPV多重感染率高达54.9%[7]。而李军[8]等人研究显示单一感染与多重感染比例为3.2:1,约30%左右。本研究中多重感染占44.44%。这与各地区差异及检测手段差异有关。在感染类型里,也存在地区之间差异,在河北石家庄地区,高危型HPV病毒感染率排前3位的是16、52、58[9]。而在黄丽丽等人的研究结果中显示:东华地区高危HPV感染的常见型别是52、53、51、58和16型[10]。而本研究单一感染中HPV16、52、56占感染类型前三位。近年来,随着宫颈癌疫苗的广泛普及,宫颈癌9价疫苗已经包含了HPV6、11、16、18、31、33、45、52和58在内的9种亚型。在HPV流行病学调查中,各地区感染类型差异也提示在宫颈癌疫苗研发中侧重点应因地制宜。多重感染所占比例虽然很大,但本研究显示其并不增加宫颈病变的风险,临床诊疗的重点还是应该放在感染类型上,而不是感染型别的多寡上,并且含HPV16/18型别的感染宫颈癌前病变率及宫颈癌患病率均高于非HPV16/18型别感染者,临床中更应予以重视。
近年来,越来越多的研究显示宫颈中存在HPV病毒多重亚型的感染。但是,关于多重高危亚型HPV感染与单一高危感染相比,是否促进宫颈病变的进展,目前尚无统一结论。外国学者Lee通过研究发现,单一型HPV感染使宫颈癌患病风险提高19.9倍,而多重感染则提高到31.8倍[11]。但是冯余宽[12]等人通过对1226例宫颈病变患者进行分析对比得出HPV多重感染并不导致宫颈病变进展。本研究结果显示,与单一高危感染相比多重感染并不增加宫颈病变的风险。
关于多重感染是否促进宫颈病变进展,尚无一致结论。还需要扩大样本量继续长时间研究,以及多重感染是否对宫颈治疗预后产生不良影响仍需继续研究。

