血管球瘤15例临床病理分析
卢昌佩 杨庆华 喻 标 王润超 步青云 景海霞
湖北医药学院附属太和医院皮肤科,湖北十堰,442000
血管球瘤又称球状血管瘤,是一种较为罕见的良性血管球性或神经肌肉动脉性肿瘤。占手部肿瘤的1%~5%,软组织肿瘤中占比低于2%[1,2],临床表现通常为甲下单发的蓝紫色结节,女性多见,其他部位如头、颈、胃、肺、舌、结肠,膀胱和尾骨也有报道,根据典型的临床三联征:发作性疼痛、剧烈触痛、冷诱发剧痛可初步考虑该疾病,但仍需组织病理学确诊,今为进一步探讨该病的临床表现及组织病理学特征,对本科收治的15例血管球瘤患者进行回顾性分析。
1 临床资料
1.1 一般资料 2011-2020年经临床及组织病理学确诊为血管球瘤的患者15例,男7例,女8例;年龄11~63岁,平均38岁,甲下5例,指腹2例,上肢3例,大腿内侧2例,肩膀处1例,腰部1例,膝外侧1例;均出现不同程度疼痛(自发性疼痛、局限性触痛、受寒痛等),其中发生甲下部位的5例患者对冷刺激更加敏感,体征均表现为皮下红蓝色小结节(表1)。
1.2 病理学资料
1.2.1 肉眼观 15例肿瘤均为圆形、椭圆形或不规则形的实性肿物,直径0.2~1 cm,11例有包膜,4例未见包膜,界限较清楚,切面呈蓝紫、淡红,质地脆软(图1)。
1.2.2 镜检 本次纳入标本分为4种血管球瘤亚型:(1)经典型:瘤细胞为较为规则的圆形或卵圆形,界限清楚,血管球细胞围绕在周围血管,结构类似于上皮样肿瘤,部分可见散在围绕在肿瘤细胞的胶原纤维(图2a);(2)球血管瘤型:血管管腔较大,似海绵状血管瘤,血管壁周围围绕大量瘤细胞,间质可见肥大细胞、淋巴细胞浸润(图2b);(3)球血管肌瘤型:可见血管球细胞、成熟的平滑肌细胞及肿瘤细胞与平滑肌细胞过渡混杂(图2c);(4)黏液样型血管球瘤:肿瘤间质明显水肿、可见疏松的黏液样组织,血管球瘤细胞呈巢状散布其中,似混合型汗腺瘤(图2d)。本组15例中,经典型2例,黏液型4例,球血管瘤型8例,球血管肌瘤型1例。多发性皮损、指尖突出性皮损临床较为少见,病理见图2e~2g。

表1 15例血管球瘤患者临床病理基本特征

图1 1a:经典甲下型结节;1b:指尖皮下结节;1c:肘部半球形损害;1d:膝外侧多发斑疹样损害

2a:经典型(HE,×100);2b:球血管瘤(HE,×100);2c:球血管肌瘤(HE×100);2d:黏液型(HE,×100);2e:多发斑疹样损害(HE,×40);2f:多发斑疹样损害(HE,×100);2g:指尖皮下结节(HE,×100)
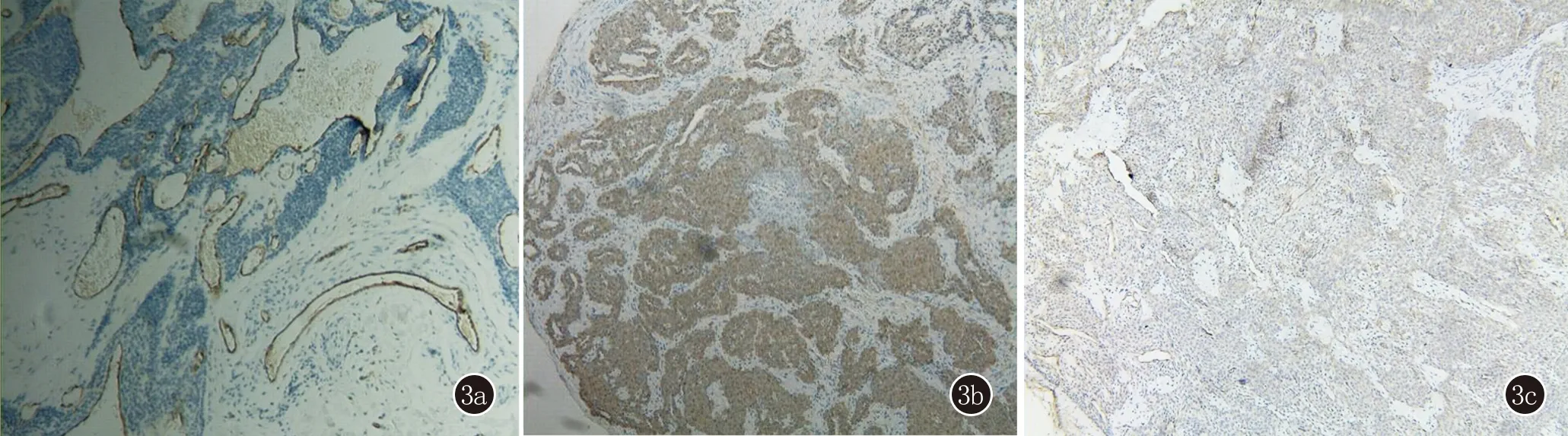
3a:CD31染色管腔阳性;3b:SMA染色阳性;3c:CD34 染色阳性
1.2.3 免疫组织化学 2例CD31染色管腔阳性,15例肿瘤细胞SMA、CD34 均阳性,S-100、EMA、CK均阴性(图3)。
1.3 治疗及预后 本组15例无明确恶性依据,予手术治疗,其中5例甲下肿瘤,拔甲后切除肿瘤,术后随访3个月,未诉肿块及疼痛复发,活动、感觉无异常。
3 讨论
1812年Wool首次用“痛性皮下结节”来描述该症状,1924年Masson第一次将其命名为血管球瘤。该病变可发生于任何年龄,平均年龄为25岁[3,4]。血管球瘤的发病无明显性别差异,主要位于四肢末端,尤其是甲下、手、腕和足,其中甲下占25%,同时甲下者女性多见[3,4],其他部位如鼻腔、肺、肾、胰腺、卵巢、神经、唇部等较为罕见[5];在我们的研究中,男女比例基本相同,四肢末端的占60%,与以往数据相比无差异,位于甲下的患者占33%,推测可能与甲下症状更加明显,从而就诊率高有关;纳入的5例甲下血管球瘤患者均为女性,进一步验证了甲下女性好发的流行病学数据,并未发现肺、胃、唇等部位的病例。
血管球瘤临床表现大多为单发红蓝色结节,直径通常<1 cm。本组病例仅1例为多发,占比仅为7%,略低于WHO(2002)[6]软组织肿瘤分类中描述的近10%病例为多发,推测可能由于多发较为罕见,临床医生认识不足,存在漏诊可能。皮疹颜色大多为红蓝色,仅有1例呈半球形透明样结节改变的血管球瘤患者(图1c),1例下肢呈多发斑疹样改变的病例(图1d),1例指尖皮下结节也较为少见,既往报道极其罕见,临床上也极易误诊,需要临床医师提高警惕(图1b)。诉疼痛的患者在以往其他报道中的占比70%~100%,本研究中诉疼痛的比例高达89%,从而进一步支持了先前报道的结果[7]。在临床症状典型三联征中,针刺样疼痛和寒冷不耐受在本组患者中同样是最具特征的主诉,可以作为诊断该病的线索。
数据表明血管球瘤平均诊断延迟为2~11年[8],极大的影响了患者的生活质量[9]。当甲下或四肢等部位出现皮下结节或暗红色丘疹,同时伴随典型的间歇性剧痛、压痛和冷敏感,此时可进一步行Love和Hildreth测试,如果呈阳性,则高度怀疑血管球瘤。有作者指出,冷敏感试验的特异性、敏感性和准确性最高,约为100%,其次是Love试验,敏感性和准确性分别为100%和78%,Hildreth试验敏感性、特异性和准确性分别为71.4%、100%和78%[10],故临床上建议将这三种检查结合起来,以提高诊断的准确性。常用的影像学检查包括X射线、超声波及磁共振成像(MRI),超声波因成本低,特异性及敏感性优于MRI,故可作为首选[11]。但确诊仍需依靠组织病理检查及免疫组化。
组织病理学上大多数的血管球瘤境界清楚,依据血管球细胞、血管、平滑肌及黏液背景可分为:①经典型:在所有类型中占75%,主要以大片球细胞围绕毛细血管生长,呈巢、片状排列,周围可呈玻璃样变或黏液样的球瘤细胞;②球血管瘤:主要含有血管成分,占所有病例的20%,似海绵状血管瘤,瘤细胞成丛状聚集于血管壁;③球血管肌瘤:约占10% ,主要由血管结构和平滑肌组成;④黏液样型:此型黏液样变明显,可伴水肿;⑤嗜酸细胞型[6]。在我们的研究中,经典型仅有2例,占比13%,而球血管瘤型占比为53%,该统计结果与以往数据差异较大,查阅国内有关血管球瘤的近几年数据,经典型占比在50%~84%,而球血管瘤型占比为6%~33%,大致符合上述占比,但与“利弗皮肤组织病理学”(2019年第一版)和“麦基皮肤组织病理学与临床的联系”第四版中,球血管瘤占60%这一数据差异较大,推测可能存在人种差异,本文研究对象均为亚洲人,球血管瘤占比为53%,与国内相关数据差异较大,推测可能与样本量较小有关,后期需要更大规模样本量来验证;并未发现部位与血管球瘤组织病理分型间的关联。
单发与多发血管球瘤的区别在于,单发血管球瘤常有纤维性结缔组织包膜,肿瘤细胞间含有大量微小的血管腔,其周围包绕着大量血管球细胞,血管腔较多发性血管球瘤更小,血管壁的血管球细胞层数多于多发性血管球,多发性血管球瘤无髓鞘,神经纤维极少或缺如。本文单发血管球瘤中有3例无纤维结缔组织包绕,5例镜下细胞呈多形性,仅1例黏液样型血管球瘤患者可见核分裂象,需要注意的是,当出现核异型性时,需要警惕恶性血管球瘤。恶性血管球瘤临床上十分罕见,故诊断需慎重。目前WHO对其定义为:①肿瘤部位深,直径>2 cm;②有非典型核分裂象;③中~高度核级(核异型性),核分裂象≥5个/50HPF,如果仅细胞有明显核异型性而无其他恶性指征,可诊断为伴异型细胞核的血管球瘤;如果仅体积较大、部位深在,或仅核分裂象丰富但位置表浅,则可诊断为恶性潜能未定的血管球瘤。血管肉瘤具有局部侵袭性,但很少转移[12]。
血管球瘤的免疫表型存在一定的变异,但常表达SMA、Vimentin及IV型胶原,偶尔可表达CD34,而Desmin、CD31、S-100表达一般呈阴性[13]。SMA为平滑肌肌动蛋白,广泛存在于平滑肌细胞;Vimentin为波形蛋白,是正常间叶源性细胞及肿瘤的敏感性标记物,EMA为一种跨膜糖蛋白,广泛分布于上皮细胞及其来源的肿瘤;SMA、Vimentin表达阳性及EMA表达阴性提示该肿瘤来源于间叶组织且含有平滑肌细胞[12,14],CD34表达阳性提示该肿瘤含有血管内皮细胞[15], S-100主要表达于中枢和外周神经胶质细胞[16]。本组SMA、CD34均阳性,而S-100、EMA、CK等均为阴性。与文献报道相一致,也进一步证明其属于平滑肌肿瘤范畴。同样,需要与汗孔瘤鉴别,后者好发于足底或足侧缘,亦可发生于手部、面部、躯干等部位,常呈半球形丘疹、结节或斑块。镜下无瘤细胞围绕血管,呈明显“血管外皮瘤”样结构,免疫组化可部分管腔上皮膜抗原(EMA)和癌胚抗原(CEA)表达阳性[17,18];而神经内分泌肿瘤细胞排列呈实性巢片状,常由纤维血管间质分隔,细胞异型性较血管球瘤细胞要大,核染色质相对较粗、深染,胞质稀少、淡染,免疫组化神经内分泌标记阳性,但不表达SMA。
总之,血管球瘤临床上误诊及漏诊率高,早期诊断需要依靠临床症状、组织形态及免疫组化结果综合判断,完整的手术切除是治疗的最佳选择[19]。

